A magas zsírtartalmú étrend krónikus expozíciója a mielin megzavarását és az interleukin-33 upregulációját váltja ki a hipotalamuszban
Absztrakt
Háttér
A hipotalamusz gyulladása, beleértve az asztrogliózist és a mikroglia aktiválódását, rágcsáló modellekben vagy elhízott egyénekben a magas zsírtartalmú étrend (HFD) bevitele után következik be. Azonban a krónikus HFD táplálkozásának hatása az oligodendrocytákra (OLG), a központi idegrendszer myelintermelő gliapopulációjára továbbra sem tisztázott. Ebben a tanulmányban 8 hetes hím C57BL/6 egereket használtunk HFD-vel 3–6 hónapig krónikus elhízás kiváltására.
Eredmények
A transzmissziós elektronmikroszkópos képalkotó elemzés azt mutatta, hogy a hipotalamusz mielin integritása 4 és 6 hónapos HFD-etetés után megszakadt. Ezenkívül az Iba1 + -mikroglia amoeboid hipertrófiás formájú felhalmozódását folyamatosan megfigyeltük a HFD-vel táplált egerek íves magjában a teljes etetési időtartam alatt. Az interleukin-33 (IL-33) szöveti riasztót a központi idegrendszer sérülése esetén 3 és 4 hónapos HFD-etetés után megnövekedett hipotalamuszszinttel mutatták ki. Ezenkívül az in vitro vizsgálat azt mutatta, hogy az érett OLG-k IL-33-nak való kitettsége károsítja az OLG-sejtek szerkezetét, és csökken a myelin bázikus fehérje expressziója.
Következtetések
Összességében megállapításaink azt mutatják, hogy a krónikus HFD-táplálás kiváltja a hipotalamusz mielin-megszakadását, az IL-33 felfelé történő szabályozással és a hipotalamuszban elhúzódó mikroglia-aktivációval együtt. Tekintettel arra, hogy az exogén IL-33 hozzáadása káros volt az OLG-k érése szempontjából, az IL-33 krónikus HFD-táplálkozással történő növekedése hozzájárulhat a hipotalamusz mielin-rendellenességének kiváltásához.
Háttér
A túlzott táplálékfelvétel és az elégtelen energiafogyasztás okozta elhízás a kritikus tényezővé vált a szív- és érrendszeri betegségek és a metabolikus szindróma kialakulásában. A központi idegrendszer (CNS) idegsejtjeinek elhízás által okozott károsodása és a vér-agy gát integritása (BBB) növeli a stroke és az Alzheimer-kór kiváltásának kockázatát [1, 2]. Tekintettel arra, hogy a hipotalamusz felelős a táplálékfelvétel és az energiafogyasztás szabályozásáért a leptin és az inzulin hatásán keresztül [3], a hipotalamusz neuronális és gliafunkcióinak homeosztázisában történő fenntartása fontos az elhízással összefüggő betegségek kialakulásának megakadályozásában.
Az elhízott egyének perifériás szöveteinek alacsony fokú gyulladását jól sikerült kezelni [4,5,6,7]. A hipotalamusz gyulladása az elhízás vagy a magas zsírtartalmú étrend (HFD) táplált állatok genetikailag módosított állatmodelljeiben is előfordul [5, 8,9,10]. Beszámoltak arról, hogy a proinflammatorikus citokinek és kemokinek (azaz IL-1β, TNF-α és IL-6) növekedését figyelték meg a hipotalamuszban az akut (órás) és a szubakut (hetes) időpontokban a HFD etetése után [11, 12]. A mikroglia és az asztrociták aktivációja, amelyet gliózisnak neveznek, köztudottan kritikus szerepet játszik a HFD által kiváltott leptinnel és inzulinnal szembeni rezisztencia szabályozásában az energia homeosztázis zavarával társulva [11,12,13,14]. Az oligodendrocyták (OLG), a mielint termelő gliapopuláció elvesztését a központi idegrendszerben (CNS) a gerincvelőben a HFD-etetés után 7 héttel észlelték [15]. A hipotalamuszos OLG-k krónikus HFD-táplálkozásra adott válaszáról azonban még keveset tudni.
A vizsgálat célja a hipotalamuszos OLG-k krónikus HFD-táplálkozásra adott válaszának vizsgálata volt, felhasználva a metabolikus rendellenességek bevett állati modelljét a HFD táplálásával az inzulinrezisztencia és a lipid-anyagcsere megzavarása érdekében [16]. A tanulmány elsőként mutatta meg a mielin mikrostruktúrájának megszakadását a hátsó laterális hipotalamusz területén a HFD táplálás későbbi időpontjaiban. Alternatív megoldásként az interleukin-33 (IL-33) celluláris alarminként működik [17], és arról számoltak be, hogy az IL-33 kritikus tényező az MS fejlődésében a központi idegrendszer mielinizációjának gátlásán keresztül [18]. Érdekes módon azt tapasztaltuk, hogy a krónikus HFD-etetés után az IL-33 növekedett a hipotalamuszos OLG-kban és az asztrocitákban. In vitro vizsgálatunkkal összefüggésben, miszerint az érett OLG-k IL-33-nak való kitettsége az OLG morfológia károsodását idézte elő, az eredmények azt sugallják, hogy a HFD-etetés után a hipotalamuszban a myelin mikrostruktúrájának károsodása részben az IL-33 molekulák által fokozott krónikus HFD táplálás.
Eredmények
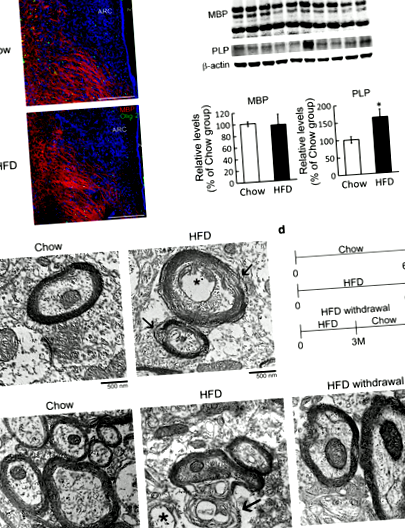
Krónikus HFD táplálkozás által kiváltott változás a hipotalamusz mielin mikrostruktúrájában
Mégis, a megszakadt mielinhüvelyt az etetés után 6 hónappal folyamatosan kimutatták a hipotalamuszban (1e. Ábra, nyilak). Mivel a mielin-szerkezet integritását a hipotalamusz régióban kevésbé befolyásolta a HFD-táplálás 3 hónapon belül (1. kiegészítő fájl: S2. Ábra), azt követtük, hogy megvizsgáljuk, hogy a HFD megvonása ebben az időpontban megakadályozhatja-e a mielin szerkezetének megzavarását a hipotalamuszban . Így elvégeztük azokat a kísérleteket, amelyek során a HFD megvonási csoportba tartozó egereket az első 3 hónapban HFD, majd további 3 hónapig Chow táplálta (1d. Ábra). Testtömegük jelentősen csökkent, miután étrendjüket Chow-ra változtatták (1. kiegészítő fájl: S3A ábra). Sőt, vízfogyasztásuk és táplálékfelvételük sokkal később visszatért a Chow csoport szintjére (1. kiegészítő fájl: S3B és C ábra). Ezenkívül a HFD megvonási csoportból származó hipotalamusz szövet mielinstruktúrája ugyanolyan kompakt volt, mint a Chow csoportban megfigyelhető (1e. Ábra). Ezek az eredmények azt mutatják, hogy a krónikus HFD-táplálás károsíthatja a hipotalamusz mielin mikrostruktúráját, és ezt a rendellenességet meg lehet akadályozni, ha a HFD-t a szokásos étrendre változtatják a korábbi időpontban.
Microglia aktiváció hipotalamusz ARC-ben krónikus HFD táplálással
IL-33 upreguláció a hipotalamuszban krónikus HFD táplálással
Az IL-33, az IL-1 gén szupercsalád egyik tagja, amely számos gyulladt betegségben kettős funkciót tölt be, például szív- és érrendszeri betegségek, allergia, sclerosis multiplex (SM), stroke és Alzheimer-kór [20, 21]. Az IL-33 fehérjéket főleg a hipotalamusz GFAP + -asztrociták (3a. Ábra, nyilak) és az Olig2 + -OLG (3a. Ábra, nyilak) sejtmagjaiban detektálták, az Iba1 + -microglia azonban nem. Megállapítottuk továbbá, hogy a HFD-vel való táplálás 3 és 4 hónapig az IL-33 fehérjék upregulációját eredményezte a hipotalamuszban (3b. Ábra). Ezzel párhuzamosan az immunfluoreszcencia eredményei azt mutatták, hogy a hipotalamuszban az IL-33 + -ot expresszáló sejtek növekedtek a HFD-etetés után 4 hónappal Olig2 + -OLG-k (3d. Ábra, nyilak), valamint GFAP + -asztrociták (3c. Ábra, nyilak). Azt is észrevettük, hogy a hipotalamusz asztrociták hipertrófiás formát mutatnak a krónikus HFD táplálkozás hatására (3c. Ábra, nyílhegyek). Tekintettel arra a tényre, hogy az OLG-k és az asztrociták alarminként szabadítják fel az IL-33-at a központi idegrendszeri károsodásokra reagálva [22, 23], eredményeink arra utalnak, hogy a krónikus HFD-táplálás kiváltja a hipotalamusz IL-33 expresszióját OLG-kban és asztrocitákban, ami egy kritikus tényező a mikroglia reaktivitásának közvetítésére a hipotalamuszban.
Az IL-33-nak való kitettség az oligodendrocita folyamatok károsodását eredményezi
Beszámoltak arról, hogy az IL-33 gátolja a központi idegrendszer mielinizációját és szabályozza az SM kialakulását [18]. Ennek megfelelően in vivo eredményeink felvetették annak lehetőségét, hogy a krónikus HFD táplálás után az IL-33 növekedése a hipotalamuszban közvetítheti a hipotalamusz mielin integritásának megzavarását krónikus HFD táplálás során. Így az in vitro kísérleteket primer egér OPC-kből származó érett OLG-k alkalmazásával végeztük annak megvizsgálására, hogy az IL-33 indukálta-e az érett OLG-k morfológiai változását. A várakozásoknak megfelelően az eredmények azt mutatták, hogy az IL-33-nak való 24 órás expozíció csökkentette az OLG összekapcsolt szövedék alakjának bonyolultságát (4a. Ábra, nyilak). Ezenkívül az IL-33 szignifikánsan csökkentette az MBP + -OLG-k számát a tenyészetekben és csökkentette az MBP + -OLG sejtméretet (4a. Ábra). Ezenkívül az MBP fehérje szintjét a tenyészetben az IL-33-mal végzett kezelést követően csökkentették (4b. Ábra). Hasonlóképpen, az érett patkány OLG-k IL-33-nak való kitettsége jelentős változásokat okozott az MBP + -OLG-k folyamat-összekapcsolásában (1. kiegészítő fájl: S5. Ábra). Az eredmények azt mutatják, hogy az IL-33 egy romboló molekula az érett OLG-k morfológiai szerveződéséhez.
Vita
Adataink azt mutatják, hogy a mielin mikrostruktúrájának integritása a hipotalamusz régiójában károsodott a krónikus HFD táplálás után, ami azt jelzi, hogy a mielin sérülés a HFD táplálás utáni későbbi időpontban következik be, mint a mikroglia aktivációja. Ezenkívül az IL-33 növekedését, amely főként asztrocitákban és OLG-kben expresszálódik, a hipotalamuszban a HFD táplálás után 3 és 4 hónappal indukálták. Az IL-33 hozzáadása érett OLG-hez a tenyészetben gyengítette az OLG sejtméretet és az MBP expressziót.
Következtetések
Összefoglalva, ez az első olyan tanulmány, amely kimutatta, hogy a hipotalamusz mielin megzavarása és a glia eredetű IL-33 upregulációja összefüggött a HFD által kiváltott elhízással. Jövőbeni tanulmányunk az IL-33 szerepének boncolgatása a krónikus HFD táplálással összefüggő hipotalamusz neuropatogenezisben.
Mód
Állatok
Valamennyi állatkísérletet az ARRIVE irányelvek (Animal Research: Reporting In Vivo Experiments) szerint hajtották végre. Az állatok gondozását és felhasználását a Tajvan, Tajvan, Nemzeti Cheng Kung Egyetem Intézményi Állattenyésztési és Felhasználási Bizottsága jóváhagyta (IACUC jóváhagyási szám: 106060). Nyolc hetes hím C57BL/6 egereket (19,91 ± 0,29 g) a National Cheng Kung Egyetem Laboratóriumi Állatközpontból (http://www.ncku.edu.tw/animal/eng/nckulac.html) nyertünk, és az egyes ketrecek (ketrecenként pár), ingyenes hozzáféréssel a normál étrendhez (Laboratory Rodent Diet # 5001; LabDiet, St. Louis, MO, USA) vagy HFD-hez (Rodent Purified Diet # 58Y1; TestDiet, St. Louis, MO, USA). Az egereket normál étrenddel vagy HFD-vel etettük (1. kiegészítő fájl: S1 táblázat) a különböző időtartamokra (3., 4. és 6. hónap). A HFD 61,6% kcal zsírokat tartalmaz, 18,1% fehérjét és 20,3% szénhidrátot tartalmaz. Az állatokat (2 állatot egy ketrecben) normál szobai körülmények között (szobahőmérséklet: 23 ± 2 ° C; páratartalom: 58 ± 2%; 12 órás fény/sötét ciklus) helyeztük el szabadon az ételhez és a vízhez szabadon hozzáférve. Az állatokat különböző időpontokban feláldoztuk (1. kiegészítő fájl: S1 táblázat), intraperitoneális (i.p.) injekcióval Zoletil 50 (Virbac Taiwan Co., Ltd.; ötszörös hígítás sóoldatban, 0,05–0,06 ml/10 g).
Elsődleges oligodendrocita prekurzor sejtek (OPC) előállítása
Western blot elemzés
A sejteket lízispufferben (1% tritonX-100, 0,05% Tween-20 PBS-ben) lizáltuk, amely proteáz inhibitor koktélt tartalmaz (Thermo Scientific, Cat # 78443). A hipotalamusz szöveteket eltávolítottuk az állatokból, és proteáz inhibitor koktélt tartalmazó T-PER szövetfehérje extrakciós reagenssel (Thermo Scientific, Cat # 78510) lizáltuk. 100 μg összfehérjét töltöttünk 10 vagy 15% SDS-PAGE-ra, és egy nitrocellulóz membránra vittük át. A nitrocellulóz membránokat egy éjszakán át, 4 ° C-on primer antitestekkel immunblotoltuk (1. táblázat). A membránt ezután peroxidázzal konjugált szekunder antitestekkel inkubáltuk 60 percig szobahőmérsékleten. Az immunreaktív fehérjéket ECL regens alkalmazásával detektáltuk, és Super RX-NC filmekkel (Fuji, Japán) tettük láthatóvá. A Western Lightning® Plus-ECL fokozott kemilumineszcens szubsztrát a PerkinElmer Life Sciences-től (Boston, MA, USA) volt.
Immunfluoreszcencia
Az agyszöveteket 4% PFA-val egy éjszakán át utólag rögzítettük, majd 30% (w/v) szacharózban PBS-ben krioprotektáltuk. A szöveteket 20 μm vastagságú metszetekkel ágyazottuk be a Tissue Tek optimális vágási hőmérsékletű vegyületébe (Electron Microscopy Sciences, Torrance, CA, USA). A szabadon lebegő koronális agymetszeteket 1% TritonX-100-mal kezeltük PBS-ben 4 ° C-on egy éjszakán át, és az elsődleges antitestekkel 0,1% TritonX-100-at és 1% lószérumot tartalmazó PBS-ben inkubáltuk 4 ° C-on egy éjszakán át. A szöveteket ezt követően megfelelő biotinilezett szekunder antitestekkel inkubáltuk 1 órán át, majd az Alexa488/Cy3-avidin (1: 200) elegyet 45 percig. A kettős immunfluoreszcencia céljából a második primer antitesttel történő inkubálás után Alexa488/Alexa594-szekunder antitesteket (1: 200) adtunk hozzá 1 órán át. Alternatív megoldásként a sejteket 4% PFA-val rögzítettük 10 percig, és 0,1% Triton-X100-ot tartalmazó PBS-ben inkubáltuk 30 percig. A tenyészeteket egy éjszakán át inkubáltuk 4 ° C-on primer antitestekkel. Az immunfestett szöveteket és az OLG-ket ezután DAPI nukleáris ellenfestésnek vetettük alá. A festést egy Olympus FLUOVIEW FV1000 konfokális lézeres letapogató mikroszkóppal (Olympus, Japán) figyeltük meg 405, 488 vagy 594 nm lézerekkel. A vizsgálatban használt antitesteket és biotinilezett szekunder antitesteket az 1. táblázat tartalmazza.
TEM képalkotás
Az egereket 0,9% sóoldattal és 2% glutáraldehidet és 2% PFA-t tartalmazó fixációs oldattal 0,1 M foszfátpufferben perfundáltuk. A hipotalamusz szövetének 1 mm 3 -es darabjait, amelyeket a hipotalamusz ARC területéhez mellékelt laterális régióból készítettünk (1. kiegészítő fájl: S1 ábra), 100 nm vastagságban metszettük Hitachi HT-7650 transzmissziós elektronmikroszkópos képalkotó rendszerhez (Tokió, Japán) üzemelteti a Nemzeti Egészségügyi Kutatóintézetek (NHRI, Tajvan) központi létesítménye.
A mikroglia számának és a sejt testének meghatározása
Az Iba1 + vagy CD11b + mikroglia morfológiai megfigyelései mellett a hipotalamuszban a mikroglia aktiválását a mikroglia számának és a sejt testméretének NIH ImageJ elemző szoftverrel történő mérésével értékeltük. Az agyszakaszonként öt, véletlenszerűen kiválasztott képet egyesítettünk, több lépésben, 1 μm vastagságban, Olympus FLUOVIEW FV1000 konfokális lézeres letapogató mikroszkóppal. A hipotalamusz ARC régióit tartalmazó öt agymetszetet minden csoportban két állattól gyűjtöttünk minden időpontban. Az Iba1 + mikroglia számát és az Iba1 + mikroglia átlagos sejt testméretét a hipotalamusz ARC régióiban (1. kiegészítő fájl: S1 ábra) számszerűsítettük.
Az oligodendrocita morfológiai változás értékelése
Öt, véletlenszerűen mintavett képet készítettünk minden tenyészettől 40x objektíves epifluoreszcens mikroszkóppal. Ezenkívül a tenyészetekben lévő MBP + -OLG-kat (kezelésenként összesen 1000 sejt) számszerűsítettük, és a tenyészetben lévő MBP + -OLG-sejtek méretét (kezelésenként összesen 100 sejtet) mértük NIH ImageJ elemző szoftver (RRID) segítségével: SCR_003070). Az eredményeket a citokinnal kezelt tenyészetben a vivőanyag-tenyészethez viszonyítva kapott adatok százalékában adjuk meg.
Kvantitatív valós idejű polimeráz láncreakció (QPCR)
Statisztikai analízis
A két csoport (Chow és HFD) közötti, ebben a vizsgálatban megfigyelt jelentős különbségeket egyetlen időpontban kétfarkú Student's t teszt. Mindegyik érték öt állat csoportonként átlagosan ± SEM (MBP és PLP expresszió), minden állatonként három állat állatcsoportonként (IL-33 expresszió), öt agyi szakasz, amelyek hipotalamusz ARC régiókat tartalmaznak (Iba1 és CD11b immunfluoreszcencia), és három ismételt kísérlet a három készítmény által előállított OLG tenyészetek felhasználásával (in vitro vizsgálat). A statisztikai szignifikanciát *o
Az adatok és anyagok rendelkezésre állása
Ennek a tanulmánynak az adatkészletei a megfelelő szerzőtől kérésre beszerezhetők.
- A krónikus, magas zsírtartalmú étrend szív hipertrófiát és fibrózist vált ki egerekben
- Dr. Bernstein; s magas fehérjetartalmú étrend nincs szénhidrát senki rajta Diabetes napi fórumok
- Diéta diagram magas vérnyomású betegek számára, magas vérnyomás diéta diagram Lybrate
- A krónikus kismedencei fájdalommal küzdő férfiak étrendválasztása és életmódbeli tényezői - interstitialis
- Dukan-étrend Magas fehérjetartalmú étrend, amely segít a fogyásban és az életben tartásában,