A macskák máj lipidózisának kezelésére szolgáló lehetséges gyógyszerek azonosítása in vitro macska máj organoid rendszerrel
Biokémiai és Sejtbiológiai Tanszék, Állatorvos-tudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Biokémiai és Sejtbiológiai Tanszék, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Biokémiai és Sejtbiológiai Tanszék, Állatorvos-tudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Biokémiai és Sejtbiológiai Tanszék, Állatorvos-tudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Biokémiai és Sejtbiológiai Tanszék, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Levelezés
J. Bernd Helms, Biokémiai és Sejtbiológiai Tanszék, Állatorvostudományi Kar, Utrechti Egyetem, Yalelaan 2, 3584 CM Utrecht, Hollandia.
Biokémiai és Sejtbiológiai Tanszék, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Biokémiai és Sejtbiológiai Tanszék, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Biokémiai és Sejtbiológiai Tanszék, Állatorvos-tudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Biokémiai és Sejtbiológiai Tanszék, Állatorvos-tudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Biokémiai és Sejtbiológiai Tanszék, Állatorvos-tudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Levelezés
J. Bernd Helms, Biokémiai és Sejtbiológiai Tanszék, Állatorvostudományi Kar, Utrechti Egyetem, Yalelaan 2, 3584 CM Utrecht, Hollandia.
Finanszírozási információk: Winn Feline Foundation, támogatás/díj száma: W17-015
Absztrakt
Háttér
A máj lipidosis gyakorisága növekszik a nyugati világban, a macskák különösen érzékenyek. Amikor a macskák abbahagyják az evést és elkezdik felhasználni zsírtartalékaikat, a szabad zsírsavak (FFA-k) növekednek a vérben, ami a májban triacil-glicerin (TAG) felhalmozódását okozza.
Célkitűzés
A macskák máj lipidózisának kezelésére alkalmazható új gyógyszerek azonosítása macskák máj organoid rendszerével.
Állatok
Májorganoidok 6 macskától.
Mód
Nyolc különféle gyógyszert teszteltek, és a 2 legígéretesebbet tovább tanulmányozták kvantitatív TAG assay, lipid csepp festés és qPCR alkalmazásával.
Eredmények
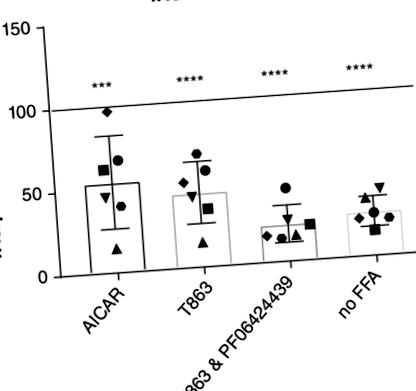
A T863 (diacilglicerin-O-aciltranszferáz 1 [DGAT1] inhibitor) és az 5-amino-imidazol-4-karboxamid 1-P-D-ribofuranozid (AICAR; egy adenozin-monofoszfát-kináz aktivátor) 55% -kal csökkentette a TAG felhalmozódását (P
Következtetések és klinikai jelentőség
Két lehetséges gyógyszert azonosítottak a máj lipidosisának kezelésében macskáknál. A T863 gyógyszer gátolja a DGAT1-et, jelezve, hogy a DGAT1 az elsődleges enzim, amely felelős a macskaorganoidokban lévő külső zsírsavakból származó TAG-szintézisért. Az AICAR gyógyszer csökkentés révén lipidszint-csökkentő vegyületként működhet PLIN2 mRNS. A májorganoidok felhasználhatók in vitro eszközként a fajspecifikus rendszerben végzett kábítószer-teszteléshez, és megalapozzák a steatosis kezelésére szolgáló gyógyszerek további klinikai tesztelését.
Rövidítések
1. BEMUTATKOZÁS
2. ANYAGOK ÉS MÓDSZEREK
2.1 Sejtkultúra
2.2 Kábítószerek
A gyógyszereket (lásd a célokat és a referenciákat az S1 táblázatban) feloldottuk dimetil-szulfoxidban, és az irodalomban leírt koncentrációkban használtuk. A kezdeti szűrés abból állt, hogy differenciálatlan macska májorganoidokat tenyésztettünk 3 donortól az S1 táblázatban említett gyógyszerek jelenlétében vagy hiányában, valamint további zsírsavak jelenlétében a lipidfelhalmozódás serkentésére. A TAG-mennyiséget a TAG-esszével alkalmaztuk. Azokat a gyógyszereket, amelyek gátolták a TAG felhalmozódását 3 macska organoidjaiban, további vizsgálatokhoz választottuk ki. A kiválasztott gyógyszerek és a kezdeti szűrés után alkalmazott koncentrációk az 5-amino-imidazol-4-karboxamid 1-β-D-ribofuranozid (AICAR; Sigma) 2 mM, T863 (Sigma) 20 μM koncentrációban és a PF 06424439 ( Sigma) 50 μM koncentrációban. Az organoidokat 24 órán át tenyésztettük további zsírsavak és gyógyszerek (vagy vivőanyag-kontrollok) jelenlétében a mintavétel előtt.
2.3. Triacil-glicerin assay
A mintákat ultrahanggal kezeltük, és a minta 10% -át használtuk fel a fehérjekoncentráció mérésére normalizálási célokra Pierce bicinchonininsav Protein Assay Kit (ThermoFisher Scientific, Waltham, Massachusetts) segítségével. A másik részt lipidek extrahálására használtuk egy korábban leírt módszer szerint. 10 mintát metanollal mostunk, hogy megakadályozzuk a kloroformmal való szennyeződést, és nitrogéngáz alatt szárítottuk. A TAG mennyiségi meghatározást TriglyceridesLiquiColor monokészlet (HUMAN, Wiesbaden, Németország) alkalmazásával végeztük, standardként trioleint használva. A Triglycerides Liquicolor assay reagenssel 90 percig rázó vízfürdőben végzett inkubálás után a TAG-t spektrofotométerrel, mikrotányér-olvasóval mértük 540 nm kihalás mellett (Molecular Devices, VersaMax, Sunnyvale, Kalifornia).
2.4. RNS izolálás és kvantitatív PCR
A minta RNS-t RNeasy Micro Kit (Qiagen, Hilden, Németország) alkalmazásával izoláltuk, egy oszlopon lévő DNase-I kezelést alkalmazva a gDNS szennyeződés minimalizálása érdekében. Ezt követően a cDNS-t egy iScript cDNS szintézis készlet segítségével szintetizáltuk (Bio-Rad, Hercules, Kalifornia). A PCR-amplifikációkat Bio-Rad detektáló rendszerrel hajtottuk végre iQ SYBR Green Supermix (Bio-Rad) alkalmazásával. Az olvadásgörbe és a szekvenciaelemzés megerősítette az amplikon specifitását, és a relatív expressziós szinteket normalizálták a tirozin-3-monooxigenáz/triptofán-5-monooxigenáz aktivációs fehérje, a zeta referenciagének felhasználásával (YWHAZ), az S5 riboszomális fehérje (RPS5), hipoxantin-foszforibozil-transzferáz (HPRT ‐ 1) és a hidroxi-metil-bilán-szintáz (HMBS). A kérdéses gének PCR-amplifikálásához használt primereket és a referencia-gének primereit az S2 táblázat mutatja.
2.5 Teljes szerelésű organoidok fluoreszcens képalkotása
Az organoidokat gondosan eltávolítottuk a Matrigel-ből, és 10% semleges pufferolt formalinnal rögzítettük. Az atommagokat 30 μg/ml Hoechst 33342-vel (Molecular Probes, Paisley, Egyesült Királyság), a lipidcseppeket 0,1 μg/ml LD540-rel (lipofil festékkel, Christoph Thiele szívesen szolgáltatta) festettük. A rögzített organoidokat 15 percen át inkubáltuk a színezékekkel foszfáttal pufferolt sóoldatban, és a szerves mosást követően FluorSave-be (Calbiochem, Billerica, Massachusetts) szereltük fel. A képeket Leica TCSSPE ‐ II konfokális mikroszkóppal készítették a Celluláris Képalkotás Központjában (Állatorvos-tudományi Kar, Utrechti Egyetem, Hollandia).
2.6 Statisztika
A statisztikai elemzésekhez kétirányú varianciaanalízist végeztek Dunnett többszörös összehasonlító tesztjével, a kezelést és a macskát 2 szintként.
3 EREDMÉNYEK
A palmitát és az oleát hozzáadása a macska organoidjaihoz a TAG és a lipid cseppek felhalmozódását eredményezte, amint azt fluoreszcens mikroszkóppal és fluoreszcensen aktivált sejtek szortírozásával (FACS) elemeztük. A TAG felhalmozódásának számszerűsítése négyszeres (± 1,3, P És S1 ábra).
Mivel a differenciált organoidok még szorosabban utánozhatják az in vivo májat, 3 különböző donor organoidjai differenciálódtak a hepatocita törzs felé. A differenciálást qPCR segítségével igazoltuk (3A. Ábra). Az őssejt marker leucinban gazdag, ismétlődést tartalmazó G fehérjéhez kapcsolt 5 receptor expressziója csökkent és a máj markerek expressziója transztiretin és CYP3a132 megnövekedett. Az alapvető TAG-koncentrációk (FFA-k és gyógyszerek hozzáadása nélkül) növekedtek az organoidokban a differenciálódás után, összehasonlítva a differenciálás előtti organoidokkal (3B. Ábra). Amikor a differenciálódott organoidokat AICAR-mal és T863-mal kezelték, az eredmények hasonlóak voltak a differenciálatlan organoidokéihoz. Az AICAR-kezelés 45% -kal csökkentette a TAG felhalmozódását (P =, 006), és a T863-mal végzett kezelés 52% -kal csökkentette a TAG felhalmozódását (P = .002; 3C. Ábra).
Az a mechanizmus, amellyel a T863 valószínűleg csökkenti a TAG felhalmozódását, az a cél, a TAG-szintetizáló DGAT1 enzim gátlása. Kevésbé nyilvánvaló az a mechanizmus, amellyel az AMP kináz aktivátor AICAR csökkenti a TAG-t. A perilipin 2 (PLIN2, más néven zsírszegény differenciálódással kapcsolatos fehérje) a lipidcseppekben jelen lévő fehérje, és ismert, hogy stabilizálja a lipidcseppeket. A PLIN2 génexpressziója növekszik a tápközeghez zsírsavak hozzáadásával. 8 Ezért megmértük a PLIN2 Az mRNS koncentrációja qPCR alkalmazásával megállapította, hogy az AICAR-val végzett kezelés jelentősen csökkentette az expressziót PLIN2 lipiddel töltött organoidokban (4. ábra). Ilyen körülmények között, PLIN2 az expresszió statisztikailag nem különbözött további zsírsavak hiányában végzett inkubálástól. Ez a hatás az AICAR-ra volt specifikus, mivel a másik TAG-csökkentő T863 gyógyszer nem befolyásolta jelentősen PLIN2 mRNS-koncentrációk. A differenciált és a differenciálatlan organoidok egyaránt hasonlóan viselkedtek (P =, 57; 4. ábra).
4. MEGBESZÉLÉS
A macska máj organoid rendszerét sikeresen alkalmazták a máj lipidózisban szenvedő macskák kezelésében potenciálisan hasznos gyógyszerek azonosítására. Mind a T863 (egy DGAT1-gátló), mind az AICAR (egy AMP-kináz aktivátor) csökkentette a TAG felhalmozódását mind a felnőtt máj őssejtjeinek a hepatocita vonal felé történő differenciálódása előtt, mind az után. Az a tény, hogy a differenciálatlan májorganoidok hasonló eredményeket hoztak, mint a differenciált organoidok, megerősíti a differenciálatlan májorganoidok felhasználását a jövőbeni gyógyszerszűrések és mechanisztikusabb vizsgálatok során, ezáltal csökkentve a kísérletekhez szükséges időt és erőforrásokat, valamint arra a következtetésre jutva, hogy ezek a szerek ígéretesek jelölt gyógyszerek klinikai alkalmazásra.
Két enzimről ismert, hogy katalizálják a TAG diacilglicerinből (DAG) és zsíros acil-CoA-ból történő képződésének utolsó lépését: DGAT 1 és 2. A diacilglicerin O-aciltranszferáz 1 knock-out egerek életképesek, ellentétben a DGAT2 knock-out egerekkel . Sőt, a DGAT1-hiányos egerek ellenállnak a magas zsírtartalmú étrend okozta elhízásnak, és fokozott érzékenységet mutatnak az inzulinra. 11, 12 Védettek az exogén zsírsavak által kiváltott máj lipidózistól, akár magas zsírtartalmú étrend, akár éhgyomor miatt. A májspecifikus és az általános leütés egyaránt védelmet nyújtott a máj lipidosisával szemben. 13 Számos DGAT1 gátlót fejlesztettek ki, a T863 az egyik közöttük. A DGAT1 inhibitorok egereknek történő beadása a szérum és a máj TAG-értékeinek csökkenéséhez vezetett, elhízott egereknél súlycsökkenést és fokozott inzulinérzékenységet eredményezett. 14, 15 Míg az egerek nagyon jól tolerálják a DGAT1-gátlókkal történő kezelést, az emberen végzett klinikai vizsgálatok mindegyike összefüggésbe hozta a gyomor-bélrendszeri káros hatásokat, elsősorban a súlyos hasmenést. Ezt a faji különbséget az okozhatja, hogy az embereknek hiányzik a vékonybélben a DGAT2 expressziója. 16 Hogy a DGAT2 expresszálódik-e a macska belében, nem ismert.
Macskamodellünkben a DGAT1 inhibitor csökkentette a TAG felhalmozódását, míg a DGAT2 inhibitor nem. Ez a megfigyelés azt sugallja, hogy a DGAT1 elsősorban a TAG külső zsírsavakból történő szintetizálásában fontos. Ez a következtetés összhangban van egy korábban leírt modellrendszerrel, 13 bemutatva a DGAT1 szerepét az exogén zsírsavakra adott válaszban. A DGAT1 és DGAT2 inhibitorok kombinációjának beadása a TAG felhalmozódásának erősebb gátlását eredményezte, mint egyedül a DGAT1 inhibitor. A DGAT2 potenciálisan részt vehet a rendszerünk TAG-szintézisében, amelyben a DGAT1 képes kompenzálni a DGAT2 gátlását, de nem fordítva. Az is lehetséges, hogy a DGAT2 csak akkor válik aktívvá, ha nincs DGAT1 tevékenység.
Mint minden olyan gyógyszer esetében, amely zavarja a TAG szintézisét és felhalmozódását, az FFA-k által okozott lipotoxicitás is óvatosságra adhat okot a máj lipidózisban szenvedő macskák DGAT1 inhibitorok alkalmazásával történő kezelésében. Mivel máj lipidózisban szenvedő macskáknál az FFA koncentráció és a véráramlás magas, a TAG képződésének megakadályozása a zsírsavak más szövetekbe történő áttelepedését vagy a zsírsavak lebontását okozhatja. Az FFA-k felhalmozódása csak akkor okozhat citotoxicitást, ha nincs elegendő kapacitás a zsírsavak oxidálására. Ezenkívül a DGAT1 részt vesz a mitokondriális funkció védelmében azáltal, hogy megakadályozza az éhezés által kiváltott autofágia során fellépő lipotoxicitást. 17 Hasonlóképpen, a DGAT1-ről beszámoltak arról, hogy a lipolízis során megvédi az adipociták endoplazmatikus retikulumát a lipotoxicitástól azáltal, hogy a felszabadult FFA-k egy részét visszacsomagolja a TAG-ba. 18.
Bár az egerek jól tolerálják a DGAT1 gátlását, az embereknél megfigyelt káros gasztrointesztinális hatások és a megnövekedett lipotoxicitás lehetősége óvatosságra utal a máj lipidózisban szenvedő macskák kezelésében. Tudomásunk szerint a DGAT1 gátlókat macskáknál korábban nem alkalmazták, ezért e faj esetleges káros in vivo hatásai nem ismertek.
Eredményeink azt mutatják, hogy csökken a PLIN2 az AICAR-kezelés után. A perilipin 2 a lipidcseppekben jelen lévő fehérje, amelyről ismert, hogy befolyásolja a lipidtartalmat a lipidcseppekben. A PLIN2 leütése egerekben csökkenti a lipidcseppek méretét és számát, és csökkenti az összes TAG mennyiséget az egerek májában. A leütés megvédi a máj lipidózisát, amelyet az egerek magas zsírtartalmú étrendje okoz. 26, 27 A PLIN2 jelenlétét lipidcseppeken javasolták a lipidcseppek megvédésére az autofágia általi lebontástól. 26 A PLIN2 fehérjét az AMPK foszforilezheti, ezután a chaperone által közvetített autofágia a lizoszómákban történő lebontásra irányul. 28 A PLIN2 eltávolítása után a lipidcseppek hajlamosak a citoszolos lipázok vagy a makroofágia által történő lebontásra. 29 Eredményeink azt mutatják, hogy a PLIN2 zsírsavak tápközeghez történő hozzáadásakor növekszik, és ezt a növekedést megakadályozza az AICAR kezelés, de a T863 kezelés után nem szignifikánsan. Meg kell még határozni, hogy az AICAR közvetlenül vagy közvetve cselekszik-e PLIN2 kifejezés.
Összefoglalva, 2 potenciális gyógyszert azonosítottak máj lipidózisban szenvedő macskák kezelésében. A T863 gyógyszer gátolja a DGAT1-et, jelezve, hogy a DGAT1 az elsődleges enzim, amely felelős a macskamáj organoidjainak külső zsírsavakból származó TAG-szintéziséért. Az AICAR hatóanyag csökkentésével lipidszint-csökkentő vegyületként működhet PLIN2 mRNS expresszió. Vizsgálatunk megmutatja a macska felnőtt őssejtjeinek in vitro eszközként való felhasználásának lehetőségét egy fajspecifikus rendszerben végzett gyógyszeres teszteléshez, és megalapozza ezen steatosis-csökkentő gyógyszerek további klinikai tesztelését.
KÖSZÖNETNYILVÁNÍTÁS
Ezt a tanulmányt a Winn Feline Foundation támogatta (támogatás száma: W17-0115). Köszönjük Ingrid Vernooij-nak, hogy kísérleti kísérleteket végzett a projekt során.
- A máj adenoma tünetei, típusai, kezelése és egyebek
- Nyolc agronómiai tulajdonságot meghatározó helyek azonosítása GBS ‐ GWAS megközelítéssel és validálás
- A máj adenoma okai, tünetei, diagnózisa és kezelése
- IRIS Vese - Oktatás - Hányás, émelygés és fogyatékosság kezelése krónikus vese macskáknál
- Májbetegség macskáknál - Macskabetegségek Hill s Pet