A MAP4K4 és IL-6 + Th17 sejtek fontos szerepet játszanak nem elhízott 2-es típusú cukorbetegségben
Absztrakt
Az elhízás a 2-es típusú cukorbetegség (T2D) ok-okozati tényezője; azonban az elhízás nélküli emberek (beleértve a sovány, normális testsúlyt vagy a túlsúlyt) továbbra is kialakíthatják a T2D-t. A nem elhízott T2D Ázsiában elterjedt, és Európában is gyakran előfordul. Nemrégiben több bizonyíték ellenzi azt az elképzelést, hogy az elhízás vagy a központi elhízás (zsigeri zsírfelhalmozódás) elősegíti a nem elhízott T2D-t. Számos tényező, például gyulladás és környezeti tényezők járulnak hozzá az elhízott T2D kialakulásához. A gén kiütéses egerekből és az ázsiai és európai klinikai mintákból származó adatok szerint a nem elhízott T2D patogenezisét a közelmúltban mutatták be. A T-sejtekben a MAP4K4 downregulációja fokozza az IL-6 + Th17 sejtpopulációt, ami inzulinrezisztenciához és T2D-hez vezet mind humán, mind egerekben. Ezenkívül a MAP4K4 egy nukleotid polimorfizmusai és az epigenetikai változások társulnak a T2D betegekkel. A MAP4K4 génvariánsok és a környezeti tényezők közötti kölcsönhatások hozzájárulhatnak a MAP4K4 csillapításához a T-sejtekben, ami nem elhízott T2D-hez vezet. A nem elhízott T2D patogenezisének jövőbeni vizsgálata precíziós gyógyszer kifejlesztéséhez vezet a nem elhízott T2D számára.
Háttér
Fő szöveg
A nem elhízott T2D megértésének hiánya
A nem elhízott vagy sovány T2D populációját alábecsülni lehet az egész világon. A nem elhízott T2D betegeknél szignifikánsan magasabb a „nem elfogadja a cukorbetegséget” pontszám, mint az elhízott betegeknél; sok vékony ember nem gyanítja, hogy T2D-je van [4]. Nevezetesen a nem elhízott T2D-s betegeknél mind a szívbetegségek kockázata megnő, mind az inzulinkezelés gyorsabban halad az elhízott T2D-betegeknél [1, 5, 6]. Továbbá „a nem elhízott tizenévesek a T2D áldozatává válnak”. Ázsiai kor Nem szabad figyelmen kívül hagyni, hogy számos nem elhízott vagy karcsú ember szenved T2D-ben.
A mai napig a legtöbb figyelmet és forrást az elhízás okozta T2D tanulmányozására irányították. A nem elhízott T2D patogenezise azonban nem mutatható ki könnyen észak-amerikai emberi alanyok mintáinak felhasználásával, a nem elhízott T2D betegek kis mintamérete miatt. Ugyancsak nem bizonyítható az „arany standard” magas zsírtartalmú étrenddel (HFD) táplált állatmodellrel, amely nem alkalmas a nem elhízott T2D vizsgálatára. Bizonyos esetekben a nyugati országokból származó tanulmányok potenciális kockázati tényezőkről számoltak be (például az 1. inzulinreceptor szubsztrát (IRS-1) egyetlen nukleotid polimorfizmusáról (SNP)) a T2D esetében [7]; e kockázati tényezők és a T2D közötti összefüggést azonban nem sikerült reprodukálni, főként nem elhízott T2D-betegekkel ázsiai országokból, például Törökországból [8], Japánból, Indiából és Tajvanról [7]. Így nyilvánvalóvá válik, hogy a nem elhízott T2D betegségmechanizmusa eltér az elhízott T2D mechanizmusától [9, 10]. Továbbá a nem elhízott T2D kockázati tényezőinek ok-okozati összefüggései nem igazolhatók a releváns, nem elhízott T2D állatmodellek hiánya miatt. Ezek a korlátozások lassan haladnak a nem elhízott T2D patogenezisének megértésében.
A zsigeri zsír felhalmozódásának vitája nem elhízott T2D-ben
Úgy gondolták, hogy a fokozott viszcerális zsírfelhalmozódás által meghatározott központi elhízás a T2D kockázatát jelenti mind európaiak, mind az ázsiaiak körében [11]. A 290 második generációs japán amerikaiaktól származó adatok, átlagéletkoruk 61,8, azt mutatják, hogy az intraabdominális zsír csak kissé korrelál a T2D incidenciájával (esélyarány = 1,5), míg az éhomi glükóz, csökkent glükóz tolerancia (IGT) a kiinduláskor, a női nem, vagy a cukorbetegség családi kórtörténete korrelál a T2D incidenciájával (esélyhányados = 2,3, 3,8, 3,1, illetve 1,9) ugyanazon többváltozós modell szerint [12]. Indiában mind a központi hasi zsír, mind a zsigeri zsír felhalmozódása nagyon kis mértékben korrelál a T2D-vel (az esélyhányad = 1,001, illetve 1,011) [13].
MAP4K4 génpolimorfizmusok és nem elhízott T2D
Nemrégiben több csoport a MAP4K4-et (más néven HGK; nem tévesztendő össze az emberi glükokinázzal és a humán mirigyes kallikreinnel, amelyeket hGK-nak neveznek) azonosította a sovány T2D kockázati tényezőként. A MAP4K4 a MAP4K család kinázainak tagja [20, 21]; A MAP4K1 [22] és a MAP4K3 [23] a T-sejt aktiváció fontos szabályozóiról számoltak be [24, 25]. A MAP4K4 szükséges a rákos sejtek migrációjához, és rák áttétekkel társul [26–29]. A MAP4K4 fontos szerepet játszik az endothelia sejtek mozgékonyságában is [30].
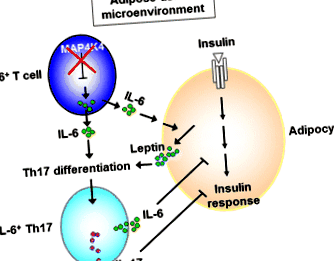
A T2D kockázati tényezőjét Európában a tübingeni család (TÜF) kohorszából származó perifériás vér DNS segítségével vizsgálták (n = 1,769) és az EPIC-potsdami eredetű esetleges eset-kohorsz (n = 2971) [31]. Megállapították, hogy egy SNP a MAP4K4 a lokusz (rs11674694) a megnövekedett orális glükóz tolerancia teszt (OGTT) glükózszinttel, csökkent inzulinérzékenységgel és a T2D fokozott kockázatával jár [31]. Karcsúbb alcsoportban ez MAP4K4 SNP (rs11674694) és két másik MAP4K4 Az SNP-k (rs13003883 és rs2236936) szintén társulnak az IL-6, de a TNF-a megnövekedett plazmaszintjeivel [31]. Sőt, a MAP4K4 Az SNP-k (rs2236936 és rs2236935) csak sovány alanyokhoz kapcsolódnak csökkent inzulin felszabaduláshoz (BMI + Th17 sejtek a leptin és az IL-6 szinergetikus hatása révén a zsírszövetben (1. ábra) [34]. Ezek a patogén IL-6 + Th17 a sejtek ezután keringenek más inzulinra célzott szövetekben (a májban és az izomban), ami inzulinrezisztenciához vezet.
A patogén IL-6 + Th17 sejtek differenciálódása a zsírszövetben. A T-sejtek MAP4K4 hiánya IL-6 túltermelést eredményez. Ezek az IL-6-termelő T-sejtek beszivárognak a zsírszövetbe. A zsírszövet mikrokörnyezetében az IL-6-termelő T-sejtekből kiválasztott IL-6 fokozza az adipociták leptin-szekrécióját. A leptin együttműködik az IL-6-mal, hogy elősegítse a Th17 differenciálódást, ami a patogén IL-6 + Th17 sejtek kialakulásához vezet [34]
A MAP4K4 által csökkentett IL-6 + Th17 sejtek klinikai jelentőségét T2D betegek tisztított T sejtjeivel validálják. Következetesen a perifériás vér T-sejtjeiben a MAP4K4 szintje csökkent a tajvani 72% -ban gyógyszerrel nem kezelt T2D-betegeknél [35]. Ebben a vizsgálatban az összes sovány T2D beteg mind a MAP4K4 downregulációját, mind az IL-6 túltermelését mutatja a T sejtekben [35]. Az IL-6-termelő T-sejtek gyakorisága korrelál az inzulinrezisztencia-index értékével [35]. Az IL-6-termelő T-sejtek frekvenciáját csökkenthetjük ektopikusan expresszált MAP4K4 alkalmazásával [35]. Ezek a megállapítások arra utalnak, hogy a T-sejtek MAP4K4 downregulációja hozzájárul a T2D-hez. Mindazonáltal a kis mintanagyság miatt a szerzők nem mutatták be, hogy a MAP4K4 csillapítású elhízott alanyok százaléka alacsonyabb, mint tanulmányukban a nem elhízott alanyoké [35]. Ezenkívül a T2D betegek tisztított T-sejtjeinek demetilációs kezelésének adatai azt mutatják, hogy a MAP4K4 downregulációja a MAP4K4 promoter fokozott metilációjának tudható be [35]. Ezenkívül a metilációs frekvenciák korrelálnak az elhízástól független OGTT glükózszintekkel; ez az összefüggés különösen magas a BMI + Th17 sejtekkel és a nem elhízott T2D-vel rendelkező betegek alcsoportjában
A magas zsírtartalmú étrend (HFD) IFN-γ + T-sejt populációt indukál egerekben [36, 37]. Az IFN-γ + T sejtek mellett a gyulladásos makrofágok és a B sejtek is hozzájárulnak a HFD által kiváltott T2D-hez [37, 38]. A T-sejtekben az MAP4K4 hiánya IL-6 + Th17 sejtek indukcióját eredményezi, a makrofágok vagy a B sejtek populációját azonban nem MAP4K4 cKO egerekben [34]. Az IFN-γ + T sejtekkel ellentétben az egerek IL17 + T sejtpopulációját nem lehet HFD-vel indukálni [36]. Nevezetesen, a MAP4K4-hiányos IL-6 + Th17 sejtek olyan patogén sejtek, amelyek spontán T2D-t okoznak a T-sejt-specifikus MAP4K4 feltételes knockout (cKO) egerekben, valamint az egészséges befogadó egerekben az örökbefogadás után [34].
Megelőzés és terápiás stratégiák nem elhízott T2D esetén
A csökkent glükóz tolerancia (IGT) egy pre-diabéteszes állapot. Az IGT-betegek IL-6-termelő T-sejtjeinek gyakorisága a T2D és egészséges egyének között van [35]. Ez a megállapítás azt sugallja, hogy az IL-6 + IL-17 + T sejtpopuláció vagy a MAP4K4 metiláció vizsgálata korai diagnózist vagy akár prognózist biztosíthat a nem elhízott vagy sovány T2D számára.
A DNS-metiláció szintjét környezeti tényezők, például étrend, kórokozók, toxinok, sugárzás, környezeti hormonok, levegőszennyezés és a víz pH-értéke szabályozhatják. Köztudott, hogy a légszennyezés (például a részecskék, a PM2,5) összefügg a T2D prevalenciájával. Érdekes módon az ózonnal oxidált fekete szénrészecskék expozíciója gyulladásos T-sejt populációt indukál a mediastinalis nyirokcsomókban, valamint IL-6 szintet vad típusú egerek bronchoalveoláris mosófolyadékaiban [40]. Ezenkívül a T-sejt-specifikus MAP4K4 kiütési egerek súlyosabb tüdőgyulladást mutatnak, mint a vad típusú egerekben, ózon-oxidált fekete szén-expozíció esetén [40].
Javasoljuk, hogy a környezeti tényezők és a kölcsönhatások MAP4K4 a polimorfizmusok/metiláció hozzájárul a MAP4K4 downregulációjához vagy inaktiválásához a T-sejtekben, ami nem elhízott T2D-hez vezet. Így a környezeti tényezők és a MAP4K4 expresszió/diszfunkció közötti kapcsolat vizsgálata segíthet a nem elhízott T2D megelőzésében. Ezen felül az SNP-k funkcionális jelentősége MAP4K4 vizsgálni kell. Hasznos lesz annak tisztázása is, hogy MAP4K4 Az SNP-k és a MAP4K4 hipermetilációja különféle országokból vagy különböző etnikai csoportokból származó, nem elhízott T2D-s betegeknél léteznek vagy önállóan fordulnak elő. A MAP4K4 mellett más gének (például szignálmolekulák) és környezeti tényezők, amelyek patogén IL-6 + Th17 sejtpopulációt indukálnak, szintén szerepet játszhatnak a nem elhízott T2D patogenezisében. Fontos azt is megvizsgálni, hogy más ismeretlen patogén immunsejt-populációk is hozzájárulnak-e a nem elhízott T2D-hez.
A gyulladásos T-sejtek gátlása hasznos megközelítés lehet a nem elhízott vagy sovány T2D kezelésében. Az IL-6 vagy az IL-17 semlegesítés javítja az inzulinérzékenységet a diabéteszes MAP4K4 cKO egerekben [34]. Számos japán [41] és európai [42] tanulmány szerint az anti-IL-6 receptor (tocilizumab) kezelésben részesülő rheumatoid arthritisben szenvedők csökkent HbA1c-szintet és jobb inzulinérzékenységet is mutatnak. Így az IL-6 vagy IL-17 blokkolás a nem elhízott T2D kezelésének tekinthető. Ezenkívül az ektópiás MAP4K4 expressziós vagy demetilációs kezelés gátolja az IL-6 termelést a T2D-betegek tisztított perifériás T-sejtjeiben [35]. Mivel a MAP4K4 mindenütt expresszálódik, és a MAP4K4 túlzott expressziója elősegíti a rák progresszióját vagy metasztázisokat [21, 26], előfordulhat, hogy a MAP4K4 agonistákat alkalmazó szisztémás kezelés nem megvalósítható. Így a MAP4K4 promoter metilációjának T-sejt-specifikus epigenetikus szabályozójának azonosítása segíthet a nem elhízott T2D potenciális kezelésének kialakításában a MAP4K4 T-sejtekben történő szelektív helyreállítása révén.
A T2D és a rheumatoid arthritis kölcsönhatása
A reumás ízületi gyulladás (RA), a pikkelysömör ízületi gyulladása vagy a pikkelysömör a T2D fokozott kockázatával jár [43, 44]; fordítva, a T2D jelentősen megnövekedett RA-kockázattal jár [45]. Az IL-6 és IL-17 gyulladásos citokinek fontos szerepet játszanak az RA, az psoriaticus arthritis vagy a pikkelysömör patogenezisében. Ezenkívül az IL-6 + Th17 sejtek kritikus patogén sejtek a nem elhízott T2D számára [34, 35]. Ezek a megállapítások azt sugallják, hogy a gyulladásos Th17 sejtek gyakran elhízott T2D, RA, pikkelysömör ízületi gyulladás és pikkelysömör kórokozói lehetnek. Így az RA vagy T2D betegek gyulladásos T sejtek figyelemmel kísérése elősegíti a másik betegség korai diagnosztizálását.
Következtetések
Különböző patogén utak nem elhízott T2D és elhízott T2D esetén. Nem elhízott T2D esetén a környezeti tényezők és a MAP4K4 génen található gének közötti kölcsönhatás fokozhatja a MAP4K4 promoter metilációját, ami MAP4K4 downregulációt eredményezhet. A MAP4K4 downregulációja a T-sejtekben ezt követően az IL-6 és IL-17 proinflammatorikus citokinek túltermelését eredményezi, ami az inzulinnal megcélzott sejtek inzulinrezisztenciájához vezet. Elhízott T2D-ben a magas zsírtartalmú étrend az elhízás és a zsigeri zsír felhalmozódásának oka, ami a proinflammatorikus citokin IFN-γ túltermelését eredményezi a T-sejtekből [36, 37], az IgG autoantitestek a B-sejtekből [38] és az előgyulladásos citokinek TNF-a, IL-1β, IL-6 makrofágokból [46]. A makrofágok mellett az IL-6 a zsírtartalmú étrendben táplált egerek zsírsejtjeiből, hepatocitáiból, izomsejtjeiből és B-sejtjeiből is előáll [47]. A magas zsírtartalmú étrend által kiváltott B-sejtek makrofágokat toboroznak az inzulinra célzott szövetekbe, és aktiválják a T-sejteket az IFN-y termeléséhez [38]. A TNF-α és az IFN-γ inzulinrezisztenciát okoz [46]. Nem elhízott T2D és elhízott T2D esetén az inzulinrezisztencia tovább indukálja a máj és a szív steatosist
- Liraglutid 2-es típusú cukorbetegség és elhízás esetén a 2015. évi frissítés - PubMed
- Hogyan táplálkozzunk egészségesen és érezzük jól magunkat az 1-es típusú cukorbetegséggel
- Cukorbetegség, 2. típusú gyógyszerek listája (161 összehasonlítva)
- A liraglutid javítja a memóriát elhízott, prediabéteszben vagy korai 2-es típusú cukorbetegségben szenvedő betegeknél a
- Élet a 2. típusú cukorbetegséggel A mindennapi egészség