A microRNA-205-5p az inzulinérzékenység modulátora, amely gátolja a FOXO működését
Fanny Langlet
1 Naomi Berrie Diabetes Központ és Orvostudományi Osztályok, Columbia Egyetem, New York, 10032, USA
Marcel Tarbier
2 Science for Life laboratórium, Molekuláris Biotudományok Tanszék, Wenner-Gren Intézet, Stockholm Egyetem, 17121, Stockholm, Svédország
Rebecca A. Haeusler
3 Naomi Berrie Diabetes Központ, valamint a Kórtani és Sejtbiológiai Osztályok, Columbia Egyetem, New York, 10032, USA
Stefania Camastra
4 Klinikai és Kísérleti Orvostan Tanszék, Pisai Egyetem Orvostudományi Kar, Pisa, Olaszország
Eleuterio Ferrannini
4 Klinikai és Kísérleti Orvostudományi Osztály, Pisai Egyetem Orvostudományi Kar, Pisa, Olaszország
5 CNR Klinikai Élettani Intézet, Pisa, Olaszország
Marc R. Friedländer
2 Science for Life laboratórium, Molekuláris Biotudományok Tanszék, Wenner-Gren Intézet, Stockholm Egyetem, 17121, Stockholm, Svédország
Domenico Accili
1 Naomi Berrie Diabetes Központ és Orvostudományi Osztályok, Columbia Egyetem, New York, 10032, USA
Társított adatok
Absztrakt
Célkitűzések
A máj inzulinrezisztenciája a 2-es típusú cukorbetegség és az elhízás jellemzője. Az inzulinreceptorok AKT-n és FOXO-n keresztül történő szignalizációjának fontos metabolikus hatása van, amelyeket hagyományosan a génexpresszió szabályozásának tulajdonítottak. Nem ismert azonban, hogy a FOXO összes metabolikus hatása a fehérjét kódoló mRNS-ek szabályozásából ered-e.
Mód
Ennek a kérdésnek a megválaszolásához FOXO-szabályozott egér máj mikroRNS-ek (miRNS-ek) expressziós profilját kaptuk koplalás és újratáplálás során olyan egerek alkalmazásával, amelyek májából Foxo1, 3a és 4 hiányzott (L-Foxo1,3a, 4).
Eredmények
Az elemzett 439 miRNS közül 175-et különböztetünk meg Foxo-kiütésekben. Funkcióik az inzulinhoz, a Wnt-hez, a Mapk-szignálhoz és az öregedéshez kapcsolódtak. Közülük a miR-205-5p expresszió feltűnő növekedéséről számolunk be az L-Foxo1,3a-ban, 4 kiütésben, valamint elhízott egerekben. Megmutattuk, hogy a miR-205-5p funkciógyarapodás növeli az AKT foszforilációját és csökkenti az SHIP2-t az elsődleges májsejtekben, ami FOXO-gátlást eredményez. Ennek következtében csökken a májsejtek glükóztermelése. Ezekkel a megfigyelésekkel összhangban az egerekben a miR-205-5p funkciógyarapodás csökkentette a glükózszintet és javította a piruvát toleranciát.
Következtetések
Ezek a megállapítások egy homeosztatikus miRNS-hurkot tárnak fel, amely szabályozza az inzulinjelet, és ennek potenciális következményei lehetnek az in vivo glükóz-anyagcserére.
1. Bemutatkozás
Az inzulinrezisztencia hajlamosít a cukorbetegségre és az elhízásra [1]. Az inzulin pleiotrop hatásait részben a PI3K/AKT/FOXO1 útvonal közvetíti [1], [2], [3]. A májban az inzulin csökkenti a glükóztermelést és növeli a glükózfelhasználást az FOXO gátlásával, míg az inzulinrezisztencia aktiválja a FOXO-t, hozzájárulva a hiperglikémiához és a hipertrigliceridémiához [4], [5]. A FOXO fehérjét kódoló célgénjeit részletesen tanulmányozták [6], [7], [8]. Kevéssé ismert azonban a génexpresszió FOXO-szabályozása mikro-RNS (miRNS) által közvetített géncsendesítés révén.
A miRNS-ek szabályozzák a génexpressziót fiziológiai és betegségekben, ideértve az inzulinrezisztens cukorbetegséget is [9], [10]. Érdekes, hogy a 2-es típusú cukorbetegség-érzékenységi lokuszok egész genomjára kiterjedő asszociációs tanulmányai azt mutatják, hogy a cukorbetegséggel társult variánsok többsége a nem kódoló régiókban lokalizálódik [11], [12], felvetve annak lehetőségét, hogy az ezekből a régiókból átírt miRNS-ek hozzájárulnak a betegség kialakulásához. Számos máj-miRNS-ről, köztük a miR-33 [13], a miR-122 [14], a miR103/107 [15] és a miR-802 [16] -ról kimutatták, hogy az anyagcserében és az inzulinszignálban szerepet játszó gének expresszióját utólag szabályozzák.
Tekintettel a FOXO inzulinhatásában betöltött szerepére, szisztematikusan kerestük a FOXO által szabályozott máj miRNS-eket és megvizsgáltuk metabolikus szerepüket. A FOXO-hiányos egerek miRNS-profiljának felhasználásával katalogizáltuk a FOXO-modulált miRNS-eket, és a miR-205-5p-t az inzulinérzékenység endogén szabályozójaként azonosítottuk, amely összehangoltan irányítja az inzulinjelző kaszkád összetevőit.
2. Anyag és módszerek
2.1. Kísérleti modell és a tárgy részletei
2.1.1. Egerek
A hím (9-24 hetes) egereket chow-n tartottuk (PicoLab rágcsáló-diéta 20, 5053; Purina Mills). Valamennyi kísérletet a Columbia Egyetemi Intézményi Állattenyésztési és Felhasználási Bizottság hagyta jóvá.
L-Foxo1, L-Foxo1,3a, 4, db/db, ob/ob és Sin3a lox/lox: Sin3b lox/lox [3], [4], [6], [17] és iL-Sin3a/3b egereket írtak le [6]. A C57Bl6, ob/ob, db/db és a 10 hetes DIO egerek a The Jackson Laboratories cégtől származnak. A miR-205-5p túlzott expresszálásához 1 × 10 11 részecskét (AAV8.TBG.miRNS (Scramble) -CMV-GFP vagy AAV8.TBG.miR-205-5p-CMV-GFP) injektáltunk a C57Bl6J-be, és megöltük az állatokat 25 nap után. A miR-205-5p leütéshez a C57Bl6J egereket 10 hétig magas zsírtartalmú táplálékkal etették (DIO) (OpenSource Diets, Cat #: D12492), és Custom miRCURY LNA-t (Exiqon, hsa-miR-205-5p) injektáltak hozzájuk. (Tétel: 681392) vagy kontroll (tétel: 681393) (15 mg/kg) 3 napig, és 25 nap után leöltük.
A miRNS-szekvenáláshoz és a miR-205 funkciónyereséghez az L-Foxo1,3a, a 4 és a C57Bl6J egereket egy éjszakán át éheztettük, és 4 órán át refrakáltuk (vagy sem). A miR-205 funkcióvesztés esetén a DIO egereket 5 órán át éheztettük. A qPCR esetében az L-Foxo1, L-Foxo1,3a, 4 és iL-Sin3a/3b egereket egy éjszakán át éheztettük; ob/ob, db/db és DIO egerek 5 órán át.
2.1.2. Elsődleges hepatocita tenyészet
Az elsődleges májsejteket izoláltuk és plazmidokkal (500 ng/5x105 sejt, 48 óra) transzfektáltuk Lipofectamine2000 alkalmazásával, a leírtak szerint [18]. a miR-205-5p-t miRCURY LNA miRNS Mimics (15-50 nM/5x105 sejt, 48 óra) túlzottan expresszáltuk az egér miR-205-5p-vel szemben; cel-39-3p-t használtunk kontrollként. A sejteket 100 uM 8-CPT-cAMP-val, 1 uM dex-szel, 100 nM inzulinnal vagy vivőanyaggal inkubáltuk 7 órán át.
2.1.3. Humán tanulmányok
A májbiopsziákat bariatriás műtét során 10 típusú 2 cukorbetegben és 10 nem cukorbetegben szerezték be [19], [20]. Az RNS-t RNS-Later-nal (Ambion Inc., Applied Biosystems, Austin, TX, USA) extraháltuk, és éjszakai böjt után plazmamintákat nyertünk. A cukorbetegek a vizsgálat előtt 48–72 órával abbahagyták a kezelést. A protokollt a Pisai Egyetem IRB hagyta jóvá. A vizsgálat jellegét és célját minden résztvevőnek gondosan elmagyarázták, mielőtt írásban hozzájárultak a részvételhez.
2.2. A módszer részletei
2.2.1. Vegyszerek és antitestek
A reagensek a következő gyártók voltak: ketamin (KetaSet ®), Xylazine (AnaSed ®), Medium 199, HBSS, EGTA, HEPES, PenStrep és Gentamycin (Life Technology), Collagen 4 (Worthington), Humulin® R U-100 (Lilly ), 8- (4-klór-fenil-tio) (CPT) -cAMP, dexametazon, cikloheximid, szarvasmarha-szérumalbumin, d-glükóz és nátrium-piruvát (Sigma – Aldrich), Lipofectamine2000 (Thermo Fisher), miRCURY LNA (Qiagen) (biotilezett mmu- 205-5p és cel-39-3p), anti-FOXO1 (C29H4, # 2880S), anti-Foszfo-FoxO1 (Thr24)/FoxO3a (Thr32) (# 2599S), anti-Akt, anti-Foszfo-Akt (Ser473) ) (D9E, # 4060), anti-SHIP2 (# 3397S) és anti-PTEN (# 9188S) (sejtjelzés), anti-aktin (ab8227) (Abcam).
2.2.2. Plazmidok/vírusok
RFP (CTL) és FOXO1 plazmidokat írtak le [21]. A miTarget ™ 3'UTR miRNS célklónokat kódoló plazmidok a GeneCopoeia-ból származnak (CTRL: CmiT000001-MT05 és FOXO1: Mmi7055419-MT05); AAV8.TBG.eGFP és AAV8.TBG.Cre a Penn Vector Core-ból; AAV8.TBG.miRNS (Scramble) -CMV-GFP és AAV8.TBG.miR-205-5p-CMV-GFP a SignaGene-től.
2.2.3. RNS és miRNS vizsgálatok
A qPCR-hez RNeasy kitet (Qiagen), GoScript (Promega) és GoTaq ® qPCR Master Mix-et (Promega) használtunk. A génexpressziós szinteket TATA-kötő fehérjére (TBP) normalizáltuk a 2 -ΔΔCt módszerrel, és relatív transzkriptumszintként adtuk meg őket. A miRNS vizsgálatokhoz RNS-t izoláltunk Mirvanával (Thermo Fisher, AM1560) vagy Trizollal (Life Technologies). A miRNS szekvenáláshoz az összes RNS-t Ribogreen-szel számszerűsítettük, és a könyvtárakat TruSeq-rel (Illumina, San Diego, Kalifornia) készítettük, az Agilent 2100 Bioanalyzer (Agilent Technologies, Santa Clara, CA) HighSensitivity készlettel számszerűsítettük, és az Illumina HiSeq 2500 Rapid single-vel szekvenáltuk. 50 ciklus végén áramlási cella. Az alacsony minőségű címkéket a FASTX-Toolkit (http://hannon-lab.cshl.edu/fastx_toolkit/) segítségével módosítottuk. Az olvasásokat a csővezeték miralignerjével dolgoztuk fel, és a miRBase v.20-ra térképeztük fel. A miRNS qPCR-hez miScript II RT Kitet (Qiagen) és miScript SYBR Green PCR Kitet (Qiagen) használtunk. Az alapvizsgálatok a Qiagen cégtől származnak. SNORD61-et alkalmaztunk a miRNS szint normalizálására a 2 -ΔΔCt módszer alkalmazásával.
2.2.4. Fehérje elemzés
A fehérjéket lízispufferben (20 mM Tris-HCl (pH = 7,4), 150 mM NaCl, 10% glicerin, 2% NP-40, 1 mM EDTA, 20 mM NaF, 30 mM Na4P2O7, 0,2% SDS, 0,5%) extraháltuk. nátrium-dezoxikolát) proteáz/foszfatáz gátló koktéllal (1x, sejtjelzés) és 0,15 mg-ot használtunk SDS-pufferben a Western blot-hoz. A denzitometriához ImageJ-t (National Institute of Health) használtunk.
2.2.5. Luciferáz vizsgálatok
A hepatocitákat miTarget ™ 3′UTR miRNS célklónokat (1 ug/5 × 105 sejt) vagy miRNS-utánzókkal (50 nM) kódoló plazmidokkal transzfektáltuk Lipofectamine 2000 (Invitrogen) alkalmazásával. 48 órával a transzfekció után luciferázt vizsgáltunk Secrete-Pair ™ Dual Luminescence Assay Kit (GeneCopoeia) segítségével egy Orion L mikrolemez-luminométerben (Berthold).
2.2.6. Anyagcsere vizsgálatok
A glükóztermelést és a lipogenezist primer hepatocita kultúrákban írták le [18]. 9–15 hetes hím egerekben glükóz- és piruvat-tolerancia teszteket végeztünk 16 órás böjt után 2 g glükóz vagy piruvát/kg alkalmazásával, inzulin-tolerancia teszteket pedig 5 órás böjt után 0,6 U inzulin/kg alkalmazásával. A máj trigliceridjeit, a koleszterint [22] és a glikogént a leírás szerint mértük [5]. Mértük a glükózt OneTouch (One Touch Ultra, Bayer), triglicerid (Infinity, # TR22421, ThermoFisher), koleszterin (Koleszterin E, # 439–17501, Wako Pure vegyszerek) és NEFA (HR sorozat NEFA-HR (2)) segítségével, # 999–34691, # 995–34791, # 991–34891, # 993–35191, Wako Pure chemicals) kolorimetriás vizsgálatokkal.
2.2.7. Statisztika
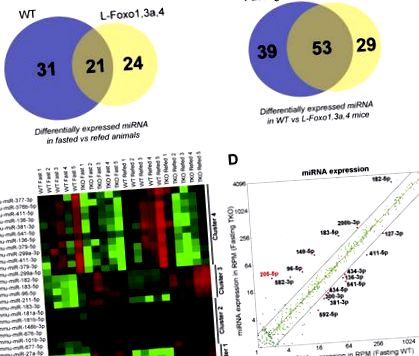
A FOXO-k modulálják a máj miRNS-ét. A-B, A differenciálisan expresszált miRNS-eket összefoglaló Venn-diagramok (A) az éheztetett és az eledelt körülmények között, és (B) WT és L-Foxo1,3a között 4 egér (n = 5 csoportonként). C, Az éheztetett és takarmányozatlan WT és L-Foxo1,3a, 4 egér miRNS expressziójának hőtérképe. D, A miRNS expressziójának szórási sávja millió olvasásonként (RPM) éhomi WT-vel szemben, L-Foxo1,3a, 4 egér.
3.2. A FOXO-k által szabályozott miRNS-ek a MAPK, Wnt és az inzulin szignalizációt célozzák meg
Ezután hőtérképet készítettünk, összehasonlítva a WT-ben differenciáltan expresszált miRNS-eket az L-Foxo1,3a-val szemben, 4 egeret éheztetett és felesleges körülmények között, 5% -os hamis felfedezési arány felhasználásával, és hierarchikus csoportosítást hajtottunk végre (1. C ábra). Négy klasztert észleltünk: az 1. és 2. klaszter tartalmazott miRNS-t, amelynek expresszióját nem szabályozta éhgyomorra vagy újratáplálás, de az L-Foxo1,3a-ban 4 egér növekedett nagyobb mértékben (1. klaszter) vagy kisebb mértékben (2. klaszter); a 3. és 4. klaszter tartalmazta az éheztetett és táplált állapotban szabályozott miRNS-t, amelynek szintje emelkedett (3. klaszter) vagy csökkent (4. klaszter) L-Foxo1,3a, 4 egérben. Ezen adatokból az a következtetés vonható le, hogy a FOXO képes mind a miRNS expresszióját kiváltani, mind gátolni, akárcsak a génexpresszió esetében [6]. Ezenkívül az a megfigyelés, miszerint a FOXO általi szabályozás látszólag megdönti az 1–2 klaszterek táplálkozási állapota általi szabályozást, arra utal, hogy a FOXO hatása a miRNS expressziójára lehet közvetlen és közvetett.
Ezután az egyes miRNS-ek szórási sávjait generáltuk az éheztetett WT és 4 egér L-Foxo1,3a és szintjeinek függvényében (1. D ábra). Ebből az elemzésből olyan miRNS-eket választottunk ki, amelyek szintje meghaladja az 5 olvasás/millió értéket, amelyek szignifikánsan (p 2A ábra) mutatják az éhezést, és ∼80% -os csökkenést az újratöltéskor (S1A ábra), jelezve, hogy a FOXO-k elnyomják a máj miR-205- 5p koplalás közben. Érdekes módon csak kétszeres növekedést tapasztaltunk az egyetlen kiütéses L-Foxo1 egerekben (2. B ábra), ami arra utal, hogy az L-Foxo1,3a, 4 egér nagy növekedése valószínűleg a FOXO3 miatt következik be (a FOXO4 szintje nagyon alacsony), vagy hogy a három izoform képes kompenzálni egymást. Az L-Foxo1 egerekből származó primer májsejtekben az mmu-miR-205-5p kétszeresére nőtt (2. ábra C), és a növekedést részben megfordította a FOXO1 transzfektálása (S1B ábra). Ezenkívül az mmu-miR-205-5p-t cAMP/dexametazon vagy inzulin nem szabályozta az L-Foxo1 egerek primer májsejtjeiben (2. C ábra), ami nem utánozta az éhezés és az újratáplálás hatását. Ez arra utal, hogy a hepatocita tenyésztés során elvész a szabályozás, vagy hogy a közvetett mechanizmusok közvetítik a miR-205 gátlását a FOXO-k által in vivo.
Máj miRNS-205 expresszió egerekben és emberekben. A-B, miR-205-5p expresszió a májban a WT-vel szemben, L-Foxo1,3a, 4 (n = 5 csoportonként) és L-Foxo1 (n = 7, illetve 9) qPCR-vel mérve. C, miR-205-5p expresszió primer májsejtekben kontroll WT vagy L-Foxo1 egerekből 7 órás kezelés után vivőanyaggal, cAMP/dex, cAMP/dex/inzulin (n = 4 csoportonként). D-G, miR-205-5p expresszió a WT májában az iL-Sin3a/b-vel szemben (D) (n = 6, illetve 7), chow vs. étrend okozta elhízott (DIO) egerek (E), n = 5 csoportonként), WT vs. ob/ob egerek (F) (n = 5 csoportonként), WT vs. hiperinsulinémiás db/db (ins magas) (G, n = 7/4). Az adatok átlag ± SEM. * P lox/lox: Sin3b lox/lox egerek (iL-Sin3a/b egerek) [6]. Nem észleltünk változásokat a miR-205-5p-ben egy éjszakán át éheztetett iL-Sin3a/b-ben a WT egerekhez képest (2. D ábra). A FOXO nem képes megkötni a miR-205 gén jelölt szabályozó régióit, és hiányzik a miR-205-5p variációk az iL-Sin3a/b egerekben, vagy az éhgyomorra vagy újratáplálásra (in vivo) vagy cAMP/a dex vs. inzulin (in vitro) arra utal, hogy a miR-205-5p-t a FOXO közvetett módon szabályozza, valószínűleg egy potenciális miR-205 aktivátor gátlásán keresztül.
Tekintettel annak potenciális szerepére az inzulinjelzésben, elemeztük a miR-205-5p szabályozását elhízásban, inzulinrezisztenciában és 2-es típusú cukorbetegségben. A diéta által kiváltott elhízott (DIO), ob/ob C57J/B6 és hiperinsulinémiás db/db egerekben kezdő hiperglikémia (/200 mg/dl) (2. ábra E, F, illetve G ábra) a miR-205-5p emelkedett 5 órás gyorsaság a kontrollokhoz képest. Ez összhangban áll a korábbi jelentésekkel, amelyek szerint a máj miR-205-5p növekedése a cukorbetegség-rezisztens, de a cukorbetegségre fogékony egerekben nem [36].
3.4. Az Mmu-miR-205-5p gátolja a FOXO1 expressziót és fokozza az inzulin szignálozást
Tekintettel annak potenciális szerepére a PI3k/Akt szignalizációban [37], [38], [39], elemeztük a miR-205-5p túlzott expresszió hatását az inzulin szignálozásra azáltal, hogy primer egér májsejteket transzfektáltunk miR-205-5p utánzókkal. A miR-205-5p túlzott expressziója májsejtekben fokozta a bazális AKT foszforilációt anélkül, hogy megváltoztatta volna a fehérje szintjét. Ezt a hatást tompította a cAMP/dex (3. ábra A – C). Az AKT foszforiláció növekedése a F24 fokozott FOXO1 foszforilációjával járt (3. ábra, A, D). Az miR-205-5p aktiválja a PI3K/AKT-t a PIP3 foszfatázok Pten [37] és Ship2 [40] célzásával. Az elsődleges májsejtekben a miR-205-5p túlzott expressziója csökkentette a Ship2-t és növelte a Phlpp2-t (3. E ábra), de nem volt hatással a Ptenre. A fehérjeszintek Western blot elemzése megerősítette ezeket az adatokat (3. ábra F – H). Ezek az eredmények azt mutatják, hogy a miR-205-5p fokozza az inzulinjelet in vitro.
- A peptid javítja a glükóz- és inzulinérzékenységet, csökkenti az egerek súlyát. Az eredmények potenciálra utalnak
- Nem lisztérzékenységi lisztérzékenység és szaporodási rendellenességek
- Az anyagcsere-egészség szorosabban összefügg a tüdőfunkció csökkenésével, mint az elhízással
- A Novo Nordisk megnyitja az inzulingyárat az orosz Pharmafile-ban
- Ápolási beavatkozások 2. típusú cukorbetegség inzulin-koffeinrezisztencia - a cukorbetegség egészsége