A normál glükóz tolerancia helyreállítása súlyos elhízott betegeknél a bilio-pancreas eltérítés után: az inzulinérzékenység és a béta-sejt funkció szerepe
Absztrakt
Célok/hipotézis
A tanulmány célja a glio-tolerancia javulásának mechanizmusainak elemzése volt a morbid-hasnyálmirigy-eltérítésen (BPD) átesett, kórosan elhízott betegeknél.
Tantárgyak és módszerek
32 kórházi elhízásban (BMI = 52 ± 7 kg/m 2, átlag ± SD) értékeltük a glükóz toleranciát (OGTT-vel), az inzulinérzékenységet (euglycaemiás – hiperinsulinaemiás bilincs és az OGTT index OGIS) és a béta-sejt funkciót (OGTT modellezési elemzés). betegek (12 NGT-vel, 9 IGT-vel és 11 2-es típusú cukorbetegséggel), BPD előtt és után, valamint 22 sovány kontroll alanyban. A betegeket a műtét előtt és után 7 naptól 60 hónapig tanulmányozták.
Eredmények
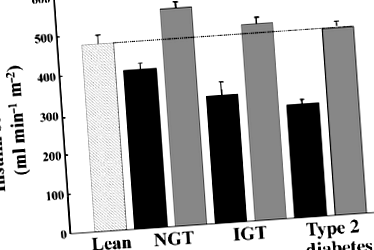
A BPD minden alanyban javította a glükóz toleranciát, akiknél a műtét után normális volt a glükóz tolerancia. Az inzulinérzékenység minden alanyban normalizálódott (BPD előtti 341 ± 79 ml min –1 m −2, a BPD után 511 ± 57 ml min −1 m −2, sovány 478 ± 49 ml min −1 m −2 ). Az inzulinérzékenység változása a BPD-t követő 10 napon belül kimutatható volt. A kiinduláskor a cukorbetegeknél a béta sejtek glükózérzékenysége károsodott (25 [18] pmol min −1 m −2 l mmol −1, medián [interkvartilis tartomány]) a sovány alanyokhoz képest (82 [98]; o≤0,05). A BPD után a béta sejtek glükózérzékenysége javulási tendenciát mutatott, de cukorbetegeknél káros maradt (30 [62]; o 2 = 0,67, részleges r= −0,76 és −0,41). A NEFA-k, a leptin és az adiponektin összefüggésben voltak az inzulinérzékenységgel, de nem tudták megmagyarázni a korai javulást.
Következtetések/értelmezés
A BPD után a glükóz tolerancia főként az inzulinérzékenység gyors és nagy javulásának eredményeként állt helyre.
Bevezetés
A súlyos elhízás miatt végzett bariatrikus műtétekkel kapcsolatos legújabb tapasztalatok azt mutatják, hogy ez a kezelési forma a cukorbetegek többségében helyreállíthatja a normális glükóz toleranciát [1]. Két műtéti eljárás, a bilio-pancreaticus elterelés (BPD) és a Roux-en-Y gyomor bypass, annyira hatékonynak bizonyult a normoglykaemia helyreállításában, hogy a cukorbetegség lehetséges terápiájaként javasolták őket [2, 3].
Morbid elhízott, bariatriás műtéten átesett betegeknél a normális glükóztolerancia helyreállításának egyik tényezője a műtétek által kiváltott inzulinérzékenység [4–7]. Noha rendelkezésre állnak bizonyos adatok [5, 7–9], a béta sejtek funkciójának szerepe, kapcsolata az inzulinérzékenységgel és mindkét tényező hozzájárulása a glükóz tolerancia javulásához nincs egyértelműen megállapítva. Továbbá, bár vannak bizonyítékok arra, hogy a keringő glükózszint javulása napokban következik be [10], nem világos, hogy a műtét után milyen korán következik be az inzulinérzékenység javulása.
Ebben a tanulmányban OGTT-t alkalmaztunk és validált inzulinérzékenységi és béta-sejtfunkciós módszereket alkalmaztunk súlyosan elhízott, a glükóz tolerancia széles spektrumát lefedő alanyokban, akik BPD-n estek át, hogy tisztázzák az inzulinérzékenység, a béta sejtek funkcióját és kölcsönhatásukat a a glükóz tolerancia helyreállítása.
Tantárgyak és módszerek
Tárgyak
32 kórosan elhízott, BPD-n átesett személyt vizsgáltunk. A műtét előtt 12 betegnek volt NGT-je, 9-nek IGT-je és 11-nek nyilvánvalóan 2-es típusú cukorbetegsége volt. A betegeket a műtét után változó időben határozták meg (mediánja 1220 nap az NGT esetében, 244 nap az IGT esetében és 153 nap a 2-es típusú cukorbetegség esetén). Az inzulinérzékenység és a béta-sejt funkció normál referenciaértékeit 22 sovány, nem cukorbeteg alany csoportjától kaptuk. A vizsgálati alanyok klinikai és metabolikus jellemzőit az 1. táblázat mutatja. További 25 súlyosan elhízott betegből álló csoport (13 férfi és 12 nő; 16 NGT, 1 IGT, 8 2-es típusú cukorbetegség; életkor 42 ± 10 év [átlag ± SD BMI 44 ± 6 kg/m 2) a BPD-n kívüli egyéb okokból hasi műtéten (elsősorban kolecisztektómián és hasi sérven) átesett, annak tesztelésére, hogy a műtéti beavatkozás maga befolyásolja-e az inzulinérzékenységet és a glükóz toleranciát. Ezekben az alanyokban OGTT-t végeztek a műtét előtt és a műtétet követő 10 napon belül. A műtétet követő első 6 napban minden beteg ugyanazt a parenterális táplálási rendszert kapta (~ 7,100 kJ/nap). A vizsgálat jellegét és célját minden alanynak elmagyarázták, mielőtt beleegyeztek a vizsgálatban való részvételbe, amely megfelelt a kórház etikai bizottságának irányelveinek.
Ez a malabszorptív műtéti eljárás [11] körülbelül 60% -os disztális gyomorreszekcióból áll, a nyombélcsonkok kapcsos lezárásával. A gyomor maradék térfogata körülbelül 300 ml. A vékonybelet 2,5 m-re keresztezik az ileo-caecalis szeleptől, és annak távoli végét a többi gyomorba anasztomizálják. Az ileum proximális vége, amely tartalmazza a fennmaradó vékonybelet (amely részt vesz a bilio-hasnyálmirigy-lé szállításában, de kizárt az élelmiszer-átjutásból), végtől-oldalig anasztomózisa van a bél felé, 50 cm-rel az ileo-caecalis szelep közelében . Következésképpen a felszívódó bél teljes hossza 250 cm-re csökken, amelynek utolsó 50 cm-je, az úgynevezett közös csatorna képviseli azt a helyet, ahol a bevitt étel és a bilio-hasnyálmirigy-lé keveredik.
Test felépítés
A testtömeget 0,1 kg pontossággal mértük egy sugárskálával, a magasságot pedig 0,5 cm pontossággal mértük egy sztadiométer segítségével (Holtain, Crosswell, Egyesült Királyság). A sovány testtömeg, kg-ban, a teljes testvízből lett kiszámítva, amelyet tríciumos vízinjekcióval határoztak meg [12]. Ezután a zsír tömegét a testtömeg és a sovány testtömeg különbségeként számoltuk ki. Amikor a műtét után nagyon korán (legfeljebb 1 hónappal) meghatározták, a testösszetételt elektromos bioimpedanciával mértük (Dietosystem, Milánó, Olaszország).
Mindegyik betegnél standard, 75 g-os OGTT-t hajtottak végre a kiinduláskor és a műtét után, vérmintát vettünk 0, 30, 60, 90, 120 és 180 percnél. Néhány vizsgálatban (a BPD alanyok 64 vizsgálatából hét és a sovány alanyok 22 vizsgálatából 13) a mintavételt 2 órával leállították.
Euglycaemiás – hyperinsulinaemiás bilincs
A perifériás inzulinérzékenységet az euglykaemiás – hiperinsulinaemiás technikával [13] értékelték a BPD-s betegek egy részében (26 pre-BPD és 18 post-BPD meghatározás). Miután az artériás vénás vérből mintát vettünk egy kanülről a hátsó kézi vénába, az infúzióhoz pedig egy másikat a kontralaterális kar antecubitalis fossa-ba, az alanyok legalább 1 órán át hanyatt feküdtek. Egyik kezükkel melegített, 60 ° C-ra beállított, melegített levegőtartályba tették őket, hogy arteriás vérmintákat kapjanak. Az inzulinérzékenység, mint az inzulin által közvetített teljes glükózfelvétel (M értéket, mikromol/perc/testtömeg-kilogramm), 240 pmol min –1 m –2 inzulin alapozott állandó infúziója során határoztuk meg. A M értéket a szorító utolsó 40 perces periódusában számoltuk ki.
Inzulinérzékenység és béta-sejtek működése
Az inzulinérzékenységet az OGTT-ből számítottuk ki, mint az orális glükóz inzulinérzékenységi indexet (OGIS) [14], a 2 órás OGIS egyenlet felhasználásával. Ez a módszer olyan inzulinérzékenységi indexet nyújt, amely az euglycaemiás – hiperglikémiás bilincs során mért glükóz clearance becslését jelenti, milliliter/perc/testfelület négyzetméterben kifejezve. Azon alcsoportok részcsoportjában, amelyeknél a bilincset is elvégezték (44 teszt), szoros összefüggés volt a M érték és OGIS (r= 0,92, o
Eredmények
Súly és glükóz tolerancia
A kiindulási alapon, a sovány kontroll alanyokkal összehasonlítva, az elhízott betegek átlagos plazma glükózkoncentrációja magasabb volt az OGTT alatt, az eltérések nagyobbak voltak az IGT és a 2-es típusú cukorbetegeknél (1. táblázat). A műtét után a testtömeg és a BMI jelentősen csökkent, de magasabb maradt, mint a sovány kontroll alanyoknál, különösen az IGT és a 2-es típusú cukorbetegeknél. Ezzel szemben az átlagos plazma glükózkoncentráció már nem volt magasabb, mint a sovány kontroll alanyoké az NGT, IGT vagy 2-es típusú cukorbetegségben.
A műtét súlycsökkenésre gyakorolt hatása erősen időfüggő volt. Így a műtét után 3 hónappal vagy annál hosszabb ideig vizsgált betegeknél a fogyás átlagosan 37% volt (12–53% tartományban). Ezzel szemben a BPD-től számított 10 napon belül vizsgált betegek testsúlycsökkenése legfeljebb 6% volt. A betegcsoport egészében a relatív súlycsökkenés szorosan és közvetlenül összefüggött a műtét óta eltelt idővel (r= 0,83, o 2. táblázat Az inzulinérzékenység és a béta-sejt funkció paraméterei
Súlyosan elhízott betegek inzulinérzékenysége korábban (fekete rudak) és utána (szürke rudak) BPD és sovány kontroll alanyokban (kikelt bár). Bárok átlagot jelent ± SEM
A testtömeg változásainak időbeli alakulása az alapvonaltól (nyitott körök, törött vonal) és inzulinérzékenység (kitöltött négyzetek, folytonos vonal) súlyosan elhízott betegeknél a műtét után különböző időpontokban. Szimbólumok ábrázoljuk a medián és interkvartilis tartományt x-tengely és az átlag ± SEM a y-tengely. A árnyékolt terület az inzulinérzékenységi tartomány a sovány kontroll alanyoknál (átlag ± 1 SD). A négy csoport a következőket tartalmazza: alapvonal (n= 32), OGTT 10 napon belül (n= 8), OGTT 11 nap és 18 hónap között (n= 10), OGTT több mint 18 hónap (n= 14) műtét után
Nem BPD műtéti betegek
A BPD kivételével műtéten átesett alanyok csoportjában a súlycsökkenés 1,7 ± 1,9 kg (∼1%) volt. Az inzulinérzékenység nem változott (373 ± 80 vs 368 ± 80 ml min – 1 m –2 műtét után), és a két inzulinérzékenységi mérés szorosan korrelált (r= 0,74, o −1.2, r= −0,61, o −2.6, r= −0,44, o= 0,01), de a két kapcsolat szignifikánsan (o 3. ábra
Az inzulinérzékenység és a teljes inzulinkibocsátás változása az OGTT során súlyosan elhízott betegeknél (körök, NGT; gyémántok, IGT; háromszögek, típusú cukorbetegség) előtt (kitöltött szimbólumok) és műtét után (nyitott szimbólumok) és sovány kontroll alanyokban (kikelt négyzet). Szimbólumok ábrázolja az átlagos ± SEM értéket az inzulinérzékenységre, valamint az medián és interkvartilis tartományt az inzulinmennyiségre
NEFA és adipokinek
A kiinduláskor az éhgyomri NEFA és a leptin koncentrációja minden elhízott csoportban magasabb volt a sovány kontroll alanyokhoz képest, míg az adiponektin szint alacsonyabb volt. A műtét után mindhárom paraméter jelentősen javult olyan szintre, amely általában már nem különbözött szignifikánsan a sovány kontrollcsoportétól (3. táblázat). Ezenkívül az elhízott csoport egészében a műtét által kiváltott inzulinérzékenység változások fordítottan összefüggtek a NEFA változásaival (r= −0,67, o 3. táblázat: NEFA és adipocita hormonok
Vita
A béta-sejtek működésére vonatkozó adataink nem összehasonlíthatók közvetlenül a korábbi vizsgálatokban kapott adatokkal [5, 8, 9], a különböző műtéti technikák (a vertikális sávos gasztroplasztika variánsai) és a béta-sejtfunkciós tesztek (arginin és i.v. glükóz infúziók) miatt. Ezek a vizsgálatok a plazma inzulin válasz csökkenését és az inzulin érzékenység növekedését találták; a két paraméter szorzataként számított diszpozíciós index vagy a műtét után szignifikánsan megemelkedett [5], vagy változatlan [8, 9], ami a béta sejtek működésének javulására vagy fenntartására utal. A béta sejtfunkciók változásainak helyes felmérése azonban olyan paraméterek révén, mint a diszpozíciós index, megköveteli, hogy a béta sejt funkció paraméterei függetlenek legyenek a glükózszinttől, és egyértelműen kapcsolódjanak az inzulinérzékenységhez egy kontrollcsoportban [20]. A kontroll alanycsoportunkban az inzulinérzékenységgel korreláló paraméter a teljes inzulinmennyiség volt, ami azonban egy olyan index, amely szorosan függ a glükózszinttől. Így bár műtét utáni eredményeink fokozott inzulinérzékenységet és csökkent orális glükózra adott inzulinszekréciós választ mutatnak (3. ábra), a kompenzáció mértékének pontos értékelése a csoportokban nem volt lehetséges.
Hasonló okokból a béta-sejt működésére vonatkozó jelenlegi eredményeket nem lehet közvetlenül összehasonlítani a hasonló betegeknél iv. glükóz teszt [7]. Ez a tanulmány kimutatta, hogy a bariatrikus műtét helyreállította az első fázis inzulinszekrécióját. Béta sejtes modellünkben az akut inzulinválaszhoz kapcsolódó paramétert, nevezetesen a sebességérzékenységet a kezelés nem befolyásolta szignifikánsan (2. táblázat). Ennek oka lehet az OGTT elégtelen ereje az akut inzulin szekréció változásainak kimutatására [21], amit a sebességérzékenységi paraméter (2. táblázat) nagy változékonysága és szerény reprodukálhatósága [16] is mutat, vagy az intrinsic különbségek az iv glükóz teszt és az OGTT [19].
Ahogy azt a korábbi munka [17–19] elvárta, erős inverz kapcsolatot találtunk a béta sejt glükóz érzékenység és a glükóz tolerancia (mint 2 órás plazma glükóz koncentráció) között. Ez a kapcsolat a műtét után is fennmaradt, de jelentősen meredekebb lett (4. ábra), vagyis ugyanaz a béta-sejt glükózérzékenység társult alacsonyabb glükózszinttel a műtét után, mint a műtét előtt. Ez valószínűleg tükrözi a javult inzulinrezisztencia hozzájárulását a glükóz toleranciához. Valójában a béta-sejt glükózérzékenység és az inzulinérzékenység együttesen magyarázta az átlagos plazma glükózkoncentráció változékonyságának csaknem 70% -át. A regressziós egyenletet alkalmazva, az NGT-csoport inzulinérzékenységével, de a 2-es típusú cukorbetegség béta-sejt glükózérzékenységével rendelkező alany átlagos glükózszintje 7,9 mmol/l lenne, ez az érték az IGT-alanyokéhoz tartozó tartományban lenne ( 7,7–10,3 mmol/l). Az, hogy a teljesnek tűnő glükózfelszívódás mintája [22] a glükózszint további meghatározója, nem állapítható meg jelen vizsgálat eredményeiből.
A jelen tanulmány másik új megállapítása az volt, hogy az OGTT utáni plazma átlagos glükózkoncentrációjának (átlagosan 3,5 mmol/l) és az inzulinérzékenység jelentős javulása a műtétet követő napokon belül történt, bármilyen jelentős súlyvesztés előtt. Ez a korai javulás nem magyarázható az éhomi plazma NEFA, leptin vagy adiponectin koncentrációk változásával, amelyek minimálisak voltak az első 10 napban. Úgy tűnik, hogy ez a korai hatás nem kapcsolódik a műtéthez kapcsolódó nem specifikus tényezőkhöz, például a tápanyagok bevitelének akut csökkentéséhez. Valójában a BPD-n kívüli okokból hasi műtéten átesett és ugyanazt a műtét utáni táplálkozási rendszert kapó betegek csoportjában az inzulinérzékenység - amelyet a jelen tanulmányban alkalmazott technikával azonos módon értékeltek - nem különbözött 4-10 nappal azután, hogy a műtét előtt, és a műtét sem javította a glükóz toleranciát. Kísérleti tervezésünk nyilvánvaló korlátja, hogy a betegeket a műtét után többször nem vizsgálták egymás után. Mindazonáltal az inzulinérzékenység jelentős javulását figyelték meg mind a nyolc vizsgált betegben a műtétet követő 10 napon belül (egy NGT-vel, négy IGT-vel és három 2-es típusú cukorbetegséggel).
Feltételezhető, hogy az inzulinérzékenység valamilyen ismeretlen szabályozóját közvetlenül érinti a BPD. Ezzel kapcsolatban meg kell jegyezni, hogy míg számos műtéti technika a duodenumot a helyén hagyja, a duodenum tranzitja kizárt a standard BPD-ben. Valójában a duodenum kizárása az étkezési tranzitból kulcsfontosságúnak bizonyult a cukorbetegség visszaállításához a Goto – Kakyzaky patkányokban [23]. Így valamilyen eddig ismeretlen, inzulin deszenzibilizáló tulajdonságú anyag termelődik a súlyosan elhízott alanyok nyombélében a tápanyagok átjutása során; az étel tolása a duodenum felé az ilyen anyag felszabadulásának csökkenését eredményezné, ami az inzulin hatásának gyors javulását eredményezné.
Nem mértük azokat a klasszikus emésztőrendszeri hormonokat, amelyek potenciálisan szerepet játszanak a glükóz homeosztázisában (glükózfüggő inzulinotróp peptid, glukagon-szerű peptid 1, ghrelin és mások), amelyekről ismert, hogy a bariatrikus műtét után megváltoznak, és feltételezik, hogy szerepet játszanak a inzulinérzékenység növekedése (pl. [24]). Ezek a hormonok azonban nem tűnnek valószínű jelöltnek, mivel nincs bizonyíték arra, hogy drasztikus változásokat okoznának az inzulinérzékenységben, amint azt ebben a tanulmányban megfigyelték. Másrészt lehetséges a béta-sejtek működésére gyakorolt hatás.
Számos releváns kérdésre vár még válasz. Először is fontos lenne megvizsgálni, hogy a súlyosan elhízott, 2-es típusú cukorbetegségben szenvedő betegek súlyos béta-sejt glükózérzékenysége végül visszatér-e a normális szintre. Másodszor, nem világos, hogy a súlyos elhízás modell mennyiben tükrözi a közepesen elhízott vagy IGT-ben vagy 2-es típusú cukorbetegségben szenvedő, nem elhízott egyéneknél fellépő patofiziológiai folyamatokat. Végül a felső gasztrointesztinális traktus által felszabadított feltételezett tényezők jellegét és dinamikáját megfelelő kísérleti modellekkel kell megvizsgálni állatokon és klinikai tervezéssel emberen.
- A reggeli kortizol alacsonyabb az elhízott, normális glükóztoleranciával rendelkező egyéneknél
- A reggeli kortizol alacsonyabb az elhízott egyéneknél, normál glükóz-tol DMSO-val
- Plazma inzulin- és glükózprofilok normál, elhízott és cukorbetegek belső évfolyamaiban
- Metabolit profil eltérések orális glükóz tolerancia tesztben - a sovány és az elhízott összehasonlítása
- A hosszú távú étrendi beavatkozás anyagcsere- és fogyáshatásai elhízott betegeknél négyéves