A növekedési hormon hatása a karbamidszintézis és a karbamid enzim mRNS szintjének szteroidok által indukált növekedésére
Orvosi Osztály V. és
Orvosi Osztály V. és
Aarhusi Egyetemi Kórház Kísérleti Klinikai Kutatóintézete, DK-8000 Aarhus C; és
Orvosi Osztály V. és
Orvosi Osztály, Állami Egyetemi Kórház, 2100 Koppenhága, Dánia
Orvosi Osztály, Állami Egyetemi Kórház, 2100 Koppenhága, Dánia
Orvosi Osztály V. és
Absztrakt
A szteroid elvesztését részben a szöveti fehérje lebontásának és az amino-N nettó felszabadulásának növekedése, részben az amino-N karbamid-N-ként történő gyorsított májkonverziója okozza (6, 37, 40). Ezzel szemben bebizonyosodott, hogy a növekedési hormon (GH) képes növelni az amino N szövetfelvételét és csökkenteni az amino N N karbamid N formává történő átalakulását (15). Nemrégiben bebizonyosodott, hogy a GH képes megakadályozni a szteroidok katabolikus mellékhatásait emberben (25).
Felvetjük azt a hipotézist, hogy a GH ezen hatása a szteroid katabolizmus megelőzésében a fehérje anyagcserében bekövetkező változás mellett szabályozási eseményeket is tartalmaz a karbamid szintézisének májműködésében, és ez összefügg a génfunkciók szabályozásával.
Patkányokban lehetséges a karbamidszintézis szubsztrát-meghajtáshoz viszonyított standardizálása az karbamid-N szintézis kapacitásának mérésével telített alaninterhelés alatt (18), ezáltal lehetővé téve a karbamidszintézis specifikus hormonális hatásainak tanulmányozását.
Megvizsgáltuk a 7 napos prednizolon- és GH-kezelés hatását külön-külön és együttesen a karbamid N szintézis kapacitására, a karbamid ciklus enzimek mRNS szintjének expressziójára a májban, a szövetek N tartalmára a különböző szövetekben és az egész test N egyensúlyára.
Állatok
A nőstény Wistar patkányokat (testtömeg 200–210 g; Møllegaard Tenyésztési Központ, Eiby, Dánia) 22 ± 2 ° C-on, 55 ± 10% relatív páratartalom mellett, a levegő változását óránként 8–10-szer, és 12: 12-kor tartottuk. -h világos-sötét ciklus (0630–1830 fény). Az állatok szabad hozzáférést kaptak a szokásos táplálékhoz (Altromin diéta 1324; Chr. Petersen, Slagelse, Dánia) és csapvízhez.
Minden patkányt naponta lemértek a kezelés alatt és a kísérleti eljárások előtt. Az ételek és a víz bevitelét minden nap rögzítették minden ketrecben, mindegyik két patkányt tartalmazott. Két nappal a vizsgálati eljárások előtt az összes patkányt egyenként metabolikus ketrecekben helyezték el az N-egyensúly meghatározása céljából.
Protokollok
Öt vizsgálati csoport volt: 1) kontroll patkányok (n = 20), sóoldat szubkután naponta kétszer, 7 napig;2) prednizolonnal kezelt patkányok (n = 20), 4 mg/kg prednizolon (Delcortol; LEO) szubkután naponta egyszer, 7 napig;3) páros táplálású kontroll prednizolonnal kezelt patkányokon (n = 20), sóoldat szubkután naponta kétszer, 7 napig;4) GH-val kezelt patkányok (n = 20), 1 mg/kg GH szubkután (Novo Nordisk) naponta kétszer, 7 napig; és5.) GH- és prednizolonnal kezelt patkányok (n = 20), 4 mg/kg prednizolon és 1 mg/kg GH szubkután.
Kísérleti vizsgálatokat végeztek olyan prednizolon dózisok megszerzésére, amelyek jelentős súlyvesztést eredményeznének. Az emberi dózis ekvivalens lenne az, amelyet például gyulladásos bélbetegségekben alkalmaznak. Az alkalmazott GH dózisok megegyeznek a hipofizektomizált patkányok szubsztitúciós dózisaival. Minden vizsgálati csoport nyolc állatában egy éjszakai böjt után meghatároztuk a vér α-amino N (AAN) koncentrációját, a karbamid szintézis sebességének kapacitását (CUNS) és az egész test N egyensúlyát. Az alap inzulint és a glükózt meghatároztuk az inzulinérzékenység és az összes inzulinszerű növekedési faktor I (IGF-I) értékelésére a kezelés ellenőrzésére. A máj, a vese, a soleus és az extensor digitorum longus (EDL) N-tartalmát az öt karbamidciklus enzim, a karbamoil-foszfát-szintetáz (CPS), az ornitin-transz-karbamoiláz (OTC), az arginino-szukcinát-szintetáz (ASS) máj mRNS-szintjével határoztuk meg. arginino-szukcinát-liáz (ASL) és argináz (ARG), mindegyik csoport nyolc állatában. A CUNS-okat és az mRNS-eket külön, de másként azonos módon kezelt állatokban mértük, ami biztosítja, hogy a CUNS-meghatározások aminosavterhelése nem befolyásolta a génexpressziót.
Kísérleti eljárások
Közvetlenül a lefejezés után a szerveket elkülönítettük és lemértük szűrőpapíron történő blotolás után, azonnal lefagyasztottuk folyékony N-ben és -80 ° C-on tároltuk az elemzésig. Az I típusú izomrostok túlnyomórészt a soleusban találhatók (84% I. típusú, 16% IIa típusú, 0% IIb típusú), a II. Típusú szálakat főleg EDL képviseli (3, 57 és 40%; lásd a 24. hivatkozást); a nem izomfehérjét a máj és a vesék tartalma alapján vizsgálták. Az N egyenleget a következőképpen értékeltük. A vizsgálati időszak utolsó 2 napján az állatokat metabolikus ketrecekben helyezték el, és meghatározták az egyes állatok által elfogyasztott táplálék mennyiségét. A mennyiségileg összegyűjtött vizelet mintáiból elemeztük a teljes N- és karbamidtartalmat, a székletmintákból pedig az N-tartalmat. Ezekből a mérésekből kiszámolták az N-egyensúlyt (mmol/24 óra) ennek a 2 napnak az átlagaként, a napi változások minimalizálása érdekében.
CUNS. Anesztézia után 0,75 ml/kg Hypnorm (fentanil/fluanizon; Jansen Pharma, Birkeroed, Dánia) és 4 mg/kg midazolám (Dormicum; La Roche, Bázel, Svájc) szubkután injekcióval, katéter (Neoflon 0,6 mm; Viggo- Spectramed, Helsingborg, Svédország) a femorális vénába helyeztük folyamatos infúzió céljából. Minden állatban (n = 8 minden csoportban), a retroperitoneális bilaterális nephrectomiát (a karbamidszintézis meghatározásának megkönnyítése érdekében lásd alább) közvetlenül a vizsgálat megkezdése előtt végeztük (18). Ez az eljárás önmagában nem befolyásolja akutan a CUNS-okat (18), amelyek a méheltávolítás után 12 óráig változatlanok maradnak, és a legnagyobbak 24 óra után (21). Vérmintákat vettünk a retrobulbáris vénás plexusból heparinizált mikropipetták segítségével (Vitrex; Horsens Laboratory Equipment).
A CUNS meghatározásához az alanint testtömeg szerint, 0,7–0,9 ml 1120 mmol/l steril vízben készült oldat bolusaként adtuk be, majd folyamatos 2,8–3,5 ml/h 224 mmol/l oldat 70 percig történő infúziójával. percig injekcióval (Perfusor Secura; Braun, Melsungen, Németország). Az állandó állapotú vér AAN-értékét 10% alatti ingadozásként határoztuk meg a vizsgálat legalább 50 percében, és az alanin-infúzióval az egyensúlyi állapotban lévő teljes vér AAN-értékét 7,3 és 11,6 mmol/l között értük el; ebben az intervallumban a karbamid szintézis patkányokban maximálisan, azaz telített, és így független a szubsztrát koncentrációjától (18). Vért vettünk (100 μl) 10 perces időközönként a kezdeti 20 perces egyensúlyi periódust követően a vér karbamidjának és a teljes AAN meghatározásához. Összesen 1 ml vért távolítottunk el. Ezt a térfogatot alanin infúzióval kompenzáltuk.
Az IGF-I plazmát, a glükózt és az inzulint minden állatnál azonnal meghatároztuk az érzéstelenítés és a nephrectomia után.
mRNS meghatározások
Minden vizsgálati csoport hat különálló, de másképp kezelt patkányának bal lebenyéből kb. 200 mg májszövetet azonnal folyékony N-ben tároltunk. A teljes RNS-t Promega kit Z 5110-gyel izoláltuk tiocianát módszer alapján, a gyártó.
Az összes próba specifikusságát Northern-blotok autoradiográfiájával állapítottuk meg, a hibridizációs jeleket mutatva a várható helyeken. Slot blotokat használtunk az mRNS-szintek mennyiségi meghatározásához Schleicher és Schuell Minifold alkalmazásával. Blottolás után a szűrőket ultraibolya térhálósítottuk egy stratalinkerben (Stratagene). Az átlagos kivonási hiba, amelyet ugyanazt a kivonatot 6-10 üregbe becsülték, átlagosan 7% volt. A legutóbbi mérések során ezt az eljárást úgy változtatták meg, hogy most a riboszomális RNS hibridizációját alkalmazzuk mRNS jel indexeként. Ez az eljárásmód nem befolyásolta az eredményeket.
Hibridizáció. Körülbelül 25 ng cDNS-t jelöltek véletlenszerű primer alkalmazással, az RPN 1601Z multiprime kit segítségével (Amersham), és NICK spin oszlopokon (Pharmacia) eluáltuk. Az előhibridizációt 42 ° C-on 1 órán át végeztük 50% -os formamid (Merck), 10x Denhart-oldat (Sigma), 0,05 M Tris (pH 7,4), 1 M NaCl, 1% SDS (tömeg/térfogat), 0,1 oldatában. % nátrium-pirofoszfát (tömeg/térfogat) és 0,25 mg/ml lazac spermium DNS (Sigma); ultrahanggal kezeljük és forrásban lévő vízbe merítjük 15 percig; majd hozzáadjuk az oldathoz. A hibridizációt 42 ° C-on 16 órán át végeztük a fenti oldattal (kivéve a 0,25 mg/ml lazac-spermium DNS-t), hozzáadva a jelzett próbát. Végül a szűrőket kétszer mossuk 0,1 x SSC-vel és 0,5% SDS-rel (tömeg/térfogat) 65 ° C-on 30 percig.
A foszfolképezést egy képalkotó lemezen BASIII készítettük ólomvédő alatt, és a hibridizációs jelet egy Fujix Bioimaging Analyzer BAS2000 rendszerben (Fuji Photo Film) elemeztük.
cDNS-próbák. A cDNS próbák a következők voltak: CPS I, pCPSr PST 850 b (8); OTC, pOTC1 Hind III 388 b (32); ASS, pASr11 PST I 1450 b (38); ASL, AL-2EcoR1 1000b (4); és ARG, 3B1PST I 650 b (10).
A DNS-fragmenseket agarózgél-elektroforézissel elválasztottuk és Spinbind DNS-extrakciós egységeken (FMC) eluáltuk.
Karbamid terjesztési mennyisége
A karbamid megoszlási térfogatát (VD) minden vizsgálati csoport négy nephrectomizált állatában ~ 1 mmol karbamid intravénás bolus injekcióval (D) határoztuk meg. Ezután a vér karbamid-koncentrációját 60 percig követtük. 20 perc elteltével a karbamid eloszlása befejeződött. Az eloszlás térfogatát VD = D/(co - ci) formában számoltuk, ahol D az injektált karbamid mennyisége, co az átlagos karbamid koncentráció a karbamid injekció beadása után 20–60 percen belül, és ci a vér a karbamid koncentrációja közvetlenül a karbamid injekció beadása előtt. A testtömeghez viszonyított VD 64 ± 2% volt az összes kontrollcsoportban, 65 ± 4% a prednizolonnal kezelt patkányokban, 69 ± 3% a GH-val kezelt állatokban, és 68 ± 2% a mind a prednizolonnal, mind a GH-val kezelt patkányokban ( átlag ± SE). Egyik sem különbözött a korábban talált 63% -tól (2), amelyet az összes jelenlegi számítás során használtak.
Bél-karbamid hidrolízis
Az újonnan szintetizált karbamid baktériumok hidrolízise útján elvész a bélben, és a keletkező ammóniát a májban visszaforgatják a karbamid reprodukciójához. Ennek a frakciónak (L) meghatározásához minden csoportból négy patkányt nephrectomizáltunk, és intravénásán 2 μCi [14 C] karbamidot injektáltunk. 20 perc elteltével a [14C] karbamid eloszlása befejeződött. Ezután 10 percenként 70 percig vért vettünk a vérből, hogy meghatározzuk a [14 C] karbamid véraktivitását. A vérminták radioaktivitását a hisafe 2-ben (Wallac) történő megszámlálással mértük folyadék szcintillációs számlálóval (Wallac 1409–2). A vér radioaktivitásának bomlási meredeksége a mikrobiotikus ureáz-függő bélveszteséget tükrözi (L). L értéke 0,14 ± 0,08 a kontrollokban, 0,13 ± 0,09 prednizolonnal kezelt patkányokban, 0,12 ± 0,1 GH-val kezelt állatokban és 0,12 ± 0,09 mind a prednizolonnal, mind a GH-val kezelt patkányokban (átlag ± SE). A kontrollértéket a jelenlegi számítások során használták.
Elemzések
A vér karbamidkoncentrációját az ureáz-Berthelot módszerrel (11) és az összes vér AAN értékét dinitrofluorbenzol módszerrel (13) mértük. A szérum IGF-I-t sav-etanolos extrakció után mértük radioimmunassay-vel (RIA) poliklonális nyúl antitest (Nichols Institute Diagnostics, San Capistiano, CA) és rekombináns humán IGF-I alkalmazásával (Amersham International, Amersham, Bucks, UK). A szérum glükóz értékét kétszer mértük glükóz-oxidáz módszerrel (Beckman oxidatív glükóz-analizátor 700). A szérum inzulint RIA-val mértük, rekombináns humán 125 I-inzulint használva nyomjelzőként, tisztított patkány inzulint standardként és poliklonális tengerimalac antitestet (az összes reagens a Novo Nordisk, Bagsværd, Dánia cégtől). Valamennyi mintát három ismétlésben elemeztük egy vizsgálatban. Az N szervtartalmat a korábban leírt mikro-Kjeldahl-technikával határoztuk meg (3).
Számítások
Az N egyenleget a következőképpen számították ki:
Statisztikai módszerek
Az eredményeket átlagként ± SE-ként adjuk meg. A statisztikákat a Solo Statistical Software csomag (BMDP Statistical Software, Los Angeles, CA) segítségével végeztük. Az adatokat egyirányú varianciaanalízissel elemeztük, majd Student-Newman-Keuls módszerrel, több összehasonlítás céljából, adott esetben. Kétfarkú P 0,05 alatti értéket tekintettünk szignifikánsnak.
Takarmánybevitel
A 7 napos prednizolon-kezelés 20% -kal csökkentette a takarmányfelvételt (P 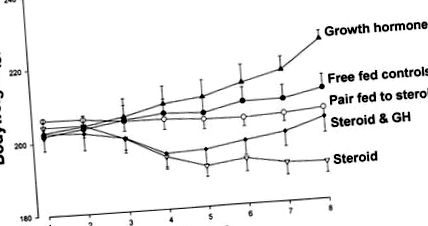
1. ábra.A patkányok testtömege 7 napig placebóval (szabadon táplált kontrollok, •), 4 mg ⋅ kg –1 ⋅ nap –1 prednizolonnal (szteroid, ▿), placebóval és prednizolonnal kezelt állatokkal párosítva (pár szteroiddal etetett, ○), 1 mg ⋅ kg −1 ⋅ nap −1 növekedési hormon (GH, ▴), vagy prednizolon plusz GH (szteroid és GH, ◆).
2. ábra.N egyensúly mint átlag nap 6–8bármelyik placebóval (Con,n = 8), 4 mg ⋅ kg −1 ⋅ nap −1 prednizolon (szteroid), placebo és pár prednizolonnal kezelt állatoknak (Stpf), 1 mg ⋅ kg −1 ⋅ nap −1 GH vagy kombinált prednizolon és GH ( ST + GH). A rudak jelentése ± SE. * Jelentős különbség (P # Jelentős különbség (P
N szerv tartalma (mg N)
A szervtömeg és az N-szervtartalom változásai párhuzamosak voltak, és csak az utóbbi adható meg. A prednizolon csökkentette a szív és a vázizmok N-tartalmát, míg a máj és a vese N-tartalma változatlan maradt. A GH kezelés növelte az összes mért szerv N-tartalmát. A kombinált kezelés növelte a máj és a vese N-tartalmát, valamint normalizálta a szív és az EDL N-tartalmát (1. táblázat).
1. táblázat: N szervi tartalom
Az értékek átlag ± SE; n = 8 patkány az összes csoportban. Az egységek: mg N. EDL, extensor digitorum longus; GH, növekedési hormon.
* P † P
3. ábra.A vér α-amino-N koncentrációja (tetejére,n = 8) és a karbamid N szintézisének kapacitása (CUNS; alsó) kontrollokban, szteroidokkal kezelt patkányokban (4 mg ⋅ kg –1 ⋅ nap –1), kontroll párokban prednizolonnal kezelt állatokban (Stpf), GH-val kezelt patkányokban (1 mg ⋅ kg –1 ⋅ nap –1), és prednizolonnal és GH-val kombináltan kezelt patkányok. A rudak jelentése ± SE. * Jelentős különbség (P # Jelentős különbség (P
Basal Blood AAN
A prednizolon 15% -kal és 33% -kal csökkentette a bazális vér AAN-értékét a szabad és a páros táplálású kontrollokhoz képest (P
4. ábra.A karbamoil-foszfát-szintetáz (CPS), az ornitin-transz-karbamiláz (OTC), az arginino-szukcinát-szintáz (ASS), az arginino-szukcinát-liáz (ASL) és az argináz (ARG) mRNS-szintjének változásai a májszövetben prednizolon-kezelés után (4 mg ⋅ kg −1 ⋅ nap −1;A, n= 8), GH kezelés (1 mg ⋅ kg −1 ⋅ nap −1;B), valamint kombinált prednizolon- és GH-kezelés (C). Az eredmények 6 patkány ± SE átlagértékei, 6 párral táplált patkány átlagértékének százalékában kifejezve. A kikelt sáv szélessége jelzi a kontrollértékek változását. * Statisztikailag szignifikáns különbség (P
2. táblázat: Glükóz és hormonok
Az értékek átlag ± SE; n = 8 patkány az összes csoportban. IGF-I, inzulinszerű növekedési faktor I.
SZERZŐ MEGJEGYZÉSEK
Az újranyomtatási kérelmek címe: T. Grøfte, V. Orvosi Osztály (Hepatológia és Gasztroenterológia), Aarhus Univ. Kórház, DK-8000 Aarhus C, Dánia.
- A növekedési hormon (GH) kezelésének hatása az étkezés szabályozására - Teljes szöveg nézet
- Az étrendi fehérje hatása a máj növekedésére, frakcionált fehérjeszintézisére és lebomlási sebességére
- A magas fehérjetartalmú étrend hatása a Ghrelin, a GH (növekedési hormon) és az IGF-1 24 órás profiljára
- Böjt és növekedési hormon - Diet Diet
- Az időszakos táplálás hatása a vízminőségre, a bőr parazitáira, a takarmányfogyasztásra és a növekedésre