A nyombél-jejunális bypass megvédi a GK patkányokat a β-sejtek elvesztésétől és a hiperglikémia súlyosbodásától, és megnöveli a GIP-t és a GLP-1-et együtt expresszáló enteroendokrin sejteket.
Molekuláris és Sejtorvosi Laboratórium, Sejt- és Élettani Tudományok és Sebészet Tanszékei, Élettudományi Intézet, British Columbia Egyetem, Vancouver, British Columbia, Kanada;
Molekuláris és Sejtorvosi Laboratórium, Sejt- és Élettani Tudományok és Sebészet Tanszékei, Élettudományi Intézet, British Columbia Egyetem, Vancouver, British Columbia, Kanada;
Szöuli Nemzeti Egyetem Orvostudományi Egyetem Belgyógyászati Klinikája, Szöul, Dél-Korea; és
Molekuláris és Sejtorvosi Laboratórium, Sejt- és Élettani Tudományok és Sebészet Tanszékei, Élettudományi Intézet, British Columbia Egyetem, Vancouver, British Columbia, Kanada;
Gyomor-bélrendszeri anyagcsere-sebészet, Sebészeti Osztály, Cornell Egyetem Weill Orvosi Főiskolája, New York, Presbiteriánus Kórház, New York, New York
Molekuláris és Sejtorvosi Laboratórium, Sejt- és Élettani Tudományok és Sebészet Tanszékei, Élettudományi Intézet, British Columbia Egyetem, Vancouver, British Columbia, Kanada;
Az újranyomtatási kérelmek és egyéb levelezés címe: T. J. Kieffer, Celluláris és Élettani Tudományok Osztály, Élettudományi Intézet, Univ. of British Columbia, 2350 Health Sciences Mall, Vancouver, BC, Kanada V6T 1Z3 (e-mail: [e-mail védett]).
Absztrakt
Bár a bypass eljárás után javuló glükóz homeosztázis pontos mechanizmusa nagyrészt megfoghatatlan, az enteroendokrin rendszerben az enteroinsuláris tengelyből vagy az inkretinekből álló változás jelenleg a legvalószínűbb magyarázatnak tekinthető (26, 39, 47). Ebben a tekintetben az enteroendokrin sejtpopuláció megváltozhat a bypass műtétet követően, mivel a gyomor-bélrendszer nyálkahártyájának anatómiai és fiziológiai plaszticitása számos körülmény között zajlik, beleértve a bariatrikus műtétet is (21, 23, 26, 37, 42). Tudomásunk szerint azonban még nincsenek olyan beszámolók, amelyek a bariatrikus műtét után megvizsgálnák az enteroendokrin sejtpopulációt. Ezért megvizsgáltuk a DJB hatását a hosszú távú glikémiás kontrollra, a plazma inkretin szintre, a β-sejtek tömegére, a szigeti fibrózisra és az enteroendokrin sejtpopulációk változásaira a Goto-Kakizaki (GK) patkányban, amely jól ismert állatmodell nem bese 2-es típusú cukorbetegség, amely Wistar patkánytelepből származik.
Állatok.
A hím 9 hetes GK patkányokat a Taconic-tól (Hudson, NY), a hím 6 hetes Wistar patkányokat a British Columbia Egyetem Állattenyésztési Központjától (Vancouver, BC, Kanada) vásároltuk. Valamennyi állatot egyedi ketrecekben, állandó környezeti hőmérsékleten és páratartalom mellett, 12: 12 órás világos-sötét ciklusban helyeztük el, és a vizsgálat során standard patkánytojással (LabDiet 5012; PMI Nutrition International, Brentwood, MO) etettük. Valamennyi tanulmányt a British Columbia Egyetem Állattenyésztési Bizottsága hagyta jóvá, és azokat a Kanadai Állatgondozási Tanács irányelveivel összhangban hajtották végre.
Sebészeti beavatkozások és monitorozás.
Orális glükóz tolerancia teszt és intraperitoneális glükóz tolerancia teszt.
Éjszakai éhgyomorra vagy 40% -os glükózoldattal (1 g/kg) orális glükóztolerancia-tesztet (OGTT) vagy intraperitoneális glükóztolerancia-tesztet (IPGTT) hajtottak végre. A farokvénák vérmintáinak glükózszintjét glükométerrel (One Touch Ultra) mértük 0, 10, 20, 30, 60, 120 és 180 perccel a glükóz beadása után. Ugyanakkor a vért (0,25 ml) heparinizált kapilláris csövekkel gyűjtöttük a farokvénából, mikrocentrifuga csövekbe helyeztük és centrifugáltuk, mielőtt a plazmamintákat -20 ° C-on tároltuk volna a hormonvizsgálatokig. A glükóz görbe alatti területét (AUC) trapezoid módszerrel számoltuk.
Vegyes étkezési tolerancia teszt.
Vegyes étkezési tolerancia tesztet végeztünk egy éjszakai böjt után, 38 hét múlva a műtét után. Vegyes ételt (11,7 g/dl szénhidrát, 3,7 g/dl fehérje, 1,8 g/dl zsír, Shapers; Pharmaprix, Toronto, ON, Kanada) adtunk be szájon át 6 ml/testtömeg-kg dózisban. A farokvénák vérmintáinak glükózszintjét glükométerrel (One Touch Ultra) mértük 0, 10, 20, 30, 60, 120 és 180 perccel étkezés után. Ugyanakkor a plazmamintákat összegyűjtöttük és -20 ° C-on tároltuk a hormonvizsgálatokig.
Inzulin tolerancia teszt.
Egy éjszakán át tartó böjt után 0,4 NE/kg humán normál inzulin (Novolin; Novo Nordisk, Toronto, ON, Kanada, Kanada) adagját intraperitoneálisan injektáltuk eszméleténél lévő patkányokba. A vércukorszintet glükométerrel (One Touch Ultra; Life Scan) mértük az alapvonalon és az inzulininjekciót követően 10, 20, 30, 60 és 120 perccel.
Hormonvizsgálatok.
A plazma teljes GIP szintjét ELISA-val (Millipore, Billerica, MA) vizsgáltuk. A plazma inzulint és az összes GLP-1 szintet (GLP-17–36 amid és GLP-17–37) a Meso Scale Discovery (Gaithersburg, MD) készletével vizsgáltuk a gyártó utasításainak megfelelően.
Immunfestések.
Hisztomorfometrikus elemzés.
A testösszetétel elemzése.
A méréseket Bruker Biospec 70/30 7 Tesla MRI szkennerrel (Bruker Biospin, Ettlingen, Németország) végeztük. A testből származó nukleáris mágneses rezonancia jelet kvadrátum térfogatú, 300 MHz-re hangolt RF tekercs segítségével nyertük. A testnedveknek (pl. Vizelet és cerebrospinalis folyadék) megfelelő „szabad” vízkomponens tipikusan az volt 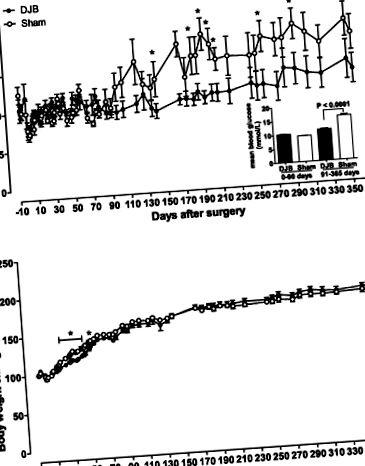
1. ábra.Vércukorszint (A) és a testtömeg növekedése az alapvonaltól (B) Goto-Kakizaki (GK) patkányokban műtét után. A vércukorszintet és a testtömeget táplált körülmények között mértük 0900-kor. A, betét, mutatja a vércukorszint átlagát a korai (0–90 nap) és a késői posztoperatív időszakokban (91–365 nap). A testtömeg normalizálódott az alapérték alapján. ○ színlelt csoportos állatok; ● duodenal-jejunal bypass (DJB) csoport. Az adatokat átlag ± SE (n = 4–6 csoportonként). *P
Az OGTT-ket és az IPGTT-ket 1, 3, 5, 10 és 18 hét múlva végeztük a műtét után. A táplált állapotú vércukor adatokkal ellentétben az OGTT és az IPGTT AUC-értékei nem különböztek a DJB és a színlelt csoportok között (2. ábra, A és B). Azonban a táplált állapotú vércukorszinttel összhangban az étkezés utáni vércukorszint 120 perccel a vegyes étkezést követő 38 héttel a műtét után szignifikánsan alacsonyabb volt a DJB csoportban, mint a színlelt csoport (2. ábraC). A műtét utáni 43 hetes inzulin-tolerancia teszttel vizsgált inzulinérzékenység összehasonlítható volt a csoportok között (2. ábraD).
2. ábra.A vércukorszint görbe alatti területe (AUC) az orális glükóz tolerancia teszt során (OGTT; A) és intraperitoneális glükóz tolerancia teszt (IPGTT; B) GK patkányokban a műtét utáni hetekben. Az AUC-t trapéz módszerrel számoltuk. C: kevert étkezési tolerancia tesztet 38 hét múlva végeztek műtét után GK patkányokban. D: az inzulin-tolerancia tesztet 43 hét múlva végeztük műtét után 0,4 NE/kg inzulinnal GK patkányokban. Az adatokat átlag ± SE (n = 5–6 csoportonként). *P
A műtét után 1 hét múlva nem volt szignifikáns különbség a plazma inzulin- és GIP-szintjeiben az OGTT-k során, míg a plazma GLP-1 szintje enyhén emelkedett a DJB csoportban anélkül, hogy nyilvánvaló csúcsot mutattak volna (3. ábra, A-C). A műtét után 18 hét múlva az álcsoporthoz képest az OGTT során a plazma inzulinszint általában magasabb volt a DJB csoportban, bár nem érte el a statisztikai szignifikanciát (P az értékek 0,118 és 0,281 között vannak; 3. ábraD). Érdekes módon a plazma GLP-1 és GIP szintje az OGTT alatt szignifikánsan magasabb volt a DJB csoportban (3. ábra, E és F). A kevert étkezési tolerancia tesztben, amely szignifikáns különbségeket produkált az étkezés utáni glükózszintekben (2. ábraD), a plazma inzulin és a GLP-1 szintje szignifikánsan magasabb volt a DJB csoportban, mint a színlelt csoportban (3. ábra, G és H), míg a plazma GIP szintekben nem volt különbség (3. ábraén). A vegyes étkezési tolerancia teszt eredményeivel összhangban a plazma inzulin és a GLP-1 szintje a 32. hét magasabbak voltak a DJB csoportban az álcsoporthoz képest (1913 ± 288 vs. 641 ± 229 pg/ml az inzulinnál), P = 0,0064, és 31 ± 1 vs. 22 ± 3 pg/ml a GLP-1 esetében, P = 0,015, ill.
3. ábra.Plazma inzulin, glukagon-szerű peptid-1 (GLP-1) és glükózfüggő inzulininotróp polipeptid (GIP) szintje az OGTT alatt 1-nél (A-C) és 18 hét (D-F) műtét és vegyes étkezési tolerancia teszt a műtét után 38 hét múlva (G-én) GK patkányokban. ○ színlelt csoportos állatok; ● DJB csoport. Az adatokat átlag ± SE (n = 5–6 csoportonként). *P
A GK patkányok hasnyálmirigyében az inzulinfestés szabálytalannak tűnt, tengeri csillagszerű megjelenéssel, ami ezen állatok jól ismert jellemzője (20). Ez a szabálytalanság még jobban megmutatkozott a színlelt csoportban, mint a DJB csoportban (4. ábraA, tetejére). Masson trichromfestése kiterjedtebb intraislet fibrózist mutatott ki a színlelt csoportban a DJB csoporthoz képest (4. ábraA, alsó). A kvantitatív planimetriás elemzések egyértelmű egyértelműségeket tártak fel; a DJB állatoknak magasabb volt a β-sejtek területe és alacsonyabb az intraislet fibrózisa, mint a színlelt állatoknak (4. ábra, B és C).
4. ábra.β-sejtek területe és szigeti fibrózis GK patkányokban. A: reprezentatív képek; tetejére 2 kép inzulin immunhisztokémiai festés, és alsó 2 kép Masson trichrom festése állatokból 1 évvel a műtét után. A hasnyálmirigy-szigetek sárga pontozott vonalakkal vannak elhatárolva, a kollagén rostokat kék színnel festik a Masson-féle trichromfestéses képek. Vegye figyelembe az erek körüli normál kollagénrostokat. Mérlegsorok, 100 μm. A β-sejtek planimetriás elemzésének eredményei (B) és a szigeti fibrózis (C) átlagosan ± SE (n = 5 a DJB csoportnál és n = 4 a színlelt csoport esetében). *P
5. ábra.A bél bruttó szövettana GK patkányokban. A DJB csoportba tartozó állatok duodenumának reprezentatív képei (A), a színlelt csoport duodenuma (B), a DJB csoport mellékelt jejunuma (C), és a színlelt csoport megfelelő jejunuma (D) kerülnek bemutatásra. Mérlegsorok, 200 μm. E: a villi hosszúságának ± SE-je (n = 4 csoportonként). Fehér oszlopok, színlelt csoport; fekete sávok, DJB csoport.
6. ábra.A bél endokrin sejtjeinek sűrűsége GK patkányokban. A: reprezentatív hármas immunfluoreszcens képek a DJJ csoportba tartozó állatok jejunumából. Minden kép GIP (zöld), GLP-1 (piros) és 4,6-diamidino-2-fenilindol (DAPI) magfolt (kék) fedvénye. A GIP és a GLP-1 kolokalizációja ugyanabban a sejtben sárga színűnek tűnik (K/L sejt). Mérlegsorok, 10 μm. B: bél endokrin sejtsűrűség. A K sejtek GIP (+)/GLP-1 (-) sejtek, az L sejtek GIP (-)/GLP-1 (+) sejtek, a K/L sejtek pedig GIP (+)/GLP-1 (+) sejtek . A K, L és K/L sejtek sűrűségét a GIP-pozitív sejtek (átlag 226), GLP-1-pozitív sejtek (átlag 322), valamint a GLP-1 és a GIP kopozitív sejtek számaként (átlag 187) ) a teljes villiák számával normalizálva (átlagosan 420 villát a duodenum és 473 villát a jejunum esetében) egy adott hosszanti bélszakaszban. Fehér oszlopok, színlelt csoport; fekete sávok, DJB csoport. Az adatokat átlag ± SE (n = 4 csoportonként). *P
Nem elhízott, cukorbetegség nélküli Wistar patkányvizsgálat.
A GK patkányok eredményeivel ellentétben a vércukorszint a Wistar patkányok táplált állapotában szerényen, de szignifikánsan magasabb volt a DJB csoportban, mint a színlelt csoportban (7. ábraA). A testtömeg és a táplálékfelvétel időnként kissé különbözött a csoportok között (7. ábraB, betét). Az etetett állapotú glükózszintnek megfelelően a DJB állatoknál a műtét után 3 és 9 hét múlva végzett OGTT-k során csökkent a glükóz tolerancia (7. ábra, C és D, illetőleg; Az AUC-k 1451,5 ± 76,6, szemben 1 134,5 ± 85,8, P = 0,028 at 3. hét, 1 334,2 ± 31,3 vs. 1 139,5 ± 79,0, P = 0,041 at 9. hét), amely 3 hét múlva késleltetett inzulinválaszhoz kapcsolódott (7. ábraE) és tompított inzulinválasz 9 hét műtét után (AUC: 132 334,0 ± 13 279,9 vs. 198 278,8,8 ± 23 791,5, P = 0,037; 7. ábraF). Nem volt különbség a vércukorszintben az IPGTT és az inzulinérzékenység során az ITT segítségével (az adatokat nem közöljük).
7. ábra.A DJB hatása nem cukorbeteg Wistar patkányokra. Fed állapotú vércukorszint (A) és a testtömeg (B) a vizsgálati időszak alatt a vércukorszint az OGTT-k során 3-kor (C) és 9 hét (D) műtét után, és a plazma inzulinszint az OGTT-k során 3 (E) és 9 hét (F) a műtét után láthatóak. A vércukorszintet és a testtömeget táplált állapotban mértük 0900-kor. B, betét, mutatja a napi táplálékfelvétel mennyiségét. ○ színlelt csoportos állatok; ● DJB csoport. Az adatokat átlag ± SE (n = 5 a DJB csoportnál és n = 4–5 a színlelt csoport esetében). *P
A GK patkányra, a Wistar patkány kolóniájából származó, jól nem vizsgált 2-es típusú cukorbetegség jól vizsgált állatmodelljére az extenzív fibrózissal társuló β-sejtvesztés jellemző, amelyet magas szénhidráttartalmú étrend fokozhat és csökkentheti GLP-1 kezelés (41). Ebben a tanulmányban azt tapasztaltuk, hogy a DJB javította az étkezés utáni glikémiát GK patkányokban azáltal, hogy csillapította a β-sejtvesztést és a szigeti fibrózist. A fokozott inzulinszekréció a megnövekedett GLP-1 szekrécióval járt. Megfigyeltük továbbá a megnövekedett K/L sejtek számát a gyomorba anasztomizált jejunumban GK patkányokban. Ezek az eredmények együttesen olyan lehetséges mechanizmusokat nyújtanak, amelyek elmagyarázzák a DJB vagy az előlap kizárásának hosszú távú jótékony hatásait a glükóz homeosztázisra.
Vizsgálatunk egyik legkézenfekvőbb eredménye a megőrzött β-sejtek tömege csökkent szigeti fibrózissal együtt DJB-GK patkányokban. Mivel a beszámolók szerint az ileum transzpozíció csökkenti a szigeti fibrózist GK patkányokban (26), a bélből származó tényezők fontos szerepet játszhattak a szigeti fibrózis csillapításában a DJB műtétek során. Ez a β-sejt védőhatás döntő lehet a 2-es típusú cukorbetegség hosszú távú remissziójában az emberek gyomor bypass műtétje után (29). Nemrégiben beszámoltak arról, hogy az exenatiddal, a GLP-1 analógdal végzett kezelés az 1 éves kezelés után 2,5-szeresére javította a β-sejtek működését, amelyet a C-peptid szekréciója adott az inzulinkezeléshez képest (7). Tekintettel arra, hogy a 2-es típusú cukorbetegséget a β-sejtek működésének könyörtelen csökkenése jellemzi (30, 43), ezek az eredmények, beleértve a mi eredményünket is, arra utalnak, hogy a bél anatómiai átrendeződése a GLP-1 szekréció növelése érdekében megőrizheti a hasnyálmirigy β-sejt tömegét és/vagy funkció.
SZERZŐ MEGJEGYZÉSEK
* Ez a két szerző egyformán járult hozzá ehhez a cikkhez, és társszerzőként kell őket tekinteni.
- Extra erősségű fogyókúrás termék férfiaknak és nőknek Japanese️ Japán étrend fogyás 13 napos CREA-RS
- Fogyókúra stratégiák fogyás tanácsadás at
- Céline Dion fogyás - hogyan fogyott az énekesnő
- Cotillard; Terhesség fogyás kemény
- Diétás tippek a pattanások és a hajhullás egészségének kezelésére