A nyugati étrend krónikus fogyasztása erőteljes gliaaktivációt vált ki az öregedő egerekben és az Alzheimer-kór egérmodelljében
Tárgyak
Absztrakt
Bevezetés
A nyugati étrend tápanyaghiányt és gyulladást okozhat, amely közvetlenül befolyásolhatja a megismerést. A nyugati étrend fizikai inaktivitással kombinálva azonban elhízáshoz vezethet, ami növeli a kognitív hanyatlás és az AD kialakulásának kockázatát. Jelenleg a 65 év feletti amerikaiak több mint 35% -a, a középkorú (40–59 éves) egyének 40% -a elhízott 24. Egyes tanulmányok azt mutatják, hogy az elhízás, különösen a középkorú elhízás, a kognitív hanyatlás és az AD hatszorosára növeli a 8,9-es esélyt. A fokozott immunválasz, például a gyulladás a nyugati étrend és/vagy az elhízás egyik fő következménye. Több tanulmány azt sugallja, hogy a megnövekedett agyi veleszületett immunválasz (vagy neuroinflammation) összefüggésben áll a memóriavesztéssel a különböző betegségekben szenvedő betegeknél, beleértve az AD-t és a traumás agysérülést 25, 26. Egerekben a magas zsírtartalmú étrend fogyasztása neuroinflammációt és kognitív hanyatlást okozott 17,19,22. Ezek az eredmények arra utalnak, hogy az étrend által kiváltott immunválaszok befolyásolják az AD-re való hajlamot vagy annak progresszióját, de a károsnak tekinthető specifikus immunválaszokat - előnyösnek tekintve - még nem határozták meg.
A legfrissebb adatok arra utalnak, hogy a mieloid sejtek veleszületett immunválaszai, például a rezidens mikroglia és a vérből származó makrofágok beszűrődése valószínűleg fontos kapcsolatot jelentenek a nyugati étrend, a kognitív hanyatlás és az AD között. Például az elhízás okozta gyulladás a myeloid sejtek növekedését eredményezi számos szövetben, beleértve az agy 27,28-át is. A magas szintet expresszáló myeloid sejtek (beleértve a rezidens mikrogliákat és az infiltráló makrofág monocitákat) TREM2 hozzájárulnak a kognitív hanyatláshoz és a demenciához 29,30,31. A TREM2 + myeloid sejtek az AP 29,32 egérmodelljeiben is jelen vannak a plakkok körül. Ezeknek a TREM2 + sejteknek a jelenléte beszámolt a neuroinflammatorikus citokinek és a plakkok terhelésének amplifikálásáról az AD egerek 29, 33 modelljeiben. Azt azonban nem vizsgálták, hogy a nyugati étrend befolyásolja-e a TREM2 + sejteket az AD genetikai kockázati tényezőinek hiányában.
Tekintettel arra, hogy több epidemiológiai tanulmány a nyugati étrendet vonja maga után az AD-érzékenység és a progresszió kockázati tényezőjeként, olyan egereket állítottunk össze, amelyek szorosan utánozták a nyugati országokban általánosan fogyasztott étrendet. Ez a nyugati diétás kalória magasabb volt a kalóriatartalomban és alacsonyabb a tápanyag-sűrűségben a szokásos egér-étrendekhez képest, és állati eredetű, nem pedig növényi fehérjéket és zsírokat tartalmazott. Ez az első alkalom, hogy a nyugati étrendet alkotó étrendi tényezők kumulatív hatásait vizsgálták egerek agyában. Továbbá, mivel más tanulmányok hajlamosak voltak az étrendi tényezők rövid távú hatásainak értékelésére, a C57BL/6J (B6) és az APP/PS1 egerek etetésével határoztuk meg a nyugati étrend-fogyasztás AD-fogékonyságra és progresszióra gyakorolt hosszú távú hatásait. 8 hónapig (2-10 hónapos korig). Megállapítottuk, hogy a hosszú távú nyugati étrend-fogyasztás drasztikusan megnövelte az asztrociták és a mieloid sejtek agyi veleszületett immunválaszát mind a B6, mind az APP/PS1 mutáns egerekben. A nyugati étrend fokozta a potenciálisan káros gliasejteket a B6 egerekben. Emellett megnövelte a plakkokat körülvevő TREM2 + mieloid sejtek számát, amelyek korreláltak a plakk lerakódásával az APP/PS1 egerekben.
Mód
Egér törzsek és tartás
Egér fenotipizálása
Test felépítés
Az egereket 9 hónapos korukban kettős energiájú röntgenabszorpciós módszerrel (DEXA) értékeltük Lunar PIXImus denzitométerrel (GE Medical Systems), miután az egereket tribromoetanollal (0,2 ml 2% -os oldat/10 g testtömeg) altattuk. A koponya magas csontsűrűsége miatt kimaradt a DEXA-elemzésből. Az egereket Ohaus Navigator skálán mértük InCal kalibrációval az állatok mozgásának befogadására.
Vércukorszint
Az egereket 9,5 hónapos korban, két héttel a szövetbegyűjtés előtt értékeltük Abbott Laboratories AlphaTRAK vércukorszint-ellenőrző rendszerrel. Az egereket a mérés előtt 8 órán keresztül éheztettük, és a farkrészlet segítségével vért gyűjtöttünk.
Szövetgyűjtés, fehérje izolálás és metszet
10 hónapos korban az egereknek halálos dózisú ketamint/xilazint adtunk intraperitoneális injekcióval, és transzkardiálisan perfundáltuk 1xPBS-sel (foszfáttal pufferolt sóoldat). Az agyakat boncoltuk, és a jobb agyféltekét lefagyasztottuk a fehérje izolálásához, míg a bal agyféltekét 4% paraformaldehidben rögzítettük egy éjszakán át 4 ° C-on. A rögzített félgömböket 1xPBS-sel öblítettük, 10% -os szacharózban, majd 30% szacharózban 4 ° C-on krioprotektálva végleg OCT-be (optimális vágási hőmérsékletű vegyület) ágyazottuk. A fagyasztott agyakat 25 μm-en szétvágtuk és -80 ° C-on tároltuk, amíg szükséges volt. A fehérjét Trizol reagenssel (Life Technologies Cat # 15596-018) extraháltuk a gyártó útmutatásait követve. A fehérjepelleteket 1: 1 8 M karbamid és 1% SDS oldatában szuszpendáltuk.
Immunfluoreszcencia, Tioflavin S festés és képrögzítés
A kezdeti megfigyeléseket szakaszosan végeztük hímek és nők részéről. A sejtszám számszerűsítését legalább 4–6 hím egér agyi szakaszain végeztük, mivel nem volt nyilvánvaló különbség a nemek között. A plakkszámláláshoz minden egér esetében meghatároztuk az entorhinalis kérgi régióban jelenlévő plakkok számát. Az IBA1 + sejtek esetében 5 egyforma távolságban lévő képet rögzítettünk (20x optikai lencsét használva) vagy a kéregről, mind az entorhinalis kéreg, mind pedig a hippocampusról, mindegyik egér központi agyrészéből. A NeuN + sejtek esetében 5 egyforma távolságban lévő képet készítettünk (20x optikai lencsével). A plakkokkal társult IBA1 + sejtek esetében agyanként 8+ plakk képét képezték le (20x optikai lencsével). A képeket feldolgoztuk, és a 20x-es kép összes celláját megszámoltuk az ImageJ/FIJI sejtszámláló plugin segítségével. Egyetlen sejtet határoztak meg DAPI-vel festett magként, amely egy sejtspecifikus antitestfestéssel (például IBA1 vagy NEUN) társult. Az egerek 5 képének sejtszámát összesítettük, majd az egereken átlagoltuk. Az egerek számát és az étrendet a sejtek elfedték az összes sejtszámlálási vizsgálathoz.
ELISA
Az Aβ42 szinteket a Life Technologies detektáló készlet (kat. KHB3442) segítségével határoztuk meg, a megadott utasítások szerint. Négy férfi és három nő B6.APB Tg egérmintákat használtunk. A fehérjemintákat 1:50 arányban hígítottuk normál hígító pufferben annak biztosítására, hogy a karbamid és az SDS szintje kompatibilis legyen az ELISA vizsgálati készlettel (kat. KHB3442). Ezután a mintákat összehasonlítottuk egy standard görbével, és meghatároztuk az Aβ42 koncentrációkat a gyártói ajánlásoknak megfelelően.
Statisztikai tesztek
Az adatokat átlag ± SEM-ben fejezzük ki. A statisztikai szignifikanciát ANOVA határozta meg Bonferroni korrekcióval, vagy a Student kétfarkú t tesztjével, amelyet GraphPad vagy Excel segítségével hajtottak végre. Minden tesztnél p
Eredmények
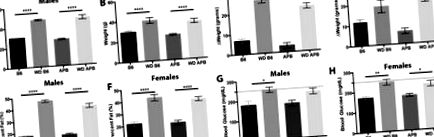
A nyugati étrend elhízást vált ki, de cukorbetegséget nem okoz a B6 egerekben
(A) A hím B6 és B6 súlya (grammban, g) nő.APB Tg miután nyugati étrendet (WD) tápláltak 8 hónapig (p Tg miután 8 hónapig nyugati étrendet tápláltak (p Tg egerek nyugati táplálékkal etettek, összehasonlítva a kontroll chow-val etetett egerekkel (p Tg egerek nyugati táplálékkal etettek, összehasonlítva a kontroll chow-val etetett egerekkel (p Tg hím egerek (p Tg nőstény egerek (p Tg a nyugati étrendet tápláló egerek (p = 0,0072, n = 5). (H) Az éhomi vércukorszint nő a női B6 és B6 esetében.APB Tg egerek táplálták a nyugati étrendet. A pontozott vonal (G, H) a cukorbetegség vércukorszintjét jelzi. (p = 0,001, n = 4).
A nyugati étrend fokozza az ideggyulladást és idegsejtvesztést okoz a B6 egerekben
- A krónikus, magas zsírtartalmú étrend szív hipertrófiát és fibrózist vált ki egerekben
- A krónikus kismedencei fájdalommal küzdő férfiak étrendválasztása és életmódbeli tényezői - interstitialis
- Krónikus fájdalommal küzdő endometriózis és a megkönnyebbülést okozó étrend - cipőtenger
- A Dukan-diéta növelheti a vesebetegség kockázatát. A magas fehérjetartalmú fogyasztás kalciumveséhez vezethet
- Diéta hiperkalémia esetén a káliumfogyasztás csökkentése