A pajzsmirigyhormonok központi hatása az étvágyra
1 Tanulmányi Orvostudományi Kar, Orvostudományi Kar, Londoni Imperial College, 6. emelet, Commonwealth Building, Hammersmith Kórház, Du Cane Road, London W12 0NN, Egyesült Királyság
Absztrakt
Az elhízás világszerte jelentős közegészségügyi probléma. A jelenlegi farmakológiai kezelések nagyrészt sikertelenek. Az ételbevitelt szabályozó komplex utak meghatározása segíthet új kezelések kidolgozásában. A hipotalamusz-hipofízis-pajzsmirigy (HPT) tengelye jól ismert hatással van az energiafelhasználásra, de a táplálékbevitel szabályozásában betöltött szerepe kevésbé jellemzett. A bizonyítékok arra utalnak, hogy a HPT tengely közvetlenül befolyásolhatja az ételbevitelt. A pajzsmirigy diszfunkciójának klinikailag jelentős következményei lehetnek az étvágyra és a testsúlyra. Klasszikusan úgy gondolták, hogy ezeket a hatásokat a pajzsmirigyhormon perifériás hatásai közvetítik. Az utóbbi időben azonban úgy gondolják, hogy a pajzsmirigyhormon helyi szabályozása a központi idegrendszerben (CNS) fontos szerepet játszik az étvágy fiziológiás szabályozásában. Ez a tanulmány a HPT és a pajzsmirigyhormon étvágybeli szerepére összpontosít, és bizonyítékot szolgáltat az elhízás elleni szerek lehetséges új célpontjaira.
1. Bemutatkozás
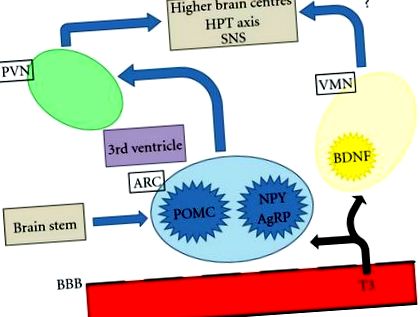
Az elhízás, annak szövődményei és az ezzel járó halálozás világszerte jelentős közegészségügyi kérdés. Az étvágyszabályozás szempontjából fontos központi központi idegrendszeri (CNS) területek a hipotalamusz és az agytörzs. A hipotalamusz értelmezi és integrálja a periféria és az agytörzs afferens szignáljait az efferens jelek modulálására, amelyek szabályozzák az élelmiszer-bevitelt és az energiafogyasztást. Az idegi és a hormonális perifériás jelek információt közvetítenek, beleértve az akut táplálkozási állapotokat és az energiatárolókat. A hipotalamusz számos egymással összekapcsolódó magra oszlik, beleértve a paraventrikuláris magot (PVN), a ventromediális magot (VMN) és az íves magot (ARC), amelyek különösen fontosak az energia homeosztázisának szabályozásában. Az ARC a medián eminencia közelében helyezkedik el, ahol a vér-agy gát hiányos, és így jó helyzetben van ahhoz, hogy reagáljon az étvágy és az étel bevitelében szerepet játszó keringő tényezőkre [1]. A legújabb bizonyítékok arra utalnak, hogy a pajzsmirigyhormonok hozzáférhetnek az ARC-hez és a hipotalamusz más régióihoz az étvágy szabályozása érdekében (1. ábra).
Megalapozott, hogy a hipotalamusz-hipofízis-pajzsmirigy (HPT) tengely szabályozza a testtömeget. A pajzsmirigyhormonokról ismert, hogy befolyásolják az anyagcserét. A pajzsmirigy diszfunkciójának klinikailag jelentős következményei lehetnek az étvágyra és a testsúlyra. A pajzsmirigy alulműködése klasszikusan csökkenti a bazális energiafelhasználást [2] súlygyarapodással [3, 4]. Ezzel szemben a pajzsmirigy-túlműködés növeli az energiafelhasználást és csökkenti a testtömeget [5–7]. Hagyományosan azt feltételezték, hogy ez a csökkent testsúly vezérli a hiperfágia működését, amely a pajzsmirigy-pajzsmirigy túlműködésének egyik jellemző jellemzője. A legújabb bizonyítékok azonban azt sugallják, hogy a HPT tengely közvetlen szerepet játszhat az étvágy hipotalamusz-szabályozásában, függetlenül az energiafogyasztás hatásaitól. Klasszikusan a hipotalamusz tirotropin-felszabadító hormon (TRH) serkenti a pajzsmirigy-stimuláló hormon (TSH) felszabadulását az agyalapi mirigy elülső mirigyéből, amely ezután serkenti mind a pajzsmirigyhormonok, a tri-jodotironin (T3) és a tiroxin (T4) felszabadulását. A jelentések azt sugallják, hogy mindezek a jelátviteli molekulák közvetlenül befolyásolhatják a táplálékfelvételt [8–11]. A HPT tengely és a pajzsmirigy hormon étvágyban betöltött szerepének jobb megértése új célpontokat azonosíthat az elhízás elleni szerek számára.
2. A pajzsmirigyhormonok hatása az élelmiszer-bevitelre (1. táblázat)
Az éhezés jól jellemzi a hipotalamusz TRH expresszióját. Ez elsősorban a HPT tengelyének alacsony szintű szabályozását gondolja korlátozott élelmiszer-hozzáférési időszakokban, ezáltal csökkentve az élelmiszer-bevitelt. A TRH-nak azonban közvetlen anorektikus hatása van, ami arra utal, hogy a táplálékfelvételt a HPT tengelyre gyakorolt hatásoktól függetlenül szabályozhatja. Rágcsálóknál a TRH központi beadása csökkenti a táplálékfelvételt [8, 12, 13]; a táplálékfelvételre hasonló hatások figyelhetők meg a perifériás beadást követően [14].
Kimutatták, hogy a TSH csökkenti a táplálékfelvételt is, ha központilag injektálják a patkányokba [8]. Bizonyíték van arra, hogy a pars tuberalis-ból származó TSH részt vesz a madarak és rágcsálók fotoperiodikus reakciójában, és így lehetséges, hogy a TSH részt vesz a táplálékbevitel és a testtömeg szezonális változásaiban, amelyek bizonyos fajokban előfordulnak [15–17].
A hipertireózissal járó hyperphagia annak a következménye lehet, hogy a pajzsmirigyhormonok közvetlenül hatnak a központi idegrendszer étvágyköreire. A T3 közvetlenül stimulálja a táplálékfelvételt a hipotalamusz szintjén. Rágcsáló-modellekben a T3 perifériás és centrális hipotalamusz-adagolása növeli a táplálékfelvételt [9–11].
Számos mechanizmus feltételezhető a pajzsmirigyhormonok orexigén hatásainak közvetítésére. Az ARC két különálló energia homeosztázist szabályozó idegsejt populációt tartalmaz. Az egyik alpopuláció a pro-opiomelanocortin (POMC) gént fejezi ki, amely az anorektikus neuropeptid alfa-melanocita stimuláló hormont kódolja (α-MSH). A másik az orexigén faktorokat fejezi ki a neuropeptid Y (NPY) és az agoutival kapcsolatos fehérje (AgRP). Beszámoltak arról, hogy a T3 perifériás beadása növeli a hipotalamusz NPY mRNS-ét, és hogy egy NPY Y1 receptor antagonista intracerebroventrikuláris (ICV) beadása tompítja a T3 indukált hiperfágiát, ami arra utal, hogy a T3 növelheti az étvágyat az NPY révén [10]. A T3 beadásáról beszámoltak a hipotalamusz POMC expressziójának csökkentéséről is [10]. Egy másik tanulmány nem mutatott ki változásokat a hipotalamusz neuropeptid expressziójában a T3 perifériás beadására reagálva, bár ez tükrözheti a beadott T3 különböző dózisait [9].
A pajzsmirigyhormonok táplálékfelvételre gyakorolt hatását azonban nem közvetlenül az ARC közvetítheti. A T3 közvetlen beadása a VMN-be, de az ARC nem növeli a patkányok táplálékfelvételét [9]. Mivel az ARC étvágyszabályozó áramköreiről ismert, hogy a HPT változásai megváltoztatják, az ARC közvetett hatása lehet a VMN-en keresztül, lehetővé téve a VMN-n belüli T3 számára az élelmiszer-bevitel növelését. Ennek megfelelően vannak olyan ingerlő bemenetek a POMC neuronokba, amelyek a VMN-ből származnak [18].
Úgy gondolják, hogy az 5 ′ adenozin-monofoszfát-aktivált protein-kináz (AMPK) szenzorként működik, amely szabályozza a sejtenergia homeosztázisát. Az AMPK foszforilezéssel aktiválódik, és az AMC aktiválása az ARC-ben növeli a táplálékfelvételt [25]. A periférián beadott T3 fokozza a hipotalamusz AMPK foszforilációját, amely így közvetítheti a T3 orexigén hatásait [11].
A pajzsmirigyhormon-származékok is szerepet játszanak az étvágy szabályozásában. A G-fehérjéhez kapcsolt nyom amin-asszociált 1 receptor (TAAR1) expresszálódik a patkány hipotalamuszában, és az energia homeosztázis szabályozásához kapcsolódik. A 3-jód-tironamin (T1AM) pajzsmirigyhormon származéka, egy endogén biogén amin, a TAAR1 hatékony agonistája. Rágcsáló vizsgálatok szerint a T1AM szignifikánsan növeli a táplálékfelvételt patkányokban, ha intraperitoneálisan, ICV-vel vagy közvetlenül az ARC-be adják be [26]. Ezen hatások fiziológiai jelentősége azonban továbbra sem ismert.
A pajzsmirigyhormon-receptor (TR) vagy olyan receptorok, amelyek közvetítik a pajzsmirigyhormonok étvágyra gyakorolt hatását, nem ismertek. A pajzsmirigy hormon receptorainak két fő típusa van - a pajzsmirigyhormon receptorok α (THRA) és a pajzsmirigyhormon receptorok β (THRB), mindegyiket külön-külön gén kódolja. Ezeket a géneket felváltva spliceljük, hogy három fő, nagyon homológ nukleáris receptor izoformát (TRα1., TRβ1. és TRβ2) specifikus szöveteloszlásokkal [27]. A három fő izoform nagy affinitással kötődik a T3-hoz, és szabályozza a pajzsmirigyhormon által közvetített transzkripciót. TRα a szív, a vázizom, a csont és az agy T3 aktivitását szabályozó fő izoform; TRβ a májban a T3 aktivitást szabályozó fő izoform. A zsírszövet mindkét TR-t expresszáljaα és TRβ. TRβAz 1 a legtöbb szövetben expresszálódik, míg a TRβA 2 csak a hipotalamuszban, az agyalapi mirigyben, a cochleaban és a retinában fejeződik ki [28, 29]. Mindhárom izoforma az emberi hipotalamuszban számos magban expresszálódik, beleértve az infundibularis magot, az ARC humán megfelelőjét, valamint a szupraoptikus és paraventrikuláris magokat.
Bár a pajzsmirigyhormonok közvetlenül növelhetik a táplálékfelvételt a hipotalamuszban, kimutatták, hogy a szelektíven célzott TR altípusok jótékony metabolikus hatásokkal bírnak. A TR aktiválásaβ receptor csökkenti a testtömeg elhízott patkányoknál [30], ami az anyagcsere sebességének növekedésének eredménye lehet. Ezért TRβ agonistákat javasoltak az elhízás kezelésére. A TR megcélzása TR-szelβ-a szelektív agonista meghatározhatja, hogy ezek a szerek kezelik-e a pajzsmirigyhormon metabolikus hatásait, anélkül, hogy a TR-re hatással lennénekα-expresszáló szövetek, például a szív [30]. A TR perifériás beadásaβ-patkányok szelektív agonistája a magas zsírtartalmú étrend etetése során megakadályozza a zsírtömeg várható növekedését, a glükóz intoleranciát és a hipertrigliceridémiát [31]. Ezek a hatások tükrözhetik a TR-vel kezelt rágcsálóknál tapasztalt megnövekedett energiafelhasználástβ-szelektív agonista, nem pedig a pajzsmirigyhormonok étvágyra gyakorolt hatása [32]. További munkára van szükség a T3 hipotalamuszban előforduló orexigén hatásaiért felelős receptor azonosításához.
3. A táplálkozási állapot hatása a pajzsmirigy hormonokra
A TRH csökkentése az éhgyomorra reagálva fontos lehet, mivel a hipotalamuszba történő injekció esetén a TRH-nak közvetlen anorektikus hatása van [13]. Lehetséges, hogy vannak különálló TRH neuronpopulációk, amelyek szabályozzák a HPT tengelyt és szabályozzák az étvágyat.
A korlátozott élelmiszer-hozzáférhetőség időszakaiban a HPT tengely központi downregulációja van. A szérum T4 és T3 szintje koplalás közben csökken emberben [33] és rágcsálókban [34, 35]. Mivel a rágcsálókban a T3 többsége a pajzsmirigyből származik, úgy gondolják, hogy az élelmiszerhiány a T4 és a T3 felszabadulásának csökkenését eredményezheti. Ez valószínűleg másodlagos a hipotalamusz TRH expressziójának csökkenése miatt, ezt a hatást a leptin zsírhormon közvetítheti (2. ábra).
A leptin egy adipocitokin, amely a fehér zsírszövet arányában kering, és a testzsírraktárakkal kapcsolatos információkat közli a központi idegrendszerrel. A leptin beadása megfordíthatja az éhezés által kiváltott változásokat a HPT tengelyben [34, 36, 37]. A leptin beadása részben megakadályozza az éheztetett egerekben egyértelműen megfigyelhető teljes T4 csökkenését [34]. A leptinreceptor vagy maga a leptin mutációival rendelkező emberek és egerek központi hipotireózist mutatnak [38, 39], amelyet leptinhiányos embereknél enyhít a leptin beadása [40]. A leptin közvetlenül szabályozhatja a TRH expresszióját a PVN-ben, és közvetett módon szabályozhatja a TRH-t az ARC-ben kifejtett hatásokon keresztül. A leptin nő α-Az MSH felszabadulása és csökken az AgRP felszabadulás, ami a TRH expresszió visszaszorítását eredményezi. Újabb bizonyítékok vannak arra vonatkozóan is, hogy létezik egy melanokortintól független útvonal, amely révén a leptin befolyásolhatja a HPT tengelyt; erős melanocortin 4 receptor (MC4R) antagonistával történő együttes kezelés rágcsáló modellben csökkenti, de nem teljesen blokkolja a leptin hatását a teljes T4 helyreállításában [41].
A HPT tengely és a perifériás pajzsmirigyhormon szintjének változásai azonban ellentmondanak a pajzsmirigyhormonok étvágyra gyakorolt jelentett hatásainak. Ha a pajzsmirigyhormonok fiziológiailag növelik az étvágyat, akkor az előrejelzések szerint az éhezés csökkenése helyett növekedni fog. A bizonyítékok arra utalnak, hogy a szisztémás pajzsmirigyhormonszint helyett az étvágyszabályozásban fontosak a pajzsmirigyhormonok helyi központi idegrendszeri koncentrációi.
4. A T3 szintjének központi változásai A D2 és D3 közvetítésével
A dejodinázok néven ismert enzimcsoport (tioredoxinszeres enzimek) szabályozza a T3 és T4 aktiválását és inaktiválását. Ezek az enzimek felelősek a központi pajzsmirigy hormon szintjének szabályozásáért. Három típusú dejodináz létezik, amelyek mindegyikének aktív helye a szelenocisztein aminosavat tartalmazza, amely kritikus fontosságú az ezen enzimek által katalizált dezodinációs reakció szempontjából. A deodinázok a jód szelektív eltávolításával járnak a T4-ből és származékaiból. A jód eltávolítható a belső (tirozil) vagy a külső (fenolos) gyűrűből. A deodináz 1 (D1) főleg a májban, a vesében és a pajzsmirigyben expresszálódik emberekben és rágcsálókban. A Deiodinase 2 (D2) és Deiodinase 3 (D3) azonban erősen expresszálódik a központi idegrendszerben, némi perifériás expresszióval. Az egyes enzimek expresszióját a pajzsmirigyhormon egyedileg szabályozza. A hipotalamuszon belül a D2 és D3 expressziója és aktivitása a táplálkozási körülményektől függ, ami a hipotalamusz T3 rendelkezésre állásának szövetspecifikus változásaihoz vezet, amelyek fontosak lehetnek az ételbevitel és az energiafelhasználás szabályozásában (3. ábra).
A hipotalamusz D2 expresszióját nem csak a pajzsmirigy állapota szabályozza. Rágcsálóknál az éhezés szintén növeli a hipotalamusz D2 expresszióját és aktivitását [9, 37], és ezt a hatást nem fordítja meg a T4 szisztémás beadása [45]. Viszont megfordítható leptin beadásával [37], ami arra utal, hogy fontosabb az energia homeosztázisban, mint a HPT tengely. A leptin az éhezés során helyreállítja a HPT tengely hipotalamuszát és agyalapi mirigyét, de közvetlenül eltompítja a pajzsmirigy válaszát, ami alacsony plazma T4 és T3 szintet eredményez [37]. Ezért a pajzsmirigyhormon normalizálódása függhet a dejodináz aktivitásának változásától és a TSH által nyújtott hosszú távú pajzsmirigy-stimulációtól, hogy szembeszálljon a leptin pajzsmirigyre gyakorolt közvetlen gátló hatásával.
A D2 aktivitás különösen magas az ARC-ban és a medián eminenciában [52], ahol asztrocitákban és tanycitákban fejeződik ki. A D2 tartalmú tanyciták folyamata közvetlen kapcsolatban áll az ARC NPY/AgRP neuronjaival, amelyek szintén expresszálják az UCP2-t [53]. Úgy gondolják, hogy az 1-es fehérje (UCP1) szétkapcsolása szerves részét képezi a barna zsírral társuló, nem reszketõ termogenezis folyamatának, mivel ez az energiát hõ formájában oszlatja el [54]. A belső mitokondriális membrán szétkapcsoló 2-es fehérje (UCP2) szerepe kevésbé jól meghatározott és szövetspecifikus, de T3 által szabályozott [55].
5. Összefoglalás
A pajzsmirigyhormonok helyi szabályozása a központi idegrendszerben fiziológiailag szabályozhatja az étvágyat. A D2 és D3 expresszió indukciója közötti váltás finom szabályozhatja a hypothalamus pajzsmirigyhormon-koncentrációit. Most további munkára van szükség annak jellemzésére, hogy a pajzsmirigyhormonok hogyan szabályozzák az élelmiszer-bevitelt. A pajzsmirigyhormonok energiaháztartást szabályozó mechanizmusainak meghatározása segíthet az elhízás kezelésére szolgáló terápiák kialakításában.
Rövidítések
| T2: | 3 ', 3′-dijód-tironin |
| AMPK: | 5 ′ adenozin-monofoszfát-aktivált protein-kináz |
| AgRP: | Agoutival kapcsolatos fehérje |
| α-MSH: | Alfa-melanocita stimuláló hormon |
| ÍV: | Ív alakú mag |
| BBB: | Vér-agy gát |
| BDNF: | Agyi eredetű neurotróf faktor |
| CNS: | Központi idegrendszer |
| D1: | Deiodináz 1 |
| Dio1: | Deiodinase 1 gén |
| D2: | Deiodináz 2 |
| Dio2: | Deiodinase 2 gén |
| D3: | Deiodináz 3 |
| Dio3: | Deiodinase 3 gén |
| HPT: | Hipotalamusz-hipofízis-pajzsmirigy |
| ICV: | Intracerebroventrikuláris |
| IP: | Intraperitoneális |
| MC4R: | Melanokortin 4 receptor |
| MCT8: | Monokarboxilát transzporter 8 |
| NPY: | Y neuropeptid |
| OATP1C1: | Szerves aniont szállító 1c1 polipeptid |
| PVN: | Paraventrikuláris mag |
| POMC: | Pro-opiomelanokortin |
| rT3: | Fordított T3 |
| SF1: | Szteroidogén faktor-1 |
| TR: | Pajzsmirigy hormon receptor |
| TSH: | Pajzsmirigy-stimuláló hormon |
| TRH: | Tirotropin felszabadító hormon |
| T4: | Tiroxin |
| T3: | Trijódtironin |
| UCP1: | A fehérje leválasztása |
| UCP2: | A fehérje leválasztása 2 |
| VMN: | Ventromediális mag. |
Köszönetnyilvánítás
A. Amin támogatója az Országos Egészségügyi Kutatóintézet (NIHR) Biomedical Research Center finanszírozási rendszere. W. S. Dhillót az Országos Egészségügyi Kutatóintézet klinikusának tudós díja és egy Wellcome Trust Value in People díj finanszírozza. K. G. Murphy a Biotechnológiai és Biológiai Tudományos Kutatási Tanács (BBSRC) támogatását kapja. A tanszéket a Nemzeti NIHR Biomedical Research Center Funding Scheme, a BBSRC és az FP7-HEALTH-2009-241592 (Európai Unió) EurOCHIP keretében finanszírozzák.
Hivatkozások
- A hormonok jelentősége, pajzsmirigy; Diéta az immunrendszer számára Las Colinas Compounding; Wellness
- A központi idegrendszer, a hasnyálmirigy hormonjai, az etetés és az elhízás - ScienceDirect
- Az étrend hatása a központi idegrendszeri betegség súlyosságára A laboratóriumi laboratórium egyik része
- Meglepő hatással vannak a hormonjaid a látásodra
- A sushi a pajzsmirigy betegségéhez kapcsolódik