A palmitinsavval dúsított étrend májzsírbetegséget és sérülést vált ki a felnőtt zebrakban
Orvostudományi Kar, Dél-Karolinai Orvostudományi Egyetem, Charleston, Dél-Karolina.
Sejt- és Molekuláris Farmakológiai és Kísérleti Terápiás Tanszék, Dél-Karolinai Orvostudományi Egyetem, Charleston, Dél-Karolina.
Sejt- és Molekuláris Farmakológiai és Kísérleti Terápiás Tanszék, Dél-Karolinai Orvostudományi Egyetem, Charleston, Dél-Karolina.
Cím levelezés: Seok-Hyung Kim, PhD, Orvosi Tanszék, Dél-Karolinai Orvostudományi Egyetem, Drug Discovery Building, 70 President Street, Charleston, SC 29425
Orvostudományi Kar, Dél-Karolinai Orvostudományi Egyetem, Charleston, Dél-Karolina.
Regeneratív Orvostudományi és Sejtbiológiai Tanszék, Dél-Karolinai Orvostudományi Egyetem, Charleston, Dél-Karolina.
Absztrakt
Bevezetés
Kísérleti szakasz
Zebrafish
A vad típusú zebrafish-t (AB/TU törzs) a Zebrafish International Resource Center-től vásároltuk, és a szokásos protokollok szerint tartottuk fenn. A zebrafish fenntartási és kísérleti eljárásait a Dél-Karolinai Orvostudományi Egyetem (Charleston, SC) intézményi állatgondozási és felhasználási bizottsága (IACUC) hagyta jóvá, protokoll száma AR3324. A halakat rendszeres ketrecben (Multi-linking water treatment unit system; Tecniplast) tartottuk 28 ° C-on, etetés közben 14: 10 órás fény: sötét ciklus alatt. A tizenkét hónapos férfi felnőtt zebrafish-t 0,016% (w/v) tricaine-nal altatták és két csoportba sorolták (n = 30 minden csoportban), hasonló testtömeggel. A halakat 3 literes tartályba helyeztük.
Diéták és etetési rendszer
Tetramin pehelyt (47% nyersfehérje; 11,0% nyers zsír; 3,0% nyersrost; Tetra-Fish, Inc., Blacksburg, VA) használtunk kontroll étrendként. PA-val dúsított étrendet felnőtt halak számára készítettek úgy, hogy a tetramin-pelyhet PA-t tartalmazó dietil-éter-oldatba áztatták, így az étel 8% (w/w) PA-tartalma elérhető (S1 kiegészítő táblázat). Az étert legalább 3 napig teljesen elpárologtatták a páraelszívóban. Kiszámítottuk az étrendben lévő PA mennyiségét, hogy a zsírból származó kalória 33% -át elérjük, míg a kontrollcsoport halai a tetramin-pehely étrendjében a zsír 23% -át kapták (kiegészítő S1A ábra). Mindegyik csoport (n = 15 × 2) 6 hétig fogyasztotta a kijelölt étrendet (21,6 mg kontroll és 20 mg PA-val dúsított étrend/nap/hal). Az étkezésenkénti összes kalória összehasonlítása a kontroll és a PA-val dúsított étrend között 8% -kal nagyobb mennyiségű ételt tápláltunk a kontroll csoportba.
Vérvétel és biokémiai elemzés
Vért vettünk egy üveg kapilláris tűvel a zebrafish dorsalis aortájába, amint arról korábban beszámoltunk. Zebrafish vért nyertünk egy heparinizált tűvel a vér vételéhez a test tengelye mentén és a végbélnyílás mögött a hátsó aorta régiójában. A vért 20 órás éhezési időszak után felnőtt zebrakból vettük, és 1:10 arányban hígítottuk foszfáttal pufferolt sóoldatban. Centrifugálás után a plazma felülúszót összegyűjtöttük. A szérum glükózszintet Bayer Contour NEXT Diabetes EZ mérővel (Bayer AG) mértük Contour NEXT vércukorszint tesztcsíkokkal. A hígított plazmában a TG, az összes koleszterin (TC) és az ALT szintjét kitekkel mértük a gyártó protokollja szerint (TR22421 kat. TG esetében; Thermo Scientific, kat. 439-17501 TC esetében; Wako, kat. Sz.). A7526 ALT-vizsgálathoz; Pointe Scientific).
Májszövettan
A májat 4% paraformaldehidben rögzítettük éjszakán át 2 napig 4 ° C-on. A rögzített májat 1,2% agarózban/5% szacharózban és 30% szacharózban telítettük 4 ° C-on 1-2 napig. A blokkokat folyékony nitrogén alkalmazásával hűtött 2-metil-bután felületén lefagyasztottuk. Tíz mikrométeres metszetet gyűjtöttünk mikroszkóp tárgylemezeken Leica kriosztát (Leica CM 1950) alkalmazásával. A metszeteket használat előtt -80 ° C-on tartottuk.
Kvantitatív RT-PCR
Az RNS-t felnőtt zebrafish májból izoláltuk Trizol-módszerrel, és a komplementer DNS-t (cDNS) reverz átírással írtuk le SuperScript III First-Strand kit (Cat. No. 18080-051; Invitrogen) segítségével. A teljes RNS-t a kontrollcsoportban, illetve a PA-vel táplált csoportban lévő három májból extraháltuk, majd azonos mennyiségű RNS-t egyesítettünk a cDNS-szintézishez. Az Oligo-dT-vel primer cDNS-t Trizol® reagenssel (katalógusszám: 15596-026; Invitrogen) izolált teljes RNS-ből állítottuk elő, a III. Felső szekvencia First-Strand kit (kat. Szám: 18080-051; Invitrogen) alkalmazásával. A valós idejű kvantitatív polimeráz láncreakciót (qPCR) termikus ciklerrel (CFX96 valós idejű rendszer; Bio-Rad) végeztük 45 ciklusban, 50 ng cDNS, 200 pmol/μL génspecifikus primerek 14 alkalmazásával (S2 kiegészítő táblázat), és SsoAdvanced ™ univerzális SYBR ® Green Supermix (katalógusszám: 172-5274; Bio-Rad). Gliceraldehid-3-foszfát-dehidrogenáz (gapdh) referenciaként alkalmaztuk, és a relatív mennyiségi meghatározást kétszeres delta Ct módszerrel számítottuk. A qRT-PCR-t minden gén esetében legalább három példányban futtattuk.
TG elemzés
6 hetes étrendi kísérlet után öt kontroll étrenddel táplált és PA táplálékkal táplált halat éjszakán át éheztettünk és májat kaptunk. Szöveti homogenizációs pufferben (250 mM szacharóz, 25 mM KCl, 0,5 mM EDTA és 50 mM Tris-HCl, pH 7,4) homogenizált máj 1x proteázzal és foszfatáz inhibitorral (Halt ™ proteáz és foszfatáz inhibitor koktél, katalógusszám: 78441).; Thermo Fisher Scientific) ultrahangos módszerrel. Összegyűjtöttük a lizátumot és a meghatározott fehérjekoncentrációt a Pierce ™ BCA fehérje assay segítségével (kat. Szám: 23227; Thermo Fisher Scientific); a lizátumot -80 ° C-on tartottuk a TG elemzés előtt. A máj TG-értékét triglicerid-reagenssel (katalógusszám: TR22421; Thermo Scientific) mértük. A zsírsav-összetétel elemzését az étrendben az Eurofins Nutritional Analysis Center-ben (Eurofins Scientific, Inc., Des Moines, IA) végeztük.
Az intracelluláris reaktív oxigénfajták mérése
Az intracelluláris reaktív oxigénfajtákat (ROS) az OxiSelect alkalmazásával mértük. In Vitro ROS/reaktív nitrogénfajok (RNS) készlet a Cell Biolabs-tól (San Diego, Kalifornia), a gyártó protokollja szerint. A lizátumokat összegyűjtöttük (1 mg/ml), és azonnal ROS/RNS mérésnek vetettük alá. A fluorofór-diklór-fluoreszcein (DCF) fluoreszcens intenzitását, amelyet a nem fluoreszcens prekurzor diklór-dihidrofluoreszcein (DCFH) peroxid-oxidációjával állítottak elő, 480 Ex/530 Em BMG LABTECH CLARIOstar-nál detektáltunk. Ezzel szemben vakkontrollként lízispuffert tartalmazó DCFH-t használtunk.
GSH és GSSG szint mérése
A máj lizátumokban a GSH és a GSSG szintjének kvantitatív meghatározását enzimatikus-újrafeldolgozó módszerrel végeztük. 15 A kontroll étrenddel táplált és PA-val dúsított étrenddel táplált felnőtt májból származó kivonatokban lévő fehérjéket szulfosalicilsavval kicsaptuk, majd a felülúszót két csőre osztottuk. Csökkentett GSH esetén a felülúszót a tiol fluoreszcens IV próbával inkubáltuk, és a fluoreszcencia intenzitást 400 Ex/465 Em értéknél mértük. A teljes GSH (GSH + GSSG) esetében a felülúszót trietanol-aminnal semlegesítettük és inkubáltuk a redukciós rendszerrel (amely NADPH-t és glutation-reduktázt tartalmazott) 37 ° C-on 20 percig. A GSSG-t a csökkent GSH és az összes GSH eredménye alapján számoltuk; aránya .
Transzmissziós elektronmikroszkópia
A zebrafish májat éjszakán át 2,5% glutáraldehidbe merítettük foszfátpufferben, pH = 7,4. Az ultravékony metszeteket (70 nm) rézrácsokra helyeztük, és mindegyikük 10 percig uranil-acetáttal és ólom-citráttal festettük. A metszeteket JEOL 1010 elektronmikroszkóppal néztük meg 80 kV feszültségen, különböző nagyításokban. A képeket Hamamatsu kamerával rögzítették. Egész folyamatokat hajtottunk végre a MUSC elektronmikroszkópos maglétesítményében.
Statisztikai analízis
A statisztikai szignifikanciát kétfarkú Student-ek határozták meg t-értékű teszt o 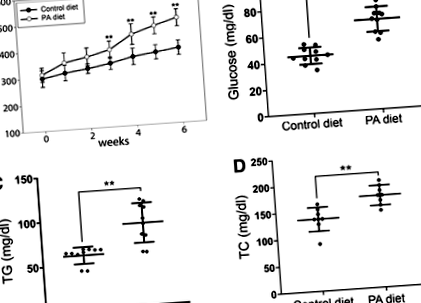
ÁBRA. 1. A testsúly, a plazma TG és a vércukorszint értékelése a zebrafish táplált kontroll vagy PA (7% PA) étrendben. (A) A testsúly változása a felnőtt felnőtt zebrafish-ban a kontroll vagy PA diétás csoportokban. Az értékeket átlag ± SD-ként adjuk meg. Kontroll vagy PA csoport: n = 15. (B) A vércukorszint változásai (n = 10, minden csoport), (C) a plazma TG-szint változásai (n = 5, mindegyik csoport), és (D) a plazma TC változásai. A hibasávok az átlag SD-jét jelzik. *o
A PA-val dúsított étrend májkárosodást vált ki a felnőtt zebrafish-ban
A hepatocelluláris léggömbölyödésre a duzzadt hepatociták jellemzők, acidofil testtel vagy anélkül (rózsaszínű festés a hematoxilinon és az eozinon [H&E]) vagy mallory hyalinon, és a májsejt sérülését tükrözi. Amint a 2. ábrán látható, a H&E-vel festett májszakaszok szövettani elemzése kimutatta, hogy a májsejtek ballonálódtak az acidofil testfenotípus felhalmozódásával PA-vel táplált csoportokban (2A, B ábra). Ezenkívül a szérum ALT szintje a májkárosodás jelentős növekedését jelezte a PA-val dúsított étrendet követően (2C. Ábra). A gyulladással járó gének relatív mRNS-expressziója (tumor nekrózis faktor alfa [tnfa] és az interleukin 1 béta [il1b]), sejthalál (DNS-fragmentációs faktor alfa alegység [dffa]) és a fibrózis (kollagén, I. típus, alfa 1a [col1a1a]) szignifikánsan megemelkedtek a PA-vel táplált csoportban a kontroll csoporthoz képest (2D. ábra). Így a PA-val dúsított étrend felnőtt zebrafish-ban utánozta a steatohepatitisben megfigyelt hepatocelluláris sérülés fenotípust.
ÁBRA. 2. A májsejtek léggömbölyítése steatosisban és a májkárosodás emelkedése PA-val dúsított étrend bevitele után. Reprezentatív képek a máj H&E festéséről a kontrollban (A) és PA (B) diéta 6 hétig. Sárga téglalapok a bal oldali sarkokban a kiválasztott területek nagyított képei láthatók. Méretarány = 25 μm. (C) Plazma ALT szintje a kontrollban és a PA diétával táplált zebrafish (n = 5). (D) A relatív mRNS expressziója tnfa, il1b, dffa, és col1a1a a kontroll és PA diétával táplált halmáj (n = 5). A hibasávok az átlag SD-jét jelzik. *o
A PA-val dúsított étrend máj steatosist indukál és növeli a lipid anyagcserével járó génexpressziót
ÁBRA. 3. A lipid metabolizmushoz kapcsolódó génexpresszió és a máj TG szintje a zebrafish-ban táplálta a kontrollt vagy a PA diétát. (A) Olajpiros májfestés a kontroll étrendből és a PA diétából. A képek egyenként 10 mintát reprezentálnak. (B) A kontroll és PA táplált csoportok zebrafish máj-lizátumaiból mért TG-szint (n = 5, minden csoport). (C) A lipid-anyagcseréhez kapcsolódó gének relatív mRNS-expressziója többek között srebp1, srebp2, C/EBPa, acc1, fasn, dgat2, ppar-γ, cd36, ldlr, lpin1, és lpl. *o
A PA-val dúsított étrend fokozza a mitokondriális biogenezist és az aktivitás β-oxidációját, ami fokozott oxidatív stresszhez vezethet a felnőtt zebrafish májban
ÁBRA. 4. Mitokondriális homeosztázis és oxidatív stressz asszociált génexpresszió és GSH, GSSG szintek kontroll és PA táplált csoportokban. (A) A mitokondriális homeosztázissal összefüggő gének relatív mRNS-expressziója többek között drp1, mfn1, opa1, pgc1a, polg, nd1, etfa, és cpt1. (B) Az oxidatív stresszhez kapcsolódó gének relatív mRNS-expressziója magában foglalja nox1, nox2, nox5, nrf2, sod2, gsr, gstp1/2, gpx1a, gpx4a, prdx1, prdx4, txnl1, és txnl4. A mennyiség meghatározása (C) ROS, (D) GSH, (E) GSSG, és (F) GSH/GSSG arány a kontroll- és PA-táplált csoportokban. *o
A PA-val dúsított étrend cristae károsodást vált ki a mitokondriumokban és az ER kitágulását hepatocitákban
Az oxidatív stressz növekedése mellett a opa1 ábrán megadott expressziós szint azt sugallta, hogy a PA diéta mitokondriális sérülést indukálhat, mert opa1 indukálható a mitokondriális cristae szerkezetének védelme az oxidatív stressztől. Ennek a lehetőségnek a tesztelésére ultrastrukturális elemzést végeztünk a kontroll étrenddel táplált és a PA diétával táplált felnőtt zebrafish májban (5A. Ábra). Megállapítottuk, hogy a PA-vel táplált zebrafak hepatocitáiban a mitokondriumok felhalmozódtak sérült cristae szerkezetekkel. Így a steatosis és a májkárosodás PA diétás mitokondriális károsodásból származhat. Fontos, hogy a PA-vel táplált csoport az ER membrán kiterjedt tágulását mutatta a PA diétával táplált zebrafish májsejtjeiben (5A. Ábra, jobb oldali panel).
ÁBRA. 5. A hepatociták transzmissziós elektronmikroszkópos leképezése és az ER stresszhez kapcsolódó gének mRNS expressziója. (A) 8000 × nagyítás a kontroll májában és a PA diétával táplált zebrafish 6 héten át. A nagyított területek a alsó (sárga téglalapok) normális mitokondriumokat ábrázolnak a kontroll táplálékkal táplált és kóros mitokondriumokban, károsodott cristákkal a PA táplált zebrafish májban. A bemutatott képek legalább három másik zebrafish májra vonatkoznak. Méretarány = 800 nm. N (mag), m (mitokondrium), Lip (lipidcsepp) és csillagok jel a sérült cristae számára. (B) ER stressz/kibontakozott fehérjeválaszhoz kapcsolódó gének relatív mRNS-expressziója; atf4, gadd45a, ire1, nfkb, xbp1, xbp1-s, atf6, ddit3, edem1, bip, dnajc3, grp94, bim, bida, és baxb. A hibasávok az átlag SD-jét jelzik. *o
Vita
Köszönetnyilvánítás
A szerzők köszönetet mondanak Dr. Don C. Rockey-nak a hasznos megjegyzésekért és a kézirat áttekintéséért, valamint Dr. Danyelle M. Townsends-nek a hasznos beszélgetésekért. Ezt a munkát az Országos Egészségügyi Intézet (Általános Orvostudományi P20GM103542-COBRE támogatás Oxidánsokban, Redox Balance) támogatta.
- A ketogén étrend rövid távú táplálása súlyosabb máj inzulinrezisztenciát vált ki, mint egy
- Royal canin állatorvosi diéta kiválasztott fehérje felnőtt pr száraz macskaeledel Translating Research into
- Gyulladáscsökkentő étrendem; Felnőttkori kezdeti betegségek
- Science Diet Felnőtt könnyű kis harapások áttekintése
- Vállsebészet - Váll utáni műtét vagy sérülés - Diéta; Gyógyítás - vállsebészet Austinban