A parazita PGD2 szintáz és a D gazdaszervezet prosztanoid 1 receptorának központi szerepe a skisztoszóma immuncsalásban
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Az első két szerző egyformán járult hozzá ehhez a tanulmányhoz
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudományos Intézet, Oszaka, Japán
Unité Mixte de Recherche (UMR) 8525, CNRS, Institute of Biologie de Lille, Lille, Franciaország
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Orvostudományi Kar, Kiotói Egyetem, Kiotó, Japán
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudományos Intézet, Oszaka, Japán
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Unité INSERM 547, Institut Pasteur, 1 rue du Pr. A. Calmette, F-59019 Lille, Franciaország Fax: + 33-3-2087-7888 A szerző további cikkeinek keresése
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Az első két szerző egyformán járult hozzá ehhez a tanulmányhoz
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudományos Intézet, Oszaka, Japán
Unité Mixte de Recherche (UMR) 8525, CNRS, Institute of Biologie de Lille, Lille, Franciaország
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Orvostudományi Kar, Kiotói Egyetem, Kiotó, Japán
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudomány Intézet, Oszaka, Japán
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Inserm U547, Institut Pasteur de Lille, Lille, Franciaország
Unité INSERM 547, Institut Pasteur, 1 rue du Pr. A. Calmette, F-59019 Lille, Franciaország Fax: + 33-3-2087-7888 A szerző további cikkeinek keresése
Absztrakt
Rövidítések:
D prosztanoid receptor
A nyirokcsomó elvezetése
28 ‐ ka GST-től S. mansoni
Oldható schistosomulum Ag
Solubleadult féreg Ag
1. Bemutatkozás
Az arachidonsav fő metabolitjának, a PGD2-nek különféle élettani aktivitásai vannak emlősökben, mint például az alvás, az idegsejtek működésének elősegítése, a hormon felszabadulása, a hörgőkonstrikciója és az 1, 2 vastagítás. Ezenkívül a PGD2 effektor funkcióval is rendelkezik a gyulladás során. Például az allergénnel aktivált hízósejtek és esetleg az Ag-fertőzött Th2 limfociták által történő PGD2 termelés részt vesz a tüdőben 3–5 kialakuló allergiás reakciókban. Másrészről, úgy tűnik, hogy a PGD2 közvetíti a szabályozó funkciókat a gyulladás során, például a carrageenin által kiváltott mellhártyagyulladás és vastagbélgyulladás lefelé történő szabályozásával patkányokban 6 - 8. A PGD2 ezen biológiai szerepeit két plazmamembrán G-fehérjéhez kapcsolt receptoron keresztül hajtják végre, a D prosztanoid 1-es receptoron (Gαs fehérje kapcsolt, DP1-nek hívják) 9 és a nemrégiben azonosított, Th2 sejteken expresszált kemoattraktáns receptor-homológ molekulán (CRTH2), eozinofileken és bazofilek (Gαi fehérjéhez kapcsolt, DP2) 10, 11. A gyulladásos funkcióikkal együtt gyanítják a DP2 és különösen a DP1 szerepét az immunválasz kimenetelében. Egy nemrégiben készült tanulmány szerint a DP1 az egér tüdő hiperreaktivitásának modelljében kedvez a helyi Th2 citokin válasz kialakulásának 12 .
2 találat
2.1 Az Sm28GST rendelkezik PGDS aktivitással in vitro
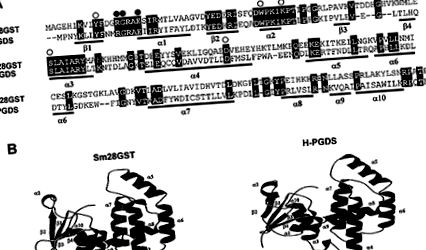
Az Sm28GST és a patkány H ‐ PGDS közötti homológiák. (A) Az Sm28GST és a patkány H-PGDS aminosav-szekvenciájának összehasonlítása. A hézagokat kötőjelek jelzik (-). A GSH és a PGD2 megkötésében részt vevő maradékokat az illesztés felett fehér, illetve fekete karikák jelzik. Másodlagos szerkezeti elemek (β-szálak és α-hélixek) láthatók. (B) Az Sm28GST és H ‐ PGDS monomerek szalagos modellezése a Molscript és a Raster3D 26, 27 kombinációjával .
Specifikus PGDS-aktivitás (μmol/perc/mg)
2.2 Az Sm28GST gátolja az LC vándorlását az epidermiszből a DLN-be
Az egér schistosomiasisában a parazitákból származó eikozanoidok fontos szerepet játszhatnak a bőr immunválaszában 15, 28. Az immunjelölés nagyon specifikus Ab-val azt mutatta, hogy az Sm28GST tömegesen választódik ki a fertőzött egerek epidermisében (2A. Ábra). Ez arra késztetett bennünket, hogy vizsgáljuk meg az Sm28GST hatását az epidermális LC vándorlására. Az rSm28GST-t intravénásán injektáltuk. 1 órával a TNF ‐ α előtt egy molekula, amelyről ismert, hogy az LC erős eltávolítását indukálja az epidermiszből 29. Meglepő módon az rSm28GST injekciója jelentősen (44% -kal) csökkentette az epidermális LC TNF-α-indukálta migrációját, ezt a hatást nem figyelték meg a mutált rSm28GST esetében (2B. Ábra). Ezek az adatok határozottan jelzik, hogy PGDS enzimatikus aktivitása révén az Sm28GST megsemmisíti az LC TNF-α által kiváltott migrációját. Ennek megerősítésére és a DLN-ben az elvándorló DC számának számszerűsítésére egy másik LC-migrációs modellt használtunk, amelyet a hapten FITC helyi alkalmazása indukált. Miután ellenőrizte, hogy ebben a modellben az Sm28GST gátolja az LC távozását (nem látható), a DLN-ben lévő FITC-terhelt DC számát áramlási citometriával számszerűsítettük. Amint az a 2C. Ábrán látható, az Sm28GST szignifikánsan (51% -kal) megakadályozta a CD11c +/FITC + sejtek felhalmozódását a DLN-ben a szenzibilizáció után 24 órával.
Az Sm28GST szerepe az LC migráció gátlásában. (A) Sm28GST immunjelölés a perkután behatolás során S. mansoni. Epidermális lapokat készítettünk belőle S. mansoni‐fertőzött egereket (1 órával a fertőzés után) és az Sm28GST-t nyúl anti-Sm28GST Ab immunjelölésével detektáltuk. A nyilak a parazita szellemét jelzik. Nyúl IgG-t használtunk negatív kontrollként (inszert) (nagyítás: × 200). (B) Az rSm28GST hatása a TNF-α-indukált LC-migrációra. Az egereket intravénásán injektáltuk 50 μl enzimatikusan aktív vagy mutált rSm28GST-vel (1 mg/ml) 1 órával a TNF-α kezelés előtt. Egy órával később a füleket eltávolítottuk, és epidermális lapokat készítettünk az LC/mm2 számának meghatározásához (anti-MHC II. Osztályú festés). Az eredményeket átlag ± SD-ként fejezzük ki, és három független kísérletet reprezentálnak (n= 5). (C) Az Sm28GST hatása a FITC + DC felhalmozódására a DLN-ben. Az egereket intravénásán injektáltuk 50 ng rSm28GST-vel 1 órával a FITC festés előtt, és a DLN-ben lévő CD11c +/FITC + sejtek számát 24 órával a FITC alkalmazás után meghatároztuk.
2.3 Az Sm28GST a DP1 aktiválásával befolyásolja az LC migrációját
Mivel a DP1 aktiváció fontosnak tűnik az LC mozgékonyságának szabályozásában in vivo 15, WT vagy DP1 KO egeret adtunk be. rSm28GST-vel injektáltuk a TNF-α kezelés előtt, és meghatároztuk az LC sűrűséget (3A. ábra). Ahogy az várható volt, az rSm28GST és különösen a DP1 agonista, a BW245C gátolta az LC távozását az epidermiszből a WT egerekben. Éles ellentétben az rSm28GST és a BW245C hatástalan volt az LC-migráció blokkolásában DP1 KO egerekben. Ezután értékeltük a DP1 hiány hatását az LC migrációra a fertőzés során. WT vagy DP1 KO egereket fertõztünk S. mansoni és az LC sűrűséget a fertőzés után 6 és 24 órával határoztuk meg. Amint a 3B. Ábra mutatja, az LC/mm2 száma az epidermális lapokban szignifikánsan csökkent a DP1 KO-ban, a WT egerekben azonban nem, függetlenül a fertőzés utáni időtől. Összességében ezek az eredmények azt mutatják, hogy a parazita eredetű PGD2 által a DP1 aktiválása az LC migráció gátlásához vezet S. mansoni fertőzés, és hogy ez a hatás valószínűleg az Sm28GST PGDS aktivitásának köszönhető.
A DP1 szerepe az LC bőrben való visszatartásában. (A) Az rSm28GST és a BW245C hatása a TNF-α által indukált LC migrációra WT és DP1 KO egerekben. Az egereket intravénásán injektáltuk 50 μl rSm28GST-vel (1 mg/ml) vagy BW245C (10 μM) 1 órával vagy 15 perccel a TNF-α kezelés előtt. Az LC sűrűséget 1 órával a TNFa kezelés után számszerűsítettük. (B) A S. mansoni fertőzés az epidermális LC vándorlásakor WT és DP1 KO egerekben. Az LC-sűrűséget 6 vagy 24 órával a fertőzés után határoztuk meg. Az eredményeket átlag ± SD-ként fejezzük ki, és három független kísérletet reprezentálnak (n= 5).
2,4 A DP1 hiánya befolyásolja az immunválaszt a fertőzés során
Az immunválasz elemzése WT és DP1 KO fertőzött egerekben. (A) A bőr DLN sejtjeinek proliferatív válasza és citokintermelése S. mansoniFertőzött WT és DP1 KO egerek, 7 nappal a fertőzés után. A bőr DLN-jét összegyűjtöttük, és a sejteket különböző SSA dózisokkal tenyésztettük (5 μg/ml). A citokin termelést és a proliferációt 3, illetve 4 nap tenyésztés után mértük. Az eredmények a triplikált tenyészetek átlagát mutatják ± SD (n= 5). A háromból egy reprezentatív kísérlet látható. (B) SWAP- és SEA-specifikus Ab izotípus válaszok S. mansoni- fertőzött WT és DP1 KO egerek (a fertőzés után 49 nappal). Az eredményeket IgG1 és IgG2a titerként fejezzük ki minden egér esetében (n= 7). A háromból egy reprezentatív kísérlet látható. A statisztikai szignifikanciát * (o
A 2,5 DP1-hiányos egér részben védett a skisztoszómákkal szemben
A schistosomiasis patológiájának szabályozása komplex Th1/Th2 immunválaszot foglal magában, amely hosszú távon a patológia által közvetített Th2-torzított immunválaszhoz kapcsolódó krónikusság kialakulásához vezet 30. A fertőzött WT egerekhez képest a parazitológiai paraméterek elemzése meglepő módon a féregterhelés jelentős csökkenését (32%), valamint a szövetekben lerakódott peték számának csökkenését (37%) tárta fel a fertőzött DP1 KO egerekben (5A. Ábra). . Ez azt jelzi, hogy a DP1 hiány erősen befolyásolja a paraziták túlélését. Feltűnő, hogy a máj és a belek vizsgálata azt mutatta, hogy ezek a szervek kevésbé sérültek a DP1 KO egerekben, mint a WT egerek, különösen a belek, amelyek erőteljesen csökkent vérzéses elváltozásokat mutattak (5B. Ábra). Mindkét állatcsoportban azonban a tojásokat körülvevő granulomák mérete, valamint a májban lévő kollagén lerakódás mértéke statisztikailag nem módosult a DP1 KO egerekben (az adatokat nem közöltük).
A DP1 - hiány hatása a féregterhelésre és a patológiára S. mansoniFertőzött egerek. (A) Parazitológiai paraméterek WT és DP1 KO egerekben, 49 fertőzés utáni. Az eredményeket átlagként fejezzük ki ± SD és három független kísérlet (n= 7). Jelentős különbség van feltüntetve (*o
3 Megbeszélés
Összefoglalva, adataink feltárják az Sm28GST és a DP1 kulcsfontosságú szerepét az LC migráció gátlásában a fertőzés során, és azt bizonyítják, hogy a PGD2 termelés a DP1 aktiválásán keresztül kedvez az egér schistosomiasis alatti teljes patológiájának. Végül ez a tanulmány fontos betekintést nyújt a DP1 szerepére az immunválasz szabályozásában és általában a gyulladásban.
4 Anyagok és módszerek
4.1 Az Sm28GST és a PGDS aminosav-összehangolása és szerkezeti homológiája
Az Sm28GST és a patkány H-PGDS aminosav-szekvenciáit vizuális szerkesztéssel igazítottuk a BestFit páros illesztési program (GCG-csomag, Wisconsin-csomag) eredménye és a strukturális jellemzők, például a másodlagos struktúrák és a gerincoszlop dihedrális szögértékei alapján. Az igazítással kezdve a Modeller6 automatizált programot használták fel az Sm28GST 3-D szerkezetének felépítéséhez, a PGDS röntgenkristályos szerkezete alapján (fehérjekód: 1PGD2). A modell sztereokémiai minőségét a Procheck-NMR programmal értékeltük 39 .
4.2 Rekombináns Sm28GST és PGDS enzimvizsgálat elkészítése
Az Sm28GST teljes hosszúságú cDNS-jét szubklónoztuk a pET-24d (+) (Novagen) és E. coli A BL21 (DE3) sejteket transzformáltuk ezzel az expressziós vektorral. A rekombináns Sm28GST (rSm28GST) tisztítását a korábban leírt módon végezzük 40. Röviden, az rSm28GST-t affinitással tisztítottuk GSH konjugált Sepharose gyöngyökön 50 mM glicin (pH 10) alkalmazásával, majd PBS-ben (pH 7,4) és 1 mM ditiotreitrolban dializáltuk, polimixin oszlopokon átengedtük és 1 mg/ml-re koncentráltuk. Az endotoxin hiányát a készítményben Limulus-próbával ellenőriztük. A Tyr-Phe mutációt (10. pozíció) a pET-24d: Sm28GST-ben állítottuk elő az 5′-GGTTATC primerekkel ellátott Quickchange TM hely-irányú mutagenezis készlet (Stratagene, La Jolla, CA) felhasználásával.TTTTTCAACGGACG ‐ 3 ′ és 5′-GCGTCCGTTGAAAAAGATAACC ‐ 3 ′ (Life Technologies, Cergy ‐ Pontoise, Franciaország) és a mutációt DNS-szekvenálással igazolták. A patkány rH-PGDS-jét megtisztítottuk, és a PGDS-aktivitást rSm28GST vagy rH-PGDS-sel (50 μg/ml) vizsgáltuk, a korábban leírtak szerint 41. Röviden a reakciót 40 μM [1–14 C] PGH2 hozzáadásával indítottuk el, és 25 ° C-on 1 percig hajtottuk végre. A PG képződését az egyes PG-k radioaktivitásának és a teljes radioaktivitás arányából vékonyréteg-kromatográfia után számoltuk.
4.3 Ag előkészítés, egerek és fertőzési protokoll
Az SSA, SWAP és SEA elkészítését a 42. leírás szerint hajtottuk végre. Fiatal felnőtt WT C57Bl/6 egereket (6–8 hetesek) az Iffa Credo-tól (l'Arbesle, Franciaország) vásároltunk. C57BL/6 DP1 KO egereket kaptunk, amint arról korábban beszámoltunk 12. Az egereket altattuk és 250 cercaria-nak tettük ki a fül 25 percig történő merítésével vagy 50 cercaria-val a borotvált hasi bőrön.
4.4. Immunhisztokémia és az LC-sűrűség elemzése
Az Sm28GST immunjelöléshez az epidermális lapokat 2% PFA-ban rögzítettük, majd PBS-3% H2O2-ba helyeztük az endogén peroxidáz gátlásához. A lapokat 30 percig inkubáltuk PBS-1% blokkoló reagensben (Boehringer), majd 2 órán át inkubáltuk nyúl affinitással tisztított anti-Sm28GST Ab (5 μg/ml), 1% blokkoló reagenssel. Biotinnal konjugált kecske anti-nyúl Ab-t (1: 2000) adtunk hozzá, és 3-amino-9-etil-karbazollal készítettünk lapokat, és immunhisztokémiai analízis céljából az Immunomount üveglemezekre helyeztük. Az LC elvándorlásának előidézésére egereket injektáltunk intravénásan. fülbe 50 ng TNF-α-val (R&D systems, Abingdon, GB) és az epidermális lapokat 1 órával az injektálás után elemeztük az LC-sűrűség meghatározása céljából. Röviden, az epidermális lapokat inkubáltuk az anti-I-A d/I-E d mAb-vel (M5/114 klón, patkány IgG2b), amelyet Dr. A. Ager (NIMR, London, GB), és LC-t tíz véletlenszerű mezőket az egyes lapok MHC II + osztályú celláinak megszámlálásával. A sejtek frekvenciáját LC/mm2-re konvertáltuk, és az eredményeket átlag ± SD-ként fejeztük ki. A FITC által indukált LC migrációhoz az egereket úgy érzékenyítettük, hogy minden fül teljes felületére 10 μl aceton/dibutilftalátban (1: 1, térfogat/térfogat; vivőanyag) készített FITC 0,5% -os oldatát festettük. Bizonyos esetekben rSm28GST-t (50 μg/ml) injektáltak i.d. 1 órával a TNF ‐ α vagy a FITC kezelés előtt. A bőr DLN-ben a migráló FITC + DC számának meghatározásához egysejtű szuszpenziókat készítettünk aurikuláris LN-ből, és a DC-t centrifugálással dúsítottuk 14,5% (wt/vol) metrizamid gradiensen. A DC-ket ezután biotinnal konjugált anti-CD11c mAb-vel (PharMingen, San Diego, Kalifornia) festettük, majd phikoeritrin-sztreptavidinnel. A CD11c +/FITC + DLN sejtek százalékos arányát FACSCalibur TM áramlási citométerrel (Becton Dickinson) határoztuk meg. Az adatokat CellQuest TM szoftverrel elemeztük.
4.5 Az immunválasz elemzése S. mansoniFertőzött egerek
4.6 Parazitológiai és kóros paraméterek elemzése
A féregterhet máj perfúzióval mérték meg 49 nappal a fertőzés után 42. A perfúzió idején a vékonybelet és a májat is összegyűjtöttük a petesejtek mérésére ezeken a szerveken. A szöveteket 4% -os KOH-ban emésztettük, a korábban leírtak szerint 43. A szervek tömegére vonatkozó feljegyzések lehetővé tették a szervenként a teljes petesejt kiszámítását. A petesejtekkel összefüggő patológiát a fertőzött egerek májában elemeztük 44 .
4.7 Statisztikai elemzés
A kísérleti csoportok közötti különbségek statisztikai szignifikanciáját a Student-féle módszerrel számoltuk ki t teszt.
Köszönetnyilvánítás
Köszönjük A. Agernek (NIMR, London, GB) az anti-I-Ad/I-Ed mAb adományozásáért. J. Fontaine-t elismerték technikai segítségért, M. Bracher-t pedig a kézirat kritikus olvasatáért. Ez a munka pénzügyi támogatást kapott az Institut Pasteur de Lille-től és az Institut National de la Santé et de la Recherche Médicale-től. M.H. és V.A. támogatta a Ministère de l'Education Nationale, de la Recherche et de la Technologie. G. Riveau és F. Trottein a Centre National de la Recherche Scientifique tagjai.
- WILEY ‐ VCH
- WILEY ‐ VCH
- WILEY ‐ VCH
- WILEY ‐ VCH
- WILEY ‐ VCH
- Parazita tények Humaworm
- Önbecsülés, súlyállapot és a fogyás megkísérlése fiatal felnőttkorban A szex és
- A Pretty Little Liars sztárjának, Ashley Bensonnak elmondják; s; túl kövér; szerepekért - bár ő; s a
- A Rho-kináz szabályozza az energia-egyensúlyt azáltal, hogy célba veszi a hipotalamusz-leptin-receptor jelátvitelt
- Shailene Woodley 350 kalóriatartalmú étrendje és 5 másik színész, aki lefogyott a filmszerepekért