Pulmonális hipertónia: típusok és kezelések
Lisa J Rose-Jones
1 Szív- és érrendszeri központ, Észak-Karolinai Egyetem, Chapel Hill, USA
Vallerie V Mclaughlin
2 Kardiovaszkuláris betegség, University of Michigan, USA
Absztrakt
A pulmonalis artériás hipertónia (PAH) egy panvasculopathia, amely befolyásolja a disztális tüdőartériákat és korlátozott véráramláshoz vezet. Ez a megnövekedett utóterhelés a jobb kamra adaptív mechanizmusaihoz vezet, esetleges meghibásodással, ha már nem képes kompenzálni. A társult állapotokból származó pulmonális hipertónia, ami a legfontosabb a bal szívbetegség, azaz a szívelégtelenség, szintén ugyanahhoz a következményhez vezethet. A betegek gyakran tapasztalják a nehézlégzés korai, homályos tüneteit és a test intoleranciáját, és így a PH elkerülheti a klinikusokat, amíg a jobb szívelégtelenség tünetei túlsúlyba nem kerülnek. A PAH-ban szenvedők számára bizonyítékokon alapuló kezelési lehetőségek állnak rendelkezésre pulmonáris értágítókkal, és ezeket korán kell alkalmazni. Alapvető fontosságú, hogy a betegeket pontosan osztályozzák a PH etiológiája szerint, mivel a kezelési stratégiák eltérőek, és rossz klinikai forgatókönyv esetén alkalmazva veszélyesek lehetnek.
BEVEZETÉS
A pulmonális hipertóniát (PH), amelyet a pulmonalis artéria átlagnyomásának> 25 Hgmm-nek definiálnak, egyre inkább felismerik és diagnosztizálják. Ennek a komplex rendellenességnek a becsült előfordulása 10-20% az általános populáción belül [1]. A PH megfigyelése, akár aktívan keresik, akár véletlenül fedezik fel az echokardiogramon vagy a jobb szív katéterezésén, megérdemli az etiológia felkutatását, a patofiziológia megértését és a kezelési lehetőségek felmérését. A PH által komplikált bal szívbetegség becsült prevalenciája 3-4 millió az Egyesült Államokban, és kétszeresen megnöveli a halál kockázatát, amikor a jobb kamrai (RV) kudarc következik be [2, 3]. Míg a jobb oldali szívelégtelenség tünetei sok klinikát gyakran a kezelés megkezdésére vagy a beutalásra késztetik, ennek az áttekintésnek az a célja, hogy javítsa a PH korai pontos osztályozását és a különböző terápiás megközelítések jobb megértését, hogy a betegség lefolyásakor korábban alkalmazhatók.
KATEGORIZÁLÁS ÉS PÁFOZIOLÓGIA
Az Egészségügyi Világszervezet által támogatott, 2008-as Dana Point Clinical Classification séma öt csoportba sorolja a PH-t az etiológiák alapján, hasonló hisztopatológiai változásokat eredményezve.
WHO 1. csoport: Pulmonális artériás hipertónia (PAH)
Becslések szerint milliónként 15-25 eset, az igazi PAH felöleli az etiológiák sokaságát, és a hagyományos terápiára vetítve 1 év körüli, körülbelül 15% -os halálozást jelent [4, 5]. Hemodinamikailag a pulmonalis artéria (PAP) ≥ 25 Hgmm plusz pulmonalis kapilláris éknyomás (PCWP) vagy a bal kamrai végdiasztolés nyomás (LVEDP) ≤ 15 Hgmm, pulmonalis vaszkuláris ellenállás (PVR)> 3 erdei egység [6]. Míg ez a PH legkevésbé elterjedt formája, addig az 1. csoport PAH-t a legszélesebb körben tanulmányozzák.
A korábban primer PH néven ismert csoportba tartozik az idiopátiás, a családi, elsősorban a csont morfogén fehérjereceptort, az anorexigén által kiváltott PH-t, a portális hipertóniát, a HIV-t, a kötőszöveti betegségeket, a veleszületett szívbetegségeket, a myleoproliferatív rendellenességeket és a schistosomiasisot kódoló BMPR2 gén mutációi miatt. . A PAH-t általában vasculopathia okozza, amely elsősorban a distalis pulmonalis artériákat érinti. Az érrendszeri rendellenességeket intim proliferáció és fibrózis jellemzi, amely mediális hipertrófiával és fokozott pulmonalis artéria vazokonstrikcióval párosul [7]. Idővel komplex plexiform elváltozások alakulnak ki, és a vasculopathiát tovább bonyolíthatja a thrombus-in-situ. Ezeket a folyamatokat az endotelin és a tromboxán A2 termelésének egyensúlyhiánya vezérli, mind erős vazokonstriktorok, mind a sejtproliferáció iniciátorai [8]. A vazokonstrikciót tovább fokozza a ciklusos GMP gyors hidrolízise inaktív GMP -vé foszfodiészteráz-5 által, ezáltal rontja a vasodilatációs endotheliális reakciót a nitrogén-oxidra.
WHO 2. csoport: A tüdő vénás hipertóniája (PVH) a bal szívbetegség miatt
A bal szívbetegség miatti pulmonalis vénás hipertónia (PVH) a PH leggyakrabban előforduló másodlagos formája [9]. A bal szívbetegség következtében krónikusan megemelkedett bal pitvari nyomás következtében alakul ki: bal kamrai (LV) szisztolés vagy diasztolés diszfunkció és szelep betegség. Hemodinamikailag a pulmonalis artéria (PAP) ≥ 25 Hgmm plusz pulmonalis kapilláris éknyomás (PCWP) vagy a bal kamrai végdiasztolés nyomás (LVEDP) ≤ 15 Hgmm.
Viszonylag keveset tudunk a PVH hátterében álló kezdeti pulmonalis vaszkuláris változásokról. Feltételezik, hogy a pulmonális artéria (PA) megnövekedett nyomása a bal pitvari hipertónia miatt másodlagos vénás nyomásból ered. Ezen betegek egy részénél az eredő vénás hipertónia bonyolódhat a vazokonstrikció és a distalis pulmonalis artériák átalakulásának további „reaktív” jelenségével [10]. Ezt az érrendszeri átalakulást a mitrális stenosisban szenvedő betegek boncolási mintáiban azonosították, amelyek tipikus pulmonalis artériás vasculopathiás változásokat tárnak fel, mint például az 1. csoportban [11].
WHO 3. csoport: tüdő HTN tüdőbetegség/hipoxémia miatt
A WHO 3. csoportja leggyakrabban krónikus obstruktív tüdőbetegség (COPD), intersticiális tüdőbetegség (ILD) és alvászavaros légzés esetén fordul elő. A PH pontos gyakorisága COPD-ben és ILD-ben nem ismert; a súlyos COPD-s betegek egy sorozatában azonban a PH előfordulása meghaladta az 50% -ot [12].
WHO 4. csoport: Krónikus thromboemboliás pulmonális hipertónia (CTEPH)
A WHO 4. csoportja a PH-t képviseli, amely krónikus pulmonalis thromboemboliás események eredménye. Pengo és mtsai. egy prospektív, longitudinális vizsgálatban 2 év után 3,8% -ra becsülték a CTEPH kumulatív incidenciáját az akut PE-vel és más vénás thromboemboliában nem szenvedő betegeknél 2 év múlva [13]. Úgy tűnik, hogy a pulmonalis artériás hipertóniás arteriopathia a látott mikrovaszkuláris változások mozgatórugója [1]. Az intraluminális thrombus klasszikus arteriopathiához vezet mind a kis izmos artériákban, mind az arteriolákban, amelyek csak részben vagy teljesen el vannak zárva az erektől. Ez a nem akadályozott ereknél is előfordul, amelyek megkímélnek, valószínűleg a nagy nyírófeszültség következtében [14].
WHO 5. csoport: PH tisztázatlan multifaktoriális mechanizmusok miatt
A WHO 5. csoportja a pulmonalis hipertónia különféle okainak kategóriája, tisztázatlan patogenezissel. A szarkoid tüdőbetegség, a glikogén tárolási betegség és a pajzsmirigy rendellenességei csak néhány példa, amelyek ebbe az osztályba tartoznak.
BEMUTATÁS
A dyspnoe a leggyakoribb tünet a PH bemutatásakor, és a PH-t mindig be kell vonni a légszomj és a testzavar intoleranciájának differenciáldiagnózisába. Az alsó végtag ödémájával és szinkópiájával találkozunk, bár ritkábban és jellemzően a betegség előrehaladottabb szakaszában [15]. A mellkasi fájdalmat gyakran figyelmen kívül hagyják a progresszív PH következtében. Az angina a PH következtében a jobb kamrai (RV) szívizom oxigénigényéből adódik a magas fal stressz következtében, valamint a szívkoszorúér-ágak szisztolés véráramának csökkenése az RV felé, és esetenként a bal fő koszorúér összenyomódása kitágult fővel tüdőartéria.
A tünetek súlyosságát a WHO funkcionális osztálya szerint osztályozzák, amely a New York Heart Association szívelégtelenség osztályozásának módosított formája [16]. A WHO 1. funkcionális osztálya olyan PH-s betegeket jelöl, akiknek nincs fizikai korlátja, míg a II. Osztály enyhe korlátozást jelent. Az ilyen betegek nehézlégzést, fáradtságot, mellkasi fájdalmat vagy közeli szinkopót tapasztalnak a hétköznapi tevékenységgel, de kényelmesen pihenhetnek. A markáns korlátozás a III. Osztályt határozza meg, a szokásosnál kevesebb aktivitást kiváltó tünetekkel. A IV. Osztályú betegeknél még nyugalmi állapotban is jelentkeznek tünetek, és a jobb szívelégtelenség jeleit és tüneteit mutatják. A syncope a IV. Osztály tünete. A WHO funkcionális osztályozása megjósolja a prognózist és irányítja a kezelést.
A fizikális vizsgálat és a radiográfia szintén javasolhatja a PH lehetséges diagnózisát. Fejlett PH-ban a jobboldali szívelégtelenség jelei lehetnek. Ezek közé tartozik a megemelkedett jugularis vénás nyomás, a hepatojugularis reflux, az ascites, a hepatomegalia vagy az alsó végtagi ödéma. Az auskultáció során tricuspid regurgitációs zörej, a második szívhang (P2) megnövekedett pulmonikus komponense vagy egy jobb kamrai vágta mutatható ki. A precordium tapintása felfedezhet egy lakóautó-emelést is. A mellkas radiográfia áttekintése kitágult pulmonalis artériákat, megnagyobbodott jobb pitvar- és RV-kontúrt, valamint perifériás metszést tárhat fel.
DIAGNOSZTIKAI ÉRTÉKELÉS
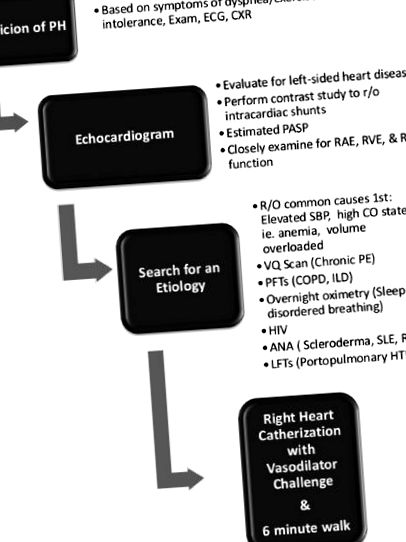
Echokardiográfia: Transthoracalis echokardiográfia az első diagnosztikai eszköz, ha PH-t gyanítanak az anamnézis és a fizikai vizsga után. Szűrő echokardiogram is ajánlott a PAH magas előzetes valószínűségével járó klinikai állapotok esetén, beleértve az ismert BMPR2 mutációt és a szisztémás szklerózist. Az ismert PAH kockázatú állapotoknak, beleértve a portális hipertóniát és a veleszületett szívbetegséget is, periodikus echokardiogramot kell végezni, különösen akkor, ha PH-ra utaló tünetek jelentkeznek [1]. A megnövekedett becsült pulmonalis artéria szisztolés nyomást gyakran észlelik véletlenül az echokardiogramokon, és az ilyen betegek racionális megközelítése áll a felülvizsgálat középpontjában.
Az echokardiogram központi szerepet játszik a PH diagnózisában és kezelésében. Becslést nyújt a pulmonalis artéria szisztolés nyomásáról, valamint a jobb pitvari (RA) és a jobb kamrai (RV) méretének és működésének értékeléséről. Az izgatott sóoldat-kontraszt alkalmazása kizárhatja az intracardialis sönt jelenlétét, és a PH értékelés részeként ajánlott [17]. Ugyanolyan fontos, hogy az echocardiogram figyelmeztetheti a klinikust más gyakori PH-val összefüggő állapotokra - leggyakrabban bal szívbetegségre.
Számos különféle visszhang-megállapítás segíthet megkülönböztetni a 2. csoport PH-ját (PVH) más kategóriáktól. A PVH echokardiográfiai jellemzői közé tartozik a kitágult bal pitvar (LA) vagy a kamra (LV), valamint a bal kamrai hipertrófia [18]. Fontos, hogy a bal kamrai ejekciós frakció (LVEF) csökkenthető vagy konzerválható. A mitrális regurgitációt gyakran vizualizálják, és az átvitt Doppler beáramlás gyors korai diasztolés iktatást mutat (E hullámsebesség> A hullámsebesség). Ezzel szemben a PAH-t jobban támogató eredmények között szerepel a normális LA és LV méret, normál vagy magas LVEF értékkel. Az RV: LV mérete általában nagyobb, mint 1,0, és az RV „átveszi” a csúcsot [19]. Az átviteli beáramlás mintája E20]. Ahogy a PH előrehalad és a jobb kamra az idő múlásával kitágul, az interventricularis szeptális laposodás a jobb kamra térfogatának és a nyomás túlterhelésének megfelelővé válhat.
További nem invazív vizsgálatok: A pulmonalis artéria szisztolés nyomása (PASP) a megnövekedett pulmonalis vaszkuláris ellenálláson kívül több okból is megemelhető. Így a kezdeti tesztelésnek a mögöttes etiológia azonosítására kell összpontosítania. A bal oldali szívbetegség (szelepes, szisztolés vagy diasztolés diszfunkció/szívelégtelenség) által okozott bal pitvari hipertónia gyakran kimutatható az echokardiogramon. Ki kell zárni a nagy teljesítményű szív állapotokat, beleértve a vérszegénységet, a terhességet, a cirrhosist, az AV fistulákat vagy a pajzsmirigy túlműködését. A megnövekedett szisztémás vérnyomás (azaz krónikus vesebetegség) szintén megnövelheti a pulmonális véráramlást, ami megnövekedett tüdőnyomáshoz vezethet. Ha a megemelkedett PASP ezen általános okait kizárják, akkor további vizsgálatokra van szükség.
A 6 perces séta teszt a hipoxémia értékelésének egyszerű módja, és erősen előrejelzi a túlélést a PAH populációban [21]. Szintén laboratóriumi értékelést kell végezni antinukleáris antitesttel, HIV-vel és májfunkciós teszttel. A tüdőfunkciós tesztek, az éjszakai oximetria és a szellőzés/perfúziós vizsgálatok szintén segíthetnek az etiológia meghatározásában. A spirális komputertomográfia (CT) nem ajánlott a VQ-vizsgálatok helyett, mivel fennáll annak a lehetősége, hogy a kisebb, távolabbi erekben a tromboembóliás betegség kimaradhat [1]. (ld. 1 1 algoritmushoz).
Pulmonális hipertónia kezdeti diagnosztikai megközelítés algoritmus. A 2009-es ACCF/AHA pulmonális hipertónia konszenzusos nyilatkozatából kiigazítva.
Az invazív hemodinamikai teszt az arany standard a PH diagnózisában. A PH egy tág kifejezés, amely pusztán a megemelkedett PA nyomást tükrözi, kifejezetten az átlagos PAP> 25. A jobb szív katéterezés (RHC) a következő lépés a diagnosztikai algoritmusban azoknál a betegeknél, akiknek valószínűleg PAH-t, a PH egyik formáját tartják, hogy kiderüljön, van-e valódi érelzáródás. A legfontosabb jellemzője a megnövekedett pulmonalis vaszkuláris ellenállás (PVR)> 3 erdőegység [1]. Az RHC létfontosságú a PAH (PCWP ≤ 15) és a PVH (PCWP> 15) megkülönböztetéséhez is [22]. A lényeges mérések magukban foglalják az oxigéntelítettségeket (a felső és az alsó vena cava, valamint a PA és a szisztémás artéria), RA és RV nyomást, szisztolés/diasztolés/átlagos PAP-t, PCWP-t, szívteljesítményt és PVR-t. Minőségi előírásokat kell alkalmazni a hemodinamika mérése során [23]. A nyomáshullám formákat a lejárat végén kell mérni. Ha a PCWP egyáltalán bizonytalan, meg kell mérni az LV végdiasztolés nyomását [24]. Az RHC általában nagyon jól tolerálható, a nemkívánatos események, köztük aritmiák, hematomák és pneumothorax 1,1% -os kockázatával számolnak be [25]. 7218 eljárásból álló, nagy multicentrikus nyilvántartásban az eljárással összefüggő összes mortalitás 0,055% volt.
Az RHC nemcsak megerősítő diagnózist nyújt, hanem segíti a prognózis meghatározását és lehetővé teszi a pulmonalis vazoreaktivitás értékelését. A vazodilatátoros kihívások az invazív hemodinamika alapvető elemei az 1. csoportba tartozó PAH-val rendelkező egyének számára. A pulmonalis vazodilatátor-kihívásra adott pozitív válasz az átlagos PA-nyomás legalább 10 mmHg-os csökkenése és 40 mmHg-nál kisebb abszolút átlagig történő csökkenése [26] a szívteljesítmény csökkenése nélkül. A pozitív teszt megjósolja a kalciumcsatorna-blokkolókra adott válasz biztonságosságát, amelyet gyakrabban figyelnek meg az idiopátiás PAH csoportban. Azoknál a betegeknél, akiknek nincs „reaktív” pulmonalis érrendszerük, általában előrehaladottabb a betegség, és erőteljesebben meg kell fontolni az agresszívebb kezelést [27].
A belélegzett nitrogén-oxid általában az akut értágítók tesztelésére választott szer, tekintettel a könnyű használatra és a korlátozott káros hatásokra. Az intravénás epoprostenol és az adenozin alternatívák, bár ezek beadása nehézkesebb, és további káros hatásokkal járhatnak. Ezeknek a szereknek az alkalmazásakor körültekintően kell eljárni egyidejűleg fellépő bal szívbetegségben szenvedő betegeknél, mivel a tüdőödéma kiválthatja a szelektív artériás értágulat, amely a kapilláris ágy elárasztásához vezet a megemelkedett bal pitvari nyomásoktól [28].
PH: Progresszív betegség
A PH előrehaladtával a PVR tovább emelkedik, tükrözve a pulmonalis artériás ágyban zajló kóros szerkezeti változásokat. A megnövelt PVR növekszik a lakóautó terhelése után, amely egy vékony falú szerkezet, amely jobban megfelel egy sokkal alacsonyabb nyomású rendszernek. Kezdetben a pulmonalis artéria nyomása addig emelkedik, amíg az RV el nem kezd működni, ami a jobb kamrai löket térfogatának csökkenéséhez vezet. Ezután a PA nyomás csökkenhet és az RA nyomás emelkedhet, mindkettő baljóslatú prognosztikus jel [29].
A hemodinamikai értékelés elengedhetetlen a PH-ban szenvedő betegek kockázat-rétegződése szempontjából, nagyrészt azért, mert az RV-kudarc drámai módon rontja a prognózist. A REVEAL nyilvántartásban egy kortárs PAH megfigyelési tanulmány szerint a jobb pitvari nyomás (RAP) fordítottan összefügg a túléléssel [30]. 10 Hgmm-nél kisebb jobb pitvari nyomás, 2,5 l/perc/m2-nél nagyobb szívindex mellett alacsony a kockázat. Éppen ellenkezőleg, a 20 Hgmm-t meghaladó jobb pitvari nyomás és az 1,0 L/perc/m2 alatti szívindex nagyobb kockázatot jelent a beteg számára [31]. A jobboldali szívelégtelenség, a szignifikánsan megnövekedett BNP, a WHO IV. Funkcionális osztályának klinikai bizonyítéka és a tünetek gyors előrehaladása jelzi az agresszív kezelés szükségességét [1]. A 6 perc gyalogteszt kevesebb, mint 300 méter, aggodalomra adhat okot. A kardiopulmonáris testmozgás tesztje prognosztikusan hasznos lehet, és a 10,4 ml/kg/percnél nagyobb VO2 csúcs enyhébb betegségre utal [32].
Az RV echokardiográfiai felmérése segít a betegek osztályozásában is. A minimális RV-diszfunkció alacsony kockázattal jár együtt, míg a jelentős megnagyobbodás és diszfunkció magasabb kockázattal járó beteget jelent [33]. A PH előrehaladtával az RV geometriája kompenzációs mechanizmusként változik az utóterhelés folyamatos növekedésével. A lakóautó kezdetben hosszirányban megnyúlik, majd keresztmetszeti átmérőjében. Végül ez utóbbi az LV felé hajlik, mivel a lakóautó oválisabb formát ölt [32]. A jobb kamrai elégtelenség azonosítása elengedhetetlen, mivel ez a morbiditás és a mortalitás fő meghatározója [33].
TERÁPIAI OPCIÓK
WHO 1. csoport: PAH
Kalciumcsatorna-blokkolók (CCB-k), beleértve az amlodopint, a diltiazemet és a hosszú hatású nifedipint, alkalmazhatók olyan betegeknél, akiknél akut válasz jelentkezik egy értágító hatásra. Az igaz válaszadók általában ritkák. Egy tanulmányban a teljes IPAH csupán 6,8% -ának volt pozitív kihívása, és fenntartotta a CCB-re adott hosszú távú válaszát [34]. A szisztémás hipotenzió általában a leggyakrabban előforduló káros hatás. A CCB-vel kezelt betegeket szorosan figyelemmel kell kísérni a tartós hatékonyság figyelemmel kísérése érdekében.
Az intravénás epoprostenol volt az első szer, amely növelte a túlélést a súlyos PAH-ban szenvedő betegek hemodinamikájának és tüneteinek javításán túl [42]. Az epoprostenol tipikus kezdő dózisa 2 ng/kg/perc, felfelé titrálva 20-40 ng/kg/perc. Az elmúlt években más prosztaciklin analógokat is jóváhagytak. Az iloprosztot napi hat-kilenc alkalommal inhalálják, 2,5 vagy 5 µg/dózisban. A treprostinil többféle kiszerelésben kapható, beleértve intravénás, szubkután és inhalációs (napi 3–9 inhaláció naponta négyszer) adagolást. A prosztaciklinek alkalmazását általában a leg betegebb PAH-betegek számára tartják fenn, akik nem reagálnak más gyógyszeres terápiákra. A káros hatások közé tartozik a fejfájás, kipirulás, kiütés, hasmenés és az állkapocs fájdalma. Óvatosan kell eljárni, mert ezeknek a szereknek a megnövekedett bal oldali töltőnyomásban szenvedő betegeknél történő alkalmazása flash tüdőödémát eredményezhet [43]. Ha a PAH-specifikus terápiákat indokoltnak ítélik tüdőbetegségben szenvedő betegeknél, ügyelni kell arra, hogy a nem szellőztetett alveolusokba irányuló fokozott véráramlás a V/Q eltérés miatt súlyosbíthatja a dyspnoát és a hypoxemiát [1].
A tüdőátültetés továbbra is az egyetlen végleges gyógymód a PAH-ban, és azoknál mérlegelik, akik az optimális orvosi terápia ellenére sem javulnak. A pitvari septostomia palliatívan alkalmazható olyan végstádiumú PAH-betegeknél, akik nem transzplantáltak, vagy transzplantációra várókban [44, 45].
WHO 2-4. Csoport
KÜLÖNLEGES FÓKUSZ: SZÜVEGBETEGEDŐ BETEGEK
- A tüdő tuberkulózis típusai, tünetei és kezelése
- Pleurális effúzió - okok, tünetek, típusok és kezelések
- A 3. stádiumú tüdőrák típusai, tünetei, diagnózisa, kezelése és prognózisa
- Rosaceás kezelések, típusok, okok és tünetek
- A mesenterialis limfadenitis tünetei, okai, tesztjei és kezelése