A rendszerimmunológiai megközelítés azonosítja az 5 miR együttes hatását Th2 gyulladásban
Ayşe Kılıç
1 Laboratóriumi Orvostudományi és Pathobiokémiai Intézet, Molekuláris Diagnosztika, Philipps University Marburg, Marburg, Németország.
Marc Santolini
2 Komplex Hálózatkutatási Központ, Fizikai Tanszék, Northeastern University, Boston, Massachusetts, USA.
3 Brigham és Női Kórház, a hálózati orvoslás Channing osztálya, Orvostudományi Osztály, Harvard Medical School, Boston, Massachusetts, USA.
4 Rákrendszerbiológiai Központ (CCSB) és Rákbiológiai Tanszék, Dana-Farber Rákkutató Intézet, Boston, Massachusetts, USA.
Taiji Nakano
1 Laboratóriumi Orvostudományi és Pathobiokémiai Intézet, Molekuláris Diagnosztika, Philipps University Marburg, Marburg, Németország.
Matthias Schiller
5 Dermatológiai és Venereológiai Klinika, Rostocki Egyetem Orvosi Központ, Rostock, Németország.
Mizue Teranishi
6 Max Planck Szív- és tüdőkutató intézet, Bad Nauheim, Németország.
Pascal Gellert
7 Breast Cancer Now kutatóközpont a rákkutató intézetben, London, Egyesült Királyság.
Julija Ponomareva
8 Kardiovaszkuláris Regenerációs Intézet, Molekuláris Orvostudományi Központ, Goethe Egyetem, Frankfurt, Frankfurt, Németország.
Thomas Braun
6 Max Planck Szív- és tüdőkutató intézet, Bad Nauheim, Németország.
Shizuka Uchida
9 Kardiovaszkuláris Innovációs Intézet, University of Louisville, Louisville, Kentucky, USA.
Scott T. Weiss
3 Brigham és Női Kórház, a hálózati orvoslás Channing osztálya, Orvostudományi Osztály, Harvard Medical School, Boston, Massachusetts, USA.
Amitabh Sharma
3 Brigham és Női Kórház, a hálózati orvoslás Channing osztálya, Orvostudományi Osztály, Harvard Medical School, Boston, Massachusetts, USA.
Harald Renz
1 Laboratóriumi Orvostudományi és Pathobiokémiai Intézet, Molekuláris Diagnosztika, Philipps University Marburg, Marburg, Németország.
Társított adatok
Absztrakt
Bevezetés
Az asztma a légutak egyik fő krónikus gyulladásos betegsége, amelynek prevalenciája és előfordulása világszerte növekszik (1). A legújabb klinikai eredmények komplex és heterogén patofiziológiát jeleznek az asztmás betegek körében (2). Jelenleg a betegek alcsoportjait a sejtes és molekuláris aláírások alapján határozzák meg, amelyeket endotípusoknak neveznek (3, 4). Ezek közül a 2-es típusú endotípus igen elterjedt, az asztmások körülbelül felét foglalja magában, és a T helper 2 (Th2) immunitás központi szerepe is jól meghatározza. A Th2 sejtek megkülönböztetik a naiv CD4 + T sejteket, amelyek a funkcionálisan sokszínű Th sejt szubpopulációk közös prekurzoraként szolgálnak (5–9). Naiv T-sejtekben az IL-4 a GATA3 transzkripciós faktor expresszióját indukálja, amely elősegíti az IL-4, IL-5 és IL-13 expresszióját. Kiegészítő sejtekben ezek a citokinek számos downstream reakciót váltanak ki, ami szöveti átalakulást és a tüdőfunkció súlyos károsodását eredményezi (10, 11).
A Th2 immunválasz felerősödik az önszaporító hurkokban, az idő múlásával stabilizálódik, és elkerüli az immunszabályozást például Treg sejtek által (12). A gazda továbbra sem képes helyreállítani az immunháztartást. A gyulladt szövetben az allergiás válasz fenntartásának hátterében álló molekuláris mechanizmusok nincsenek pontosan meghatározva. Ezért ezeknek a jeleknek a megfejtése kulcsfontosságú a betegségek kórokozó mechanizmusainak megértésében. A közelmúltban kimutatták, hogy a poszttranszkripciós mechanizmusok, beleértve a mikroRNS-eket (miR-eket), szabályozzák a génexpressziót, és felismerték, hogy jelentősen hozzájárulnak az emberi betegséghez (13–15).
A miRs finomhangolja a génexpressziót az mRNS lebontásának és a fehérjeszintézis visszaszorításának megkönnyítésével (16, 17), és a miR-ek megváltozott expresszióját dokumentálták T-sejt-vezérelt betegségek esetén, beleértve az asztmát (18–22). Mivel a miR-eket a gének kódolják, és a génexpressziót nagymértékben befolyásolja a Th-sejtekben történő citokinbevitel, valószínű, hogy a miR-expresszió szintjét befolyásolják a gyulladt szövetben jelen lévő különféle ingerek, és a betegség különböző stádiumaiban változó mikro-miliők. Azt, hogy a Th2 sejtek miR expressziós mintázata a krónikus allergiás gyulladás további változásainak van-e kitéve, és ha ezek a változások befolyásolják a gyulladt szövet Th2 részhalmazának fenntartását, még nem vizsgálták.
Egyetlen miR széles célspektruma miatt nehéz megjósolni a miR-szabályozás következményeit a sejtes folyamatokra, hacsak nem vesszük figyelembe a miR-szabályozott gén és fehérje expressziót. A rendszerbiológiai megközelítések sikeresen feltérképezik az ilyen interakómákat és miRNome adatokat a betegség szabályozási útjainak azonosításához (23–30).
Itt kifejlesztettünk egy hálózati alapú keretrendszert, a Differential Expression Across Layers Impact of Differential Expression Across Layers (IDEAL) elemzést, amely a miR-eket prioritásként kezeli a differenciálisan expresszált (DE) gének (betegség modul) helyi szomszédságában zajló interakciós mintázataik alapján. A miR-ek kumulatív hatásának mérésére a miR-mRNS és mRNS-mRNS többrétegű hálózatban bevezettük a kollektív hatást (CI). Ez a megközelítés meghatározta az 5 asztmával kapcsolatos miR részhalmazát, amelyek maximális topológiai hatással bírnak. Érdekes módon ezek a miR-ek csak mérsékelt hajtásváltozást (FC) mutatnak, és a hagyományos hálózati-agnosztikai módszerekkel nem lehetne rögzíteni őket. Végül in vitro validáljuk ezeket az eredményeket azáltal, hogy antagonizáljuk aktivitásukat a Th2 sejtekben, és az IL-5, IL-9 és IL-13 Th2-specifikus effektor citokinek alacsonyabb termelését detektáltuk.
Eredmények
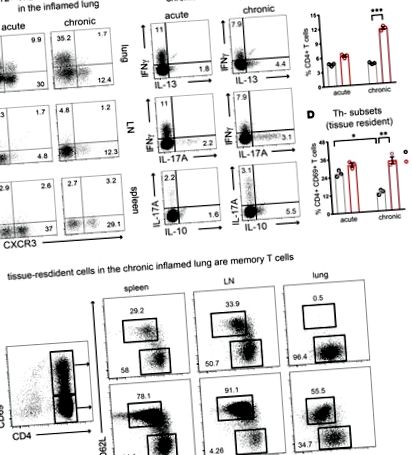
A CD4 + Th2 sejtpopuláció stabilizálódik a krónikus gyulladásos légutakban.
Hőtérkép, amely különböző módon kifejezett miR-eket ábrázol (A) korai Th2 és (B) stabil Th2 sejtek a naiv T sejtekhez képest. (C) A korai és stabil Th2 sejtekben a szabályozott miR-eket összefoglaló Venn-diagram.
A miR-ek hatása a Th2 betegség modulokra.
Tekintettel arra, hogy minden miR rendszerint több mRNS célpontot szabályoz, elengedhetetlen a miR és mRNS hálózatok összekapcsolhatósági szerkezetének integrálása a Th2 aláírás dinamikájának molekuláris szintű megértése érdekében. A miRNome és az interomeom térképezés legújabb fejleményei bizonyítják az ilyen rendszerbiológiai megközelítések érettségét és értékét a betegségek szabályozási útjainak felfedezésében (23–30). Egy lépés előrelépése, a miRNome és az interakóm integrálása a transzkriptóm kifejezéssel együtt lehetővé tette számunkra, hogy kiemelt fontosságúvá tegyük a jelentős kollektív hatású miR-eket (4A. Ábra). A humán fehérje-fehérje-kölcsönhatás (PPI) és miR-mRNS hálózatokat használtuk, azzal a megállapítással, hogy az emberi PPI-hálózatok jól konzerváltak az egerekben (36, 37) (lásd Módszerek).
A betegség génjei általában a modulokként definiált interakóma lokalizált szomszédságában aggregálódnak (29). Itt megvizsgáltuk, hogy a naiv Th sejtek tekintetében a DE gének ugyanazt a klaszterezési mintát követték-e. A különböző FC-cutoffok fölötti DE-géneket feltérképeztük az emberi interakómára, és a megfelelő fehérjék aggregációját a legnagyobb összekapcsolt komponens (LCC) méretével - a legnagyobb összekapcsolt algráf csomóinak számával - mértük. Az azonos méretű gének véletlenszerű halmazainak összehasonlítása lehetővé tette számunkra a szignifikancia Z-pontszám levezetését (lásd: Módszerek). Megfigyeltük, hogy a DE gének erősen összekapcsolt klasztereket képeznek a köztes FC-k számára (FC = 1,3, Z = 5,3 a stabil Th2 esetében, 4B ábra; és FC = 1,8, Z = 4,3 a korai Th2 esetében, 4C ábra). Ezeket az FC-ket választották a korai és stabil Th2-betegség modulok meghatározására. Ez a módszertan csak a DE-gének közötti kapcsolati mintákra támaszkodik, elkerülve ezzel azt a hagyományos csapdát, hogy előre meghatározott FC-határértéket kell választani.
Ezután azt kérdeztük, hogy a DE miR-ek befolyásolják-e a topológiailag központi célokat a kapott betegség modulokban. Mindegyik esetben a DE miR-ek hatását úgy értékelték, hogy az előre jelzett célokat eltávolították a megfelelő betegség modulból, amely megközelítés a skálamentes hálózatok támadására emlékeztet (38). Korai és stabil esetben egyaránt azt tapasztaltuk, hogy a modulok összetartása elveszett a céleltávolítás után, az LCC-méretek jelentéktelen szintre csökkentek (4D. Ábra, vörös bab). Másrészről, a modulok továbbra is összetartottak ugyanolyan számú célpont véletlenszerű támadása alatt (4D. Ábra, szürke bab).
A miR-ek prioritása a betegség modulokra gyakorolt hatásuk alapján.
A fontos, differenciáltan expresszált (DE) miR-ek rangsorolásához kifejlesztettünk egy módszert a betegség modulra gyakorolt kollektív topológiai hatásuk mérésére, az Impact of Differential Expression Across Layers (IDEAL). (A) Az IDEAL egy betegségmodullal indul, amelyet a betegség génjei (körök) alkotnak az interakómában, és egy DE miR (gyémánt) halmaza célozza meg. A legnagyobb csatlakoztatott alkatrészt (LCC) narancssárga színnel mutatják. (B) A miR-ek és az ellentétes hajtásváltozású mRNS-ek közötti kölcsönhatások megmaradnak. (C) A központi miR maximális hatást fejt ki, mérve az LCC méretének csökkenésével a cél eltávolításakor, ezért ez az első IDEAL miR. Ezután az eljárás megismétli az új miR legnagyobb hatással történő megtalálását, eltávolítja a célpontokat, és addig folytatja, amíg az összes miR nincs besorolva.
(A) Az n miR eltávolítása utáni kumulatív hatást a kollektív hatás (CI) méri, amely olyan módszer, amely szisztematikusan hasonlítja össze az n miR által okozott támadás utáni legnagyobb összekapcsolt komponens (LCC) relatív méretét a véletlenszerűen várható értékkel. A CI csúcsa körülbelül 5 miR-nél volt megfigyelhető, ami a stabil Th2 maximális hatását, a korai Th2 esetében pedig körülbelül 10 miR-t jelzi (B). (C) Venn-diagram, amely összehasonlítja a legmagasabb rangú miR-eket a hajtásváltással (FC) és a differenciál expressziós rétegek közötti (IDEAL) módszerekkel. (D) A stabil Th2 betegség modult mutatjuk be (gének, körök; miR-ek, V-k). Az első 5 miR piros színnel van kiemelve, és célpontjaik sötétvörös színnel vannak kiemelve. A csomópont mérete arányos a fokkal. Az alhálózat kiemeli a célgének és az adott miR első szomszédjai között gazdagított legfelső utakat az interakómában. A kék körök jelzik az mTOR-t, a sárga az EGFR1-t, a lila a TGF/SMAD-t, piros az IL-5-t és zöld a TRIF-utat. Az útvonalak közötti közös csomópontok fekete színűek.
Az IDEAL és az FC miR-jeit a 6C. Ábra hasonlítja össze. Az FC rangsor jelentős listát eredményez a korai és a stabil körülmények közötti hasonló jelöltekről. Másrészt az IDEAL rangsor ortogonális halmazokat eredményez, amelyek nagyon specifikusak az egyes feltételekre, és csak a miR-203 oszlik meg a korai és a stabil körülmények között. Végül a miR-27b-nek, az IDEAL stabil Th2-es rangsorában elért legmagasabb rangú jelöltnek azt is jósolták, hogy korai és stabil körülmények között egyaránt magas az FC-je, így erős jelölt.
Összességében azt találtuk, hogy a miR-ek kis csoportja (142-ből 5;
Az összes DE miR 4% -a) maximális CI volt a stabil Th2 betegség modulon. Ez a készlet a szabályozott (miR-27b és -23b) és az elnémított (miR-206, miR-106b és miR-203) miR kombinációját tartalmazta. Ezen miR-ek lehetséges biológiai szerepének vizsgálatához a közvetlen miR-célpontokat és az interakómában található első szomszédaikat útanalízisnek vetették alá (lásd: Módszerek szakasz, 1. táblázat és 6D. Ábra). A miR-27b által megcélzott legfelső út nukleáris SMAD2/3 volt, és az EGFR1 jelátviteli utat a miR-23 szabályozza. Mindkét út összefügg a szabályozó T-sejtek immunszuppressziójával és aktivitásával (39, 40). Ezen utak aktív elhallgattatása stabil Th2 sejtekben segíthet elkerülni a belső immunszabályozást. Ezzel szemben a Th2 sejtekben elhallgattatott miR-ek aktívan megcélozzák a jelátviteli utak azon komponenseit, amelyek polarizációval (41), aktivációval és proliferációval (42) társulnak, valamint a citokinektől (43, 44) lefelé hatnak, amelyekre az IL 5. Ezek az eredmények együttesen azt mutatják, hogy ezen specifikus miR-ek aktivitásának elnyomása kombinálva az immunszuppresszív utak aktív elhallgatásával Th2-sejt fenntartást eredményezhet.
Asztal 1
Az IDEAL miRs célzása enyhíti a citokintermelést a Th2 sejtekben.
Ezt a megjósolt miR-készletet több funkcionális vizsgálatban tovább validálták. Minden miR-hez kiválasztottunk egy célgént, amely mind a betegség modulon belül erősen kapcsolódik, mind pedig az ember és az egér között megőrzi a mag szekvenciáját (további 3. ábra, Módszerek). Ez azt eredményezte, hogy a miR-27b esetében a CTCF, a miR-206 esetében az NCOA3, a miR-106b esetében az ELK3, a miR-203 esetében AHR és a miR-23b esetében ELF2 volt kiválasztva. A kettős riporterrel végzett luciferáz-vizsgálat a kiválasztott célgének szabályozását mutatta ki a megfelelő miR-ekkel, amit az összes vad típusú (WT) 3′-UTR szekvencia esetében detektált luciferáz szignál szignifikáns és jelentős csökkenése mutat. A szekvencia specifitást a miR mag szekvenciák (mutáns) törlésével validáltuk, ami változatlan luciferáz szignált eredményezett (7A. Ábra). Ezek az eredmények megerősítik a gyulladásba olvadó több útvonal központi génjeinek IDEAL miR-ek általi szabályozását.
Vita
Ez a rendszerimmunológiai megközelítés - IDEAL - azonosítja a miR-ek által kiváltott legfontosabb gén-szabályozási változásokat a sejt molekuláris kölcsönhatásainak teljes sorozatában (interakóma). Az IDEAL tovább mérlegeli a miR aktivitásnak az interakómára gyakorolt nettó következményeit egy hálózati alapú prioritás-algoritmus alkalmazásával. A kumulatív perturbációs kimenetel felmérése a miR-ek számának és azonosságának meghatározásához, amelyek együttesen lépik át a nyugalmi küszöböt és gyulladáshoz vezetnek, az IDEAL 5 miR maximális kollektív hatását jósolta meg stabil Th2 sejtekben, amelyek fel- és lefelé szabályozott miR-eket tartalmaznak. Ezen miR-ek expressziós szintjének in vitro antagonizálása jelentősen csökkentette a citokintermelést a Th2 sejtekben. Összességében úgy gondoljuk, hogy ez az első olyan tanulmány, amely a miR expresszió változását írja le, mint az allergiás immunválasz perzisztenciáját ösztönző mechanizmust.
Összefoglalva: szisztematikusan profilizáltuk a Th2 sejteket, és kifejlesztettünk egy rendszerbiológiai eszközt (IDEAL), hogy értékeljük a miR-ek szerepét az asztmás Th2 válasz perzisztenciájának szabályozásában. Túlléptük a szokásos FC-alapú elemzéseket, és megvizsgáltuk a miR-ek hatásának elterjedését a molekuláris interakciós hálózatban (interakóma). Bizonyítékokat és bizonyítékokat szolgáltatunk a holisztikus rendszerek immunológiai megközelítésének hasznosságáról a kényes kölcsönhatások megfejtésében, konvergálva a kóros tulajdonságokra, és bizonyítékot szolgáltatunk a Th2 sejtekben található egyedi miR-ek komplex és kombinatorikus aktivitására. Ennek a kollektív miR hatásnak az azonosítása új lehetőségeket nyithat a Th2 által vezérelt betegség kezelésére szolgáló miR kombinációkra irányuló terápiás beavatkozások számára.
Mód
6–8 hetes nőstény BALB/c egereket (Charles River) használtunk a kísérletekhez. Az egereket szokásos körülmények között helyeztük el, szabad hozzáféréssel a rágcsáló chow-hoz és a vízhez.
- Az egészséges táplálkozás rendszerszemlélete
- A rendszerszemlélet szerint a mieloid sejtekben a MAVS jelzés kritikus fontosságú az Ebola-rezisztencia szempontjából
- Bio-Serv s rágcsáló gyógyszeres adagoló rendszerek (Rodent MD s ™); alacsony stressz-adagolási alternatíva
- Absztrakt P268 A túlsúly és az elhízás hatása a magas vérnyomás előfordulásában és kezelésében
- 3 alapvető energetikai rendszer titkokat szolgáltat; Engedje meg, hogy az edzők tökéletesítsék a célorientált testmozgást!