A SUMO szerepe a metabolikus szabályozásban
Absztrakt
A fehérje módosítása a kis ubiquitin-kapcsolódó módosítóval (SUMO) hatással lehet a fehérje működésére, az enzimaktivitásra, a fehérje-fehérje kölcsönhatásokra, a fehérje stabilitására, a fehérje célzására és a sejt lokalizációjára. A SUMO befolyásolja a metabolikus enzimek működését és szabályozását az útvonalakon belül, és egyes esetekben a teljes anyagcsere útvonalakat célozza meg azáltal, hogy befolyásolja a transzkripciós faktorok aktivitását, vagy megkönnyíti a teljes anyagcsere útvonalak transzlokációját a szubcelluláris rekeszekbe. A SUMO módosítása szintén a tápanyag- és anyagcsere-érzékelő mechanizmusok kulcseleme, amelyek szabályozzák a sejtek anyagcseréjét. A metabolikus homeosztázis fenntartásában kialakított szerepe mellett egyre több bizonyíték áll rendelkezésre arra vonatkozóan, hogy a SUMO kulcsfontosságú tényező a sejtes stresszválaszok elősegítésében a legalapvetőbb anyagcsere-folyamatok szabályozásával és/vagy adaptációjával, beleértve az energia- és nukleotid-anyagcserét. Ez az áttekintés a SUMO szerepére összpontosít a sejtanyagcserében és az anyagcsere betegségekben.
9.1 Bevezetés: A SUMO funkciói az anyagcserében
A fehérje módosítása a kis ubiquitin-rokon módosító SUMO-val befolyásolhatja a fehérje működését, az enzimaktivitást, a fehérje-fehérje kölcsönhatásokat, a fehérje stabilitását, a fehérje célzását és a sejt lokalizációját. Az azonosított sumoilált fehérjék és a SUMO-val kölcsönhatásban lévő fehérjék száma a SUMO interakciós motívumokon (SIM) keresztül folyamatosan nő (Becker et al. 2013; Bruderer et al. 2011; Eifler and Vertegaal 2015; Hendriks et al. 2014; Impens et al. 2014; Jardin és mtsai 2015; Jentsch és Psakhye 2013; Kaminsky és mtsai 2009; Kroetz és Hochstrasser 2009; Lamoliatte és mtsai 2014; Makhnevych és mtsai 2009; Subramonian és mtsai 2014; Tammsalu és mtsai 2014, 2015; Yang és Paschen 2015; Yang et al. 2012). A poszt-transzlációs módosítás más formáihoz hasonlóan a szumoilezés is ismert, hogy részt vesz a legtöbb, ha nem az összes sejtes folyamatban (Flotho és Melchior 2013; Gareau és Lima 2010; Hecker és mtsai 2006; Makhnevych és mtsai 2009; Stehmeier és Muller 2009; Wilkinson és Henley 2010). A szumojiláció reverzibilis módosítás: A SUMO/sentrin-specifikus proteázok (SENP) képesek eltávolítani a SUMO-kat a célfehérjékből, hozzájárulva a szumoiláció dinamikus szabályozásához (Flotho és Melchior 2013; Hay 2007; Hickey és mtsai 2012; Mukhopadhyay és Dasso 2007; Yeh 2009).
Nem meglepő, hogy a SUMO mára ismert módon befolyásolja és befolyásolja a specifikus metabolikus enzimek működését és/vagy szabályozását az útvonalakon belül, és egyes esetekben a teljes metabolikus útvonalakat szabályozza azáltal, hogy befolyásolja a mesterkontroll fehérjék aktivitását, vagy megkönnyíti a teljes anyagcsere út transzlokációját szubcellulárisra. rekeszek (Gareau és Lima 2010). A metabolikus homeosztázis fenntartásában betöltött szerepe mellett egyre több bizonyíték áll rendelkezésre arról, hogy a SUMO kulcsfontosságú tényező a sejtes stresszválaszok elősegítésében. Ez a legalapvetőbb anyagcsere-folyamatok, köztük az energia- és a nukleotid-anyagcsere szabályozásával történik, és lehetővé teszi a fiziológiai alkalmazkodást a sejt- és környezeti várakozásokra reagálva (Enserink 2015; Makhnevych et al. 2009). A SUMO összetett emberi betegségekben és fejlődési rendellenességekben vesz részt, amelyek táplálkozási és/vagy anyagcserezavarokkal is társulnak, beleértve az Alzheimer-kórt is (Dorval és Fraser 2007; Hoppe és mtsai 2015; Lee és mtsai 2013, 2014b; Martins és mtsai 2016; McMillan et al. 2011; Sarge és Park-Sarge 2009), Parkinson-kór (Guerra de Souza és mtsai 2016) (Eckermann 2013; Krumova és mtsai 2011), I. típusú cukorbetegség (Li és mtsai 2005; Wang és She 2008), családi parciális lipodisztrófia (Simon és mtsai 2013), cukorbetegség által közvetített kardiovaszkuláris betegség (Chang és Abe 2016), veleszületett szívbetegség (Wang és mtsai 2011), kardiomiopátia (Kim és mtsai 2015c; Zhang és Sarge 2008), arthritis (Yan és mtsai. 2010), amiotróf laterális szklerózis (Dangoumau és mtsai. 2016; Foran és mtsai. 2013; Niikura és mtsai. 2014), valamint ajak- és/vagy szájpadhasadék (Alkuraya és mtsai. 2006; Song és mtsai. 2008; Tang és mtsai 2014).
9.2 A metabolikus utak SUMO és transzkripciós szabályozása
9.2.1. A lipid bioszintézis SUMO és fő szabályozása
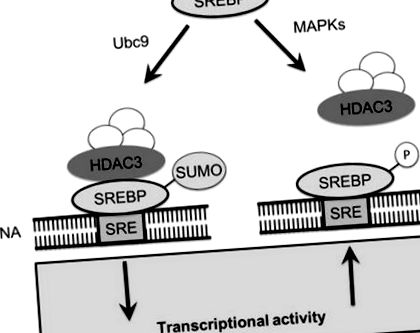
A Golgi-ból proteolízissel felszabadult SREBP-k további magszabályozásnak vannak alávetve a két poszttranszlációs módosítás, a szumoiláció és a foszforiláció antagonista kölcsönhatásával a magban (Arito és mtsai 2008). Az SREBP-k a növekedési hormon által indukált mitogén-aktivált protein kinázok (MAPK) ERK1 és ERK2 célpontjai. Az ERK-függő foszforiláció a SUMO-módosítás helyének közvetlen közelében történik, de nagyon eltérő funkcionális hatásokat vált ki az SREBP-aktivitásra (Arito és mtsai 2008). Az SREBP-2 S455-nél végzett foszforilezése növeli transzkripciós aktivitását, míg a K464-nél végzett SUMO-módosítás gátolja aktivitását (Arito és mtsai 2008). A SREBP-2 foszforilációja és a szumoiláció versenyképes módosításnak bizonyult; az S455 alanin-maradékként történő mutációja fokozza a szumoilációt, míg az S455G mutáns SREBP-2, amely egy foszforilezett SREBP-2 utánzó, károsodott szumoilációt mutatott (Arito et al. 2008). Mivel az S455 foszforilezésnek az SREBP szerkezetére vagy működésére gyakorolt közvetlen hatásáról nem számoltak be, az S455 foszforilezés fiziológiai funkciója az SREBP szumoiláció megakadályozását jelentheti (9.1. Ábra).
Az SREBP-k sumoilációja toborzó komplexet toboroz, amely magában foglalja a HDAC3-at. A HDAC3-at tartalmazó komplex felvétele csökkenti az SREBP-k transzkripciós aktivitását. A SUMO-ra csak a társ-represszor komplex kialakulásához van szükség, mivel a komplex továbbra is elnyomja a SUMO eltávolítását. Alternatív megoldásként az SREBP-ket foszforilezhetjük MAPK-kkal, amelyek gátolják a szumoilációt azáltal, hogy versengenek a szumoilációs motívum közelében lévő helyekért. Az SREBP foszforilációja lehetővé teszi a lipid bioszintézis transzkripciós aktiválását szterin-válasz elemeket tartalmazó gének expresszálásával
A SREBP SUMO-val történő módosítása funkcionális következményeket vált ki. Az SREBP szumoiláció gátolja a SREBP transzkripciós aktivitását közvetetten egy ko-represszor komplex toborzása révén, amely a hiszton-dezacetilázt 3 (HDAC3) tartalmazza. A represszor komplex felvételét és felállítását követően az SREBP-2 SUMO rész valószínűleg nem lényeges, mivel a represszor komplexben jelen lévő SREBP többségének nincs SUMO módosítása. A HDAC3 aktivitás közvetlenül befolyásolja a lipid homeosztázist, mivel a HDAC3 expresszió visszaszorításakor mind az LDL felvétel, mind az LDL receptor expressziója megemelkedett a HepG2 sejtekben (Arito és mtsai 2008). Az SREBP növekedési hormon által indukált ERK-függő foszforilációja biztosítja, hogy a növekedés időszakában a membrán bioszintéziséhez lipidszintézis forduljon elő, míg a szumoiláció képes visszaszorítani a lipid bioszintézist és csillapítani az endoplazmatikus retikulumból származó lipidérzékelő jeleket és SREBP fehérjét generálni.
Bizonyíték van arra is, hogy az SREBP-1 szumoilezése szerepet játszik a hasnyálmirigy alfa-sejtjeinek glükogonszekréciójában. A glükagon csökkenti a máj lipidszintézisét, és köztudott, hogy az SREBP-1c éhgyomorra visszaszorul. A glükagon metabolikus hatásait a cAMP-függő protein kináz A (PKA) közvetíti. Nemrégiben bebizonyosodott, hogy az SREBP-1 a PKA foszforilezésének egyik szubsztrátja (Dong és mtsai, 2014). Táplálkozáshiány során a PKA aktiválódik, amelynek eredményeként a PIASy SREBP-1c szumoilációt indukál. Ez a kaszkád az SREBP-1 fokozott szamoilezését eredményezi, elnyomja annak transzkripciós aktivitását és kikapcsolja a máj lipogenezisét (Lee és mtsai 2014a). Ez az út az SREBP-1 transzkripciós aktivitásának dinamikus finomhangolását jelenti különféle táplálkozási és hormonális változásokra adott válaszként, hogy az éhgyomorra vagy a táplálkozáshiányra a lipidszintézist kikapcsolja. Így az SREBP-k szumoilációja fontos szerepet játszik a máj lipogén programjának elnyomásában az éhgyomri indukcióval.
9.2.2. SUMO és metabolikus nukleáris receptorok
9.3 SUMO a családi részleges lipodystrophiában
A családi parciális lipodisztrófia (FPLD) egy olyan anyagcserezavar, amelyet a pubertás után abnormális regionális és progresszív zsírszövetvesztés jellemez az adipocita degenerációja miatt. Az FPLD gyakran társul inzulinrezisztens cukorbetegséggel, acanthosis nigricans és hypertriglyceridemia. Az FPLD esetek egy részét Dunnigan-típusú családi parciális lipodisztrófiának vagy 2. típusú családi parciális lipodisztrófiának (FPLD2) is nevezik, az A és C szerkezeti nukleáris fehérjéket kódoló LMNA gén mutációi okozzák (Cao és Hegele 2000; Speckman és mtsai. 2000). A Lamin A/C-t szuboilálják (Boudreau és mtsai 2012; Zhang és Sarge 2008), és a SUMO-t egy SUMO-interakciós motívumon (SIM) keresztül is megkötik (Moriuchi et al. 2016). A családi parciális lipodystrophiához kapcsolódó A-mutációk megváltoztatják az A-lamin szumoilációját (Simon és mtsai 2013). Az FPLD-t okozó mutációk csökkentik a lamin A SREBP1-hez való kötődését és nagyszámú SREBP1 célgént szabályoznak (Lloyd et al. 2002; Vadrot et al. 2015). Így olyan modellt javasoltak, ahol a lamin A K486 SUMO általi módosítása blokkolja az egymással kölcsönhatásba lépő fehérjék, köztük az SREBP1 megkötését (Simon és mtsai 2013). Ezek a vizsgálatok a megváltozott lamin A szamoilezést vonják maguk után a családi parciális lipodystrophiában; az FPLD molekuláris mechanizmusait és a megváltozott lamin A szamoilezés metabolikus következményeit azonban még tisztázni kell.
9.4 Metabolikus alkalmazkodás a celluláris és oxidatív stresszhez
A promielocita leukémia (PML) fehérje a PML nukleáris testek (NB) fő alkotóeleme és állványa, amelyek a stressz hatására összeállnak. Az oxidatív stressz során a PML fehérje oxidálódik, és diszulfid-közvetített gömb alakú hálót képez, amelyek az UBC9-et toborozzák, ami fokozza a PML szumoilációt (Sahin és mtsai 2014). A szumojilált PML olyan SUMO-kötő fehérjéket toboroz, amelyek az NB belső magban szekvenálódnak. Az oxidatív stresszre reagálva az NB-k elősegítik ezen úgynevezett partnerfehérjék szamoilezését (Sahin és mtsai 2014).
9.5 SUMO és energiacsere
9.5.1 SUMO az izomanyagcserében
A szumojilált KLF5 transzkripciós-represszív szabályozó komplexekben található, nem szignifikáns PPARβ/δ és társ-represszor represszorokkal (9.1. Táblázat). Ez a komplex elnyomja a karnitin-palmitoil-transzferáz-1b (Cpt1b), valamint a szétkapcsoló 2-es és 3-as fehérje (Ucp2 és Ucp3) expresszióját, amelyek a lipid oxidáció és az energia szétkapcsolódás szabályozói. A Cpt1b a mitokondriális zsírsav behozatalának sebességkorlátozó lépését katalizálja a β-oxidáció érdekében. Az Ucp2 és az Ucp3 elválasztja az oxidatív foszforilációt az ATP-generációtól és ezáltal hőt termel, de a mitokondriumokból származó ROS szabályozására is szolgál. A PPARβ/δ ligandum megkötése után a KLF5 deszumoilálódik, és transzkripciósan aktív komplexekkel társul, ami a Cpt1b, Ucp2 és Ucp3 expresszió fokozásához vezet (9.2. Ábra). Ebben a tekintetben a KLF5 deszumoyiláció a tápanyagok szignalizációjának egyik alkotóeleme a transzkripciós faktor komplexeket tartalmazó PPARβ/δ-n belül, és szabályozó kapcsolóként működik, amely közvetíti az energiafogyasztás transzkripciós aktivációját (Oishi et al. 2008).
a) Alapvető körülmények között a SUMO-val módosított KLF5 egy társ-represszor komplex része, amely nem igényelt PPAR-5-t tartalmaz. A KLF5 ko-represszor komplex gátolja a Cpt1b lipid oxidációs gén és az Ucp2 és Ucp3 fehérjegének szétkapcsolását. (b) PPAR-δ ligandumstimuláció után a KLF5-et SENP1 deszumilálja, lehetővé téve a ko-represszorok csereaktivátorok cseréjét. (c) A KLF deszumilálása indukálja a KLF5 és a PPAR-5 kölcsönhatását, lehetővé téve a Cpt1b, Ucp2 és Ucp3 transzkripció indukcióját
9.1. Táblázat
A szumojiláció szerepe az anyagcserében a transzkripciós faktorok aktivitásának szabályozásán keresztül
A nukleáris receptor peroxiszóma proliferátorral aktivált a-receptor (PPARa) magasan expresszálódik a magas zsírsavkatabolikus aktivitású szövetekben, mint például a vázizom, a máj és a barna zsírszövet, a vékonybél, a szív és a vese. Az endogén ligandumok, például az arachidonsav és más többszörösen telítetlen zsírsavak hatására szabályozza a gyulladáscsökkentő választ és az energia homeosztázist (Kersten 2014). Energiahiányos és böjtös körülmények között aktiválódik, és elősegíti a zsírszöveti lipolízisben részt vevő gének expresszióját. A DNS közvetlen megkötésén és a metabolikus gének expressziójának szabályozásán túl a PPAR-k a gyulladással kapcsolatos gének expresszióját is szabályozhatják azáltal, hogy más fehérje-fehérje interakciók révén gátolják más transzkripciós faktorok aktivitását. A PPAR-ek ezt a hatását transzrepressziónak nevezzük. A PPARa-t a SUMO-1 szumoilálja a 185-ös lizinen a csukló régiójában az E2-konjugáló Ubc9 enzim és a SUMO E3-ligáz PIASy aktivitásával (9.1. Táblázat). A PPARα SUMO-1 módosítása az NCoR corepresszor specifikus toborzásához vezet, ami a PPARα transz-aktivitás csökkenését és a PPARα célgének egy részének lefelé történő szabályozását eredményezi (Kim és mtsai 2015c; Pourcet és mtsai 2010).
9.5.2 SUMO inzulinszintézisben és szekrécióban
9.5.3. SUMO a glükóztranszportban és anyagcserében
9.5.4. SUMO mitokondriális biogenezisben és anyagcsere-betegségben
A mitokondriumok működése, beleértve az oxidatív kapacitást és az oxidatív foszforiláció sebességét, a csontvázizomzatban csökkent az anyagcsere-betegség alatt (Aon et al. 2014; Civitarese és Ravussin 2008). A II. Típusú cukorbetegség, az elhízás és az inzulinrezisztencia rendellenes mitokondriális morfológiával, csökkent funkcióval és a mitokondriumok összességében csökkent számával társul (Goodpaster 2013; Kelley és mtsai 2002; Koves és mtsai 2008). A sejtszintű oxidatív kapacitás csökkenése máj steatosishoz vezet, ami viszont növeli a máj glükóztermelését és a hiperglikémiát (Anderson és mtsai 2009; Sonoda és mtsai 2007). A mitokondrium dinamikus organellák, amelyek folyamatosan hasadási és fúziós eseményeken mennek keresztül, reagálva a sejtanyagcsere változásaira. A mitokondriumok fúzióját olyan mechanizmusnak javasolták, amely révén az ép mitokondriumok képesek helyreállítani a sérült, depolarizált mitokondrium aktivitását az anyagcsere hatékonyságának fenntartása érdekében (Mishra és Chan 2014; Twig és mtsai 2008). Másrészt a mitokondriális biogenezist stimulálják a mitokondrium károsodására reagálva, de akkor is, ha az ATP követelmények megnövekszenek (Frazier et al. 2006; Toyama et al. 2016). A túlzott mitokondriális hasadás apoptózist okozhat (Bueler 2010). Ezért a hasadási és fúziós események szabályozása elengedhetetlen a mitokondriumok száma és minősége közötti megfelelő egyensúly elérésének biztosításához a sejtanyagcsere igényeinek megfelelően és/vagy az anyagcsere és az oxidációs képesség fenntartása érdekében.
9.6 SUMO- és Folát-mediált egyszénű anyagcsere
A folát egy B-vitamin, amely metabolikus kofaktorként funkcionál a sejtben, amely egyetlen szénatomot hordoz és kémiailag aktivál, mint három különböző oxidációs állapot a folát által közvetített egyszénes anyagcseréhez (Fox és Stover 2009). Az egy szénatomú anyagcsere egy metabolikus hálózat, amely három egymással összekapcsolt bioszintetikus útból áll: a purinok de novo szintéziséből, a de novo timidilát bioszintézisből és a homocisztein remetilezéséből metioninná (Fox and Stover 2009). A metionin ezt követően adenozilezhető S-adenozil-metioninná, amely kofaktorként szolgál a sejt számos sejtes metilációs reakciójában, ideértve a kromatin-metilezést is (9.3. Ábra) (Fox és Stover 2009). A folát-anyagcsere zavarai számos patológiával és fejlődési rendellenességgel társulnak, ideértve a rákot, a szív- és érrendszeri betegségeket, az idegcső hibáit és a szájpadhasadékot, bár a mechanizmusokat még ki kell alakítani (Stover 2004).
A folát által közvetített egy szénatom metabolizmusának felosztása a citoplazmában, a mitokondriumokban és a magban. A citoplazmában lévő egy szénatom anyagcserére van szükség a purinok és timidilátok de novo szintéziséhez, valamint a homocisztein metioninná történő újrametilezéséhez. Az egy szénatom anyagcseréje a magban szintetizálja a dTMP-t a dUMP-ból és a szerinből. AICARTfázis, aminoimidazol-4-karboxamid ribonukleotid transzferáz; DHFR, dihidrofolát-reduktáz; GARTfázis, 10-formil-tetrahidrofolát: 5'-foszforibozil-glicinamid-N-formil-transzferáz; MTHFD1, metilén-tetrahidrofolát-dehidrogenáz; NADPH, nikotinamid-adenin-dinukleotid-foszfát; SHMT1, citoplazmatikus szerin-hidroxi-metil-transzferáz; TYMS, timidilát-szintáz; THF, tetrahidrofolát
A folát által közvetített egy szénatomú anyagcsere ismert, hogy a sejtben rekontementálódik; sejtes folátok találhatók a citoplazmában, a mitokondriumokban és a sejtmagban (Shin és mtsai. 1976). A mitokondriumok egyszéneket képeznek formiát formájában a szerin és a glicin aminosavak katabolizmusából. A mitokondriumban kapott formiátus a citoplazmába jut, hogy támogassa az egy szén-dioxid-transzfer reakciókat ebben a térben (Fox és Stover 2009).
A sejtben a foláttal aktivált egyszén koncentrációja korlátozó a folátfüggő enzimek koncentrációjához viszonyítva, ami azt jelzi, hogy a folátfüggő bioszintetikus utak versenyeznek a folát-kofaktorok korlátozó készletéért (Stover és Field 2011). Ez a versengés a timidilát- és metionin-bioszintézis útvonalakra nézve a legmarkánsabb, amelyek a metilén-tetrahidrofolát korlátozó készletéért versengenek (Herbig és mtsai. 2002), amelyet a metilén-tetrahidrofolát-dehidrogenáz 1 (MTHFD1) által katalizált 10-formil-tetrahidrofolát redukciója eredményez (MTHFD1). 9.3) (Field et al. 2014, 2015, 2016).
Az SHMT1 kölcsönhatásba lép számos nukleáris és magpórusokkal társított fehérjével, beleértve az Ubc9-et, a RanBP9-et és a PCNA-t. SHMT1. Az SHMT1 szumoilezés elengedhetetlen a maggal való rekeszmentálódáshoz; A K38R/K39R SHMT1 mutánsok nem szubsztrátjai az Ubc9 által közvetített szamoilezésnek, és ezek az SHMT1 mutáns fehérjék nem lokalizálódnak a magban az S-fázis során (Woeller és mtsai 2007). Továbbá egy közös SHMT1 variáns, az L474F megváltoztatja az SHMTI-Ubc9 kötési felületet. Az SHMTI L474F fehérje nem hatékony szubsztrátja az Ubc9 szumoilezésének, és nukleáris lokalizációja károsodott. Az SHMT1 sejtmag lokalizációja a G-fehérje Ran-tól függ; egy domináns negatív RanT24N expressziója szintén rontja az SHMT1 felhalmozódását a magban.
A timidilát bioszintézis út SUMO-függő szétválasztása a magban a metilén-tetrahidrofolát előnyös megoszlását jelenti a de novo timidilát bioszintézis felé. Ha a DNS károsodik, számos DNS-helyreállító mechanizmus megköveteli a dNTP-szintézist (Mathews 2015). A tenyésztett sejtek ultraibolya sugárzásnak való kitétele indukálja a timidilát bioszintézis útjának SHMT1 szumoilációját és mag lokalizációját, a nukleáris timidilát szintézis károsodása pedig érzékenyíti a sejteket az UV által kiváltott sejthalálra (Fox és mtsai 2009; Fox és Stover 2009). A de novo timidilát szintézis egyedülálló a többi nukleotid bioszintetikus útvonallal szemben, amelyekről feltételezik, hogy a citoplazmában fordulnak elő, kivéve a DNS károsodásának szintézisét (Mathews 2015). A nukleáris timidilát-bioszintézis az uracil DNS-ben való inkorporációjának korlátozását szolgálja, és ezáltal elősegíti a genom stabilitását (Field et al. 2014, 2015, 2016; MacFarlane et al. 2008, 2011a, b).
9.7 Következtetések
- A SUMO szerepe a metabolikus szabályozásban SpringerLink
- A miR-149-5pFGF21 tengely szabályozása révén a húgysav indukálta a májsejtek lipidfelhalmozódását
- A metabolikus szindróma globális járványa
- Pajzsmirigy hormonok és a metabolikus szindróma - FullText - European Thyroid Journal 2013, Vol
- A gyulladásos szindróma A zsírszöveti citokinek szerepe az anyagcserezavarokban