A miR-149-5p/FGF21 tengely szabályozása révén a húgysav indukálta a májsejtek lipidfelhalmozódását
Absztrakt
Háttér
A hiperurikémia az alkoholmentes zsírmájbetegségek egyik fő kockázata. Ennek a jelenségnek a mechanizmusait azonban nem teljesen értik. Ennek a tanulmánynak a célja annak megvizsgálása volt, hogy a mikroRNS-ek közvetítik-e a húgysav kórokozó hatásait az alkoholmentes zsírmáj betegségre.
Mód
Microarray-t használtunk a mi miRNS expressziós profiljának meghatározásához hím C57BL/6 egereknél, akiket standard chow-étrenddel, magas zsírtartalmú étrenddel (HFD) és HFD-vel tápláltak, és húgysavat csökkentő terápiával kombinálták allopurinollal. Igazoltuk a legjelentősebb, differenciálisan expresszált mikroRNS expresszióját, és feltártuk annak szerepét és downstream célját a húgysav által indukált hepatociták lipid felhalmozódásában.
Eredmények
A microarray elemzés és az azt követő validálás azt mutatta, hogy a miR-149-5p szignifikánsan felfelé szabályozott volt a HFD-vel táplált egerek májában, míg az expressziót az allopurinol terápia csökkentette. A miR-149-5p expressziója szignifikánsan jobban szabályozott a húgysavval stimulált hepatocitákban is. A miR-149-5p túlzott expressziója szignifikánsan aggregálta a húgysav által kiváltott triglicerid felhalmozódást a hepatocitákban, míg a miR-149-5p gátlása enyhítette a triglicerid felhalmozódását. A Luciferase jelentés vizsgálata megerősítette, hogy az FGF21 a miR-149-5p célgénje. Az FGF21 elhallgattatása megszüntette a miR-149-5p inhibitornak a húgysav által indukált hepatociták lipidfelhalmozódását enyhítő hatásait, míg az FGF21 túlzott expressziója megakadályozta a miR-149-5p utánzások által kiváltott lipid felhalmozódást.
Következtetések
A húgysav szignifikánsan szabályozta a miR-149-5p expresszióját a hepatocitákban, és a miR-149-5p/FGF21 tengely szabályozásával indukálta a májsejtek lipidfelhalmozódását.
Háttér
A nem alkoholos zsírmájbetegség (NAFLD) a májbetegségek egy csoportja, amelyet a máj túlzott lipidfelhalmozódása jellemez, túlzott alkoholfogyasztás nélkül [1]. Ez az egyszerű steatosistól a steatohepatitisig, a fibrózisig, a cirrhosisig és végül a máj karcinómáig terjed [2]. A NAFLD a leggyakoribb krónikus májbetegség világszerte, a NAFLD előfordulása Ázsiában növekszik, és Kínában gyakorisága 2019-ben gyorsan 29,2% -ra emelkedett [3, 4]. A NAFLD szorosan kapcsolódik az elhízáshoz, a 2-es típusú diabetes mellitushoz és a szív- és érrendszeri betegségekhez, amelyek világszerte súlyos közegészségügyi problémákhoz vezetnek [5,6,7]. Az elmúlt évtizedek intenzív vizsgálata ellenére a NAFLD pontos patogenezise még mindig kevéssé ismert.
A húgysav a purin metabolizmusának végső enzimatikus terméke. Korábban azonosítottuk, hogy a magas szérum húgysavszint a NAFLD egyik fő kockázati tényezője [8, 9], és a húgysav indukálta a máj lipidfelhalmozódását az NLRP3 gyulladás aktiválásával [10]. A húgysav a máj lipid felhalmozódását is indukálhatja endoplazmatikus retikulum stressz és mitokondriális oxidatív stressz kiváltásával [11, 12]. Bár egyre nagyobb kutatások jelentek meg annak a mechanizmusnak a feltárására, amely révén a húgysav indukálja a máj lipidfelhalmozódását, a mögöttes molekuláris mechanizmusok még nem teljesen tisztázottak. A mechanizmusok jobb megismerése segíthet a NAFLD új terápiás stratégiájának kidolgozásában.
Az allopurinolt, a xotin-oxidáz (XO) prototípus gátlót több évtizede a köszvény vagy a hiperurikémia klinikai kezelésének sarokkövének tekintik [20]. Az előző tanulmányban azt is megállapítottuk, hogy a szérum húgysavszint allopurinollal történő csökkentése jelentősen enyhítette az egerekben a HFD által kiváltott máj steatózist [10]. Ebben a tanulmányban az allopurinol-terápiával vagy anélkül kezelt HFD-vel táplált egerek máj miRNS expressziós profiljának feltárását tűztük ki célul. Megállapítottuk, hogy a miR-149-5p részt vesz a húgysav hepatociták lipidfelhalmozódására gyakorolt hatásában az FGF21 célgén szabályozása révén.
Mód
Állatok és kezelések
8-10 hetes, 18–20 g tömegű hím C57BL/6 egereket vásároltak a Zhejiang tartomány Orvostudományi Intézetéből (Hangzhou, Kína). A kísérlet előtt az egereket 1-2 hétig hagyták akklimatizálódni, hogy hozzáférjenek az élelemhez és a vízhez. Az egereket véletlenszerűen 3 csoportba osztottuk, beleértve csoportonként 6 állatot, és standard chow-étrenddel (SCD), HFD-vel vagy HFD-vel etettük allopurinollal (120 mg/l) kombinálva az ivóvízben (HFD + A) 8 héten keresztül. . A HFD (D12492, Research Diets, New Brunswick, NJ) 60% kcal-t tartalmaz zsírból, 20% szénhidrátból és 20% fehérjét. Az egereket 12 órás világos/sötét ciklusban tartottuk szabályozott szobahőmérsékleten, és szabad hozzáférést kaptunk az élelemhez és a vízhez.
5% klór-hidrát intraperitoneális injekciója után az egereket méhnyak diszlokációval leöltük. Minden egér máját eltávolítottuk és megmérettettük. Hideg PBS-sel történő öblítés után a máj tartalmát semleges pufferolt formalinban rögzítettük. Az összes állatkísérletet a Zhejiang Egyetem Orvostudományi Főiskolájának Első Társult Kórházának Állatgondozási és Felhasználási Bizottsága hagyta jóvá (hivatkozási szám: 2019–1096).
Szövettani elemzés
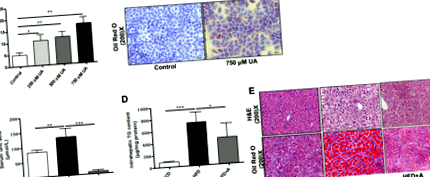
A májszakaszokat egy éjszakán át semleges pufferelt formalinban rögzítettük, majd paraffin blokkokba ágyazottuk. A metszeteket kivágtuk és megfestettük a hematoxilin és az eozin (H & E) szempontjából. A máj lipidfelhalmozódásának meghatározásához 8 μm-es fagyasztott májszakaszokat festettünk egymás után Oil Red O-val és hematoxilinnel (Jiancheng Biology, Nanjing, Kína). Az üvegborító hajókban 12 lyukú lemezeken növesztett sejteket PBS-sel mostuk, majd olajvörös O-val és hematoxilinnel festettük. A metszeteket 200-szoros nagyítással készítettük (Olympus, Tokió, Japán).
Sejtkultúra és húgysavkezelés
Az egér májsejt sejtvonalat (AML-12) és humán hepatoblastoma sejtvonalat (HepG2) a Kínai Tudományos Akadémiától (Sanghaj, Kína) szereztük be. Az AML-12 sejteket 10% FBS-sel és 1% penicillinnel/sztreptomicinnel, ITS Liquid Media Supplement-tel és Dexametazonnal (40 μg/ml) kiegészített DMEM/F12 táptalajban növesztettük. A HepG2 sejteket 10% FBS-sel és 1% penicillin/sztreptomicinnel kiegészített DMEM tápközegben tenyésztettük. A sejteket 37 ° C-on inkubáltuk 5% CO2-ban. A húgysav-stimulált sejtmodellek megállapításához az AML-12 és HepG2 sejteket 48 órán keresztül különböző koncentrációjú húgysavval (250, 500 és 750 μmol/l) kezeltük.
miRNS tömb
A teljes RNS-t izoláltuk és az RNS integritását Agilent Bioanalyzer 2100 (Agilent Technologies, Santa Clara, CA) alkalmazásával értékeltük. A teljes RNS-t átírjuk kettős szálú cDNS-be, majd szintetizáljuk cRNS-be, és cianin-3-CTP-vel jelöljük. A jelölt cRNS-eket először hibridizáltuk a mikrorayára, amelyeket az Agilent Scanner G2505C (Agilent Technologies) szkennelt. A tömb képeket elemeztük, hogy nyers adatokat kapjunk a funkciókivonó szoftver használatával (10.7.1.1 verzió, Agilent Technologies). A nyers adatok alapelemzéséhez a Genespringet (14.8 verzió, Agilent Technologies) végeztük. A nyers adatokat a kvantilis algoritmussal normalizáltuk. A fel és le szabályozott gének küszöbértéke ≥1,5-szeres változás volt.
Sejttranszfekció
Az Mmu/hsa-miR-149-5p inhibitor (100 nM), az mmu/hsa-miR-149-5p (50 nM) és ezeknek megfelelő negatív kontrollokat a RiboBio-tól (Guangzhou, Kína) szereztük be. Az egér vagy humán FGF21 siRNS oligonukleotidjait és túl expressziós plazmidjait, valamint azok megfelelő negatív kontrolljait szintén a RiboBio-tól kaptuk. A miRNS-eket, siRNS-eket és plazmidokat hepatocitákba transzfektáltuk Lipofectamine3000 (Invitrogen, Carlsbad, CA) alkalmazásával, a gyártó utasításainak megfelelően. 24 órás transzfekció után a hepatocitákat további 48 órán át húgysavnak tették ki.
RNS izolálás és valós idejű PCR
A teljes RNS-t sejtekből vagy fagyasztott májból állítottuk elő RNS plus alkalmazásával (Takara, Dalian, Kína). A 2,5 μg teljes RNS-t fordítottan írták át One Step PrimeScript ™ RT-PCR készlettel (Takara). A valós idejű PCR-analízist a SYBR Premix-Ex Tag Kit (Takara) felhasználásával végeztük ABI prism 7500 szekvencia detektáló rendszeren (Applied Biosystems, Foster City, CA). A primer szekvenciákat az S1 táblázat tartalmazza.
Western blot elemzés
A sejteket és a májszöveteket proteázzal és foszfatáz inhibitorral (Pierce Biotechnology, Rockford, IL) kiegészített RIPA puffer (Applygen Technologies Inc., Peking, Kína) alkalmazásával homogenizáltuk. Egyenlő mennyiségű fehérjét 12% SDS-PAGE-nak vetünk alá, majd a PVDF membránokra (Millipore, Inc., Darmstadt, Németország) való transzfer. A membránokat 5% zsírmentes száraz tejjel blokkoltuk TBST-ben, majd egy éjszakán át inkubáltuk a következő primer antitestekkel: anti-FGF21 (Abcam, ab17194, 1: 1000), anti-β-aktin (CST, 3700 s, 1: 1000). A csavarokat tovább HRP-vel konjugált másodlagos antitestekkel inkubáltuk: kecske anti-nyúl (Sigma, sc-2004) vagy kecske anti-egér (Sigma, sc-2005). A fehérjéket ECL plusz segítségével vizualizálták (Fudebio, Hangzhou, Kína).
Triglicerid elemzés
Az intrahepatikus és intracelluláris trigliceridtartalmat kereskedelmi készlet (Applygen Technologies Inc., Peking, Kína) segítségével detektáltuk a gyártó utasításai szerint. A triglicerid értékeket az összes fehérjetartalom alapján normalizáltuk.
Luciferáz-vizsgálat
A luciferáz riporter elvégzéséhez vad típusú vagy mutált 3’UTR szekvenciát tartalmazó plazmidokat állítottunk elő (Hanyin, Shanghai, Kína). A plazmidokat HEK293T sejtekbe transzfektáltuk Lipofectamine 3000 (Invitrogen, Carlsbad, CA) alkalmazásával. A sejteket együtt transzfektáltuk vagy a negatív kontroll, vagy a miR-149-5p utánzattal (50 nM). 24 órás transzfekció után a sejteket a gyártó utasításai szerint gyűjtöttük (Promega Dual Luciferase Assay Kit, Promega). A Firefly luciferáz értékeket normalizáltuk a Renilla luciferase értékéhez.
statisztikai elemzések
A statisztikai elemzéseket az SPSS 18.0 for Windows (SPSS, Chicago, IL) alkalmazásával végeztük. Statisztikai összehasonlításokat végeztünk t-teszt vagy ANOVA adott esetben. Az összes adatot átlag ± standard osztásként (SD) fejeztük ki, statisztikailag szignifikáns különbséget a következőképpen határoztuk meg: P
Eredmények
A húgysav lipid felhalmozódást indukál a májsejtekben
Differenciálisan expresszált miRNS HFD és HFD + A táplált egerekben
Mikrosarkúakat alkalmaztunk a húgysav máj miRNS expressziójára gyakorolt hatásának feltárására SCD-vel, HFD-vel és HFD + A-val etetett egerekben. Megállapítottuk, hogy 47 miRNS-t expresszáltak legalább 1,5-szeresen a HFD és SCD csoportok között, beleértve 28 down- szabályozott és 19 felfelé szabályozott miRNS. Ezenkívül 26 miRNS-t expresszáltak legalább 1,5-szeresen a HFD + A csoportban a HFD csoportokhoz képest, beleértve 5 lefelé szabályozott és 21 felfelé szabályozott miRNS-t. Először azonosítottuk, hogy 12 miRNS egyaránt differenciáltan expresszálódik HFD vs SCD, és HFD + A vs HFD között (2a ábra, S2 táblázat), jelezve, hogy ezek a 12 miRNS egyaránt szerepet játszhatnak a magas húgysav által kiváltott máj steatosis előrehaladásában és a húgysavval enyhített máj steatosis csökkentése.
Valós idejű PCR-t hajtottak végre a differenciálisan expresszált miRNS-ek expressziójának megerősítésére. A miRNS tömb elemzésével összhangban azt tapasztaltuk, hogy a miR-149-5p expressziója kb. 2,5-szeres mértékben volt felfelé szabályozva a HFD-vel táplált egerek májjában az SCD-vel táplált egerekhez képest, míg az expresszió kb. % HFD + A egerekben a HFD-vel táplált egerekhez képest (2b. ábra). Azt is tapasztaltuk, hogy a miR-149-5p szignifikánsan kb. 1,5-szeresen volt szabályozva az 500 μmol/l és 750 μmol/l húgysavnak kitett AML-12 sejtekben 48 órán keresztül (2c. Ábra). Hasonló eredményeket figyeltünk meg a HepG2 sejtekben (S2. Ábra). Ezek az eredmények azt mutatták, hogy a miR-149-5p összefüggésbe hozható a húgysav által indukált hepatociták lipid felhalmozódásával.
A miR-149-5p hatása a májsejtek lipidfelhalmozódására
Annak igazolására, hogy a miR-149-5p közvetíti-e a húgysav szabályozó hatását a hepatociták lipidfelhalmozódására, elemeztük-e a miR-149-5p funkcióvesztését vagy növekedését a húgysavval stimulált hepatocitákon. A miR-149-5p-t túl expresszáltuk AML-12 sejtekben miR-149-5p utánzó transzfekciójával (3a. ábra). Megállapítottuk, hogy a miR-149-5p túlzott expressziója szignifikánsan aggregált húgysav-indukálta intracelluláris triglicerid felhalmozódást AML-12 sejtekben (3b. Ábra). Másrészt a miR-149-5p expressziójának gátlása miR-149-5p inhibitor által jelentősen javította a húgysav által kiváltott triglicerid felhalmozódást az AML-12 sejtekben (3c. És d. Ábra). A májsejtek olajvörös O-festése megerősíti a megváltozott sejten belüli lipidfelhalmozódást (3e. Ábra). Hasonló eredményeket figyeltek meg a húgysavval stimulált HepG2 sejtekben, amelyeket miR-149-5p utánzattal vagy inhibitorral kezeltek (S3. Ábra). Ezek az eredmények azt sugallják, hogy a miR-149-5p részt vett a húgysav szabályozó hatásában a májsejtek lipidfelhalmozódására.
Az FGF21 a miR-149-5p célgénje, amely részt vesz a húgysav által indukált hepatociták lipidfelhalmozódásában.
A miRwalk predikciós adatbázis keresésével megállapítottuk, hogy az FGF21-et a miR-149-5p célgénjének jósolták. Az FGF21 egy jól ismert fehérje, amely kulcsszerepet játszik a lipid anyagcserében [21, 22]. Annak megállapítására, hogy az FGF21 miR-149-5p célgénje volt-e, renilla-luciferáz riporter plazmidokat készítettünk úgy, hogy az emberi FGF21 belsejébe becsült miR-149-5p kötőhelyeket inszertáltunk (4a. Ábra). A miR-149-5p utánzó együtt transzfekciója az FGF21 WT 3’UTR-től származó luciferáz aktivitás 30% -os csökkenését eredményezte 293 T sejtben (4b. Ábra). Az előrejelzett kötőhelyek mutációja azonban helyreállította a miR-149-5p felesleg által közvetített luciferáz aktivitások veszteségét (4b. Ábra). Sőt, azt is megvizsgáljuk, hogy a miR-149-5p szabályozza-e endogén módon az FGF21-et. Megállapítottuk, hogy miR-149-5p utánzattal történő transzfektálás jelentősen elnyomta az FGF21 fehérje szintjét az AML-12 sejtekben (4c. Ábra). A húgysavstimuláció elnyomta az FGF21 fehérje szintjét az AML-12 sejtekben, míg a miR-149-5p inhibitor helyreállította az FGF21 expresszióját húgysavval stimulált hepatocitákban (4d. Ábra). Hasonló eredményeket figyeltek meg a húgysavval stimulált HepG2 sejtekben (S4a és b ábra). Ezek az eredmények azt sugallják, hogy a miR-149-5p cél a transzláció gátlásán keresztül szabályozza az FGF21-et.
Továbbá FGF21 siRNS-t és túlexpressziós plazmidokat alkalmaztunk az FGF21 májsejtekben történő lipidfelhalmozódásra gyakorolt hatásának meghatározására. Megállapítottuk, hogy az FGF21 elhallgattatása megszüntette a miR-149-5p inhibitor javító hatását a húgysav által indukált triglicerid hepatocitákban történő felhalmozódására (4e. Ábra). Éppen ellenkezőleg, az FGF21 túlzott expressziója jelentősen megakadályozta a miR-149-5p utánzással kiváltott triglicerid felhalmozódást az AML-12 sejtekben (4f. Ábra). Hasonló eredményeket figyeltünk meg az FGF21 siRNS-sel és a túlexpressziós plazmidokkal kezelt HepG2 sejtekben (S4c és d ábra). Ezek az eredmények arra utalnak, hogy az FGF21 a miR-149-5p downstream célpontja, és közvetíti a húgysav szabályozó hatásait a hepatociták lipidfelhalmozódására.
Vita
Ebben a tanulmányban új bizonyítékokat szolgáltatunk arra vonatkozóan, hogy a húgysav által indukált hepatociták lipidfelhalmozódása a miR-149-5p/FGF21 függő mechanizmus révén. Először is, a húgysavstimuláció szignifikánsan felfelé szabályozta a miR-149-5p expresszióját a hepatocytákban, míg a húgysav csökkentése az allopurinol hatására jelentősen lefelé szabályozta a máj miR-149-5p expresszióját HFD-vel táplált egerekben. Másodszor, a funkcióvesztés vagy a funkciógyarapodás tanulmányai azt találták, hogy a miR-149-5p felelős a húgysav hepatociták lipidfelhalmozódására gyakorolt patogén hatásáért. Harmadszor megerősítettük, hogy az FGF21 a miR-149-5p downstream célpontja, és az FGF21 közvetítette a húgysav szabályozó hatását a hepatociták lipidfelhalmozódására.
Korábbi vizsgálataink kimutatták, hogy a SUA szintje szignifikánsan emelkedett a NAFLD betegeknél, és hogy az emelkedett SUA szint az NAFLD incidensek fokozott kockázatával jár [9, 23]. Más nagy populáció-alapú kohorsz vizsgálatok azt is kimutatták, hogy a magas SUA-szint pozitívan összefügg a NAFLD kockázatával [24, 25]. Szövettani vizsgálatok kimutatták, hogy a SUA szint szignifikánsan összefüggött a NAFLD szövettani betegségének súlyosságával [26,27,28]. Ezenkívül az allopurinollal végzett húgysavcsökkentő kezelés jelentősen enyhítette a HFD által kiváltott máj steatózist a NAFLD állatmodelljében [29]. Ezek a tanulmányok azt sugallták, hogy a magas húgysav okozhatja a NAFLD kialakulását, miközben mögöttes molekuláris mechanizmusa továbbra sem tisztázott.
A MiRNA-t kulcsfontosságú szabályozóként vonják be az anyagcsere-betegségekbe azáltal, hogy a transzkripció utáni szinten elhallgattatják a géneket. Egyre több bizonyíték bizonyította, hogy a miRNS-ek, mint például a miR-122, a miR-378 és a miR-34a, nagy számban vesznek részt a NAFLD patogenezisében [30, 31]. Az azonban nem világos, hogy a miRNS-ek részt vesznek-e a húgysav által kiváltott hepatociták lipidfelhalmozódásában. Ebben a tanulmányban az allopurinol-terápiával vagy anélkül kezelt HFD-vel táplált egerek máj miRNS expressziós profiljának feltárását tűztük ki célul. Ebben a tanulmányban a HFD-re reagálva megváltozott miRNS-profilokat elemeztük, és a HFD-t alacsonyabb húgysav-terápiával kombinálva. Megállapítottuk, hogy 47 miRNS-t expresszáltak differenciáltan a HFD és SCD csoportok között, köztük 19 felfelé szabályozott miRNS-t és 28 lefelé szabályozott miRNS-t. Ez a megállapítás részben összhangban áll az ob/ob egereknél [17, 32], MCD-vel táplált egerekkel [33] és NASH-betegeknél korábban megfigyeltekkel [34]. Vizsgálatunk megerősítette, hogy a miRNS-ek részt vesznek az NFALD patogenezisében.
Ezenkívül feltártuk a miR-149-5p down-stream mechanizmusát a hepatociták lipidfelhalmozódásán. Az FGF21 az endokrin FGF család tagja, főleg a májban és a zsírszövetben expresszálódik és szekretálódik. Az FGF21 a lipid- és glükóz-anyagcsere fontos szabályozója, és kulcsszerepet játszik a NAFLD fejlődésében [39, 40]. Néhány klinikai tanulmány arról számolt be, hogy a szérum FGF21 szintje megemelkedik a NAFLD betegeknél, és a NAFLD prediktorának tekintik [41]. A legújabb tanulmányok azonban különböző eredményeket jelentettek, amelyek az FGF21 hiánya miatt májsteatózist okoztak [42], és az FGF21 túlzott expressziója képes volt javítani a májzsír felhalmozódását [43]. Vizsgálatunkban megerősítettük, hogy az FGF21 a miR-149-5p downstream célpontja a húgysav által indukált hepatociták lipidfelhalmozódásának folyamatában. Eredményeink a húgysav által indukált hepatociták lipidfelhalmozódásának új mechanizmusát javasolják.
Ebben a tanulmányban számos korlátozás volt. Először is, a miRNS funkciója és szabályozása összetett, az FGF21 nem lehet az egyetlen, és a fő célgént húgysav szabályozza, további vizsgálatokra van szükség a miR-149-5p részletes downstream mechanizmusainak tisztázása érdekében a húgysav által indukált máj steatosisban . Másodszor, bár in vitro sejtvonal eredményeink egyértelműen azt mutatták, hogy a húgysav miR-149-5p/FGF21 függő mechanizmuson keresztül szabályozza a hepatocita lipidfelhalmozódását, elsődleges hepatocita kísérletekre és in vivo kísérletekre van szükség a szabályozó mechanizmusok további megerősítéséhez.
Következtetések
Összefoglalva, tanulmányunk először bizonyítékot szolgáltatott arra vonatkozóan, hogy a húgysav miR-149-5p/FGF21 függő mechanizmus révén indukálta a májsejtek lipidfelhalmozódását.
- Húgysav - áttekintés a ScienceDirect témákról
- Húgysav a Blood Kaiser Permanente-ben
- A húgysav egészségügyi témái
- Húgysav, Blood Davis s Lab; Diagnosztikai tesztek
- Tippek a köszvényre és a magas húgysavszintre Nestlé Wellness