A szénhidrátok korlátozása a fej- és nyakrák elleni küzdelemre - ez reális?
Absztrakt
Bevezetés
A fej- és nyakrák (HNC) az ajak, a száj és az orrüreg, az orrmelléküregek, a garat, a gége és a légcső eredetű rákos megbetegedések gyűjtőfogalma. A HNC-k körülbelül 90% -a fej- és nyaki laphámsejt (HNSCC), amely ezen régiók nyálkahártyájából (hámból) származik.
A legtöbb agresszív daganathoz hasonlóan a HNC-k is magas arányú glikolízis-függőséget mutatnak metabolikus igényeik kielégítése érdekében8, 9. Ezért indokolták, hogy a szénhidrátokban (CHO) korlátozott étrend az ilyen glikolitikus daganatok megváltozott anyagcseréjét célozhatja meg10, 11. Bizonyos bizonyítékok vannak arra, hogy a ketogén diéta (KD), a magas zsírtartalmú alacsony CHO diéta, amely a keringő ketontestek mM tartományba emelkedéséhez vezet, nemcsak károsíthatja a tumorsejtek anyagcseréjét és növekedését, hanem küzdhet a cachexia és a terápia ellen is által kiváltott mellékhatások12 - 14.
Ebben az áttekintésben a CHO-korlátozott és a KD-k HNC-betegekben történő megvalósításának három fő okát fogom bemutatni. Röviden: ezek (1) a megváltozott tumorsejt-anyagcserét célozzák meg; (2) a rosszindulatú sejtek rádió- és kemoszenzitivitásának növelése a normál sejtek védelme mellett; (3) a daganatot hordozó gazdaszervezet megváltozott anyagcseréje. A táplálékfelvétellel kapcsolatos különféle problémák miatt továbbra is kérdés, hogy megvalósítható-e a CHO korlátozása a HNC betegeknél. A cikk utolsó részében ezért egy ilyen étrendi beavatkozás sajátos szempontjaival és gyakorlati kérdéseivel foglalkozom.
A HNC-k édesszájú
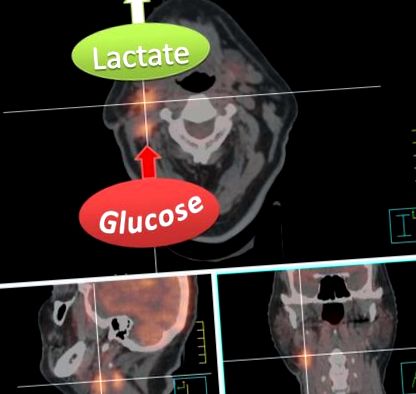
A HNC ismertetőjegye, mint általában a legtöbb rák, a magas glükózfelvétel iránti kedvük. Otto Warburg és munkatársai a volt berlini Kaiser Wilhelm Biológiai Intézetben elsőként számszerűsítették a glükózfelvételt és az energiatermelést sokféle állati és emberi daganatban15 - 19. Warburg mind in vivo, mind in vitro mérések segítségével kimutatta, hogy a normális szövetekhez képest a daganatok többször több glükózt vesznek fel a környezetből, és annak nagy részét laktáttá fermentálják még elegendő oxigén jelenlétében is, amely normálisan elnyomja a laktáttermelést. A megnövekedett glükózfelvétel és laktáttermelés ezen metabolikus fenotípusát ezért Warburg-hatásnak vagy aerob glikolízisnek nevezik, mivel normoxikus körülmények között is előfordul.
A sugárterápiát tervező CT és FDG-PET vizsgálat fúziós képe primer jobb oldali cT1 cN2b tonsillaris laphámrákos beteg mandulaműtét után. A jobb nyirokcsomó-konglomerátumok magas FDG-felvétele erősen glikolitikus metasztázisra utal. Ne feledje azonban, hogy az FDG-PET csak a glükózfelvételt és a glükóz-6-foszfáttá történő átalakulást méri, és ezért nem tehet különbséget a laktáttermelés vagy a glikolízis-intermedierek és a végtermékek táplálása között a pentóz-foszfát útvonalában vagy a citromsav-ciklusban. Az egyéb technikákkal, például mágneses rezonancia spektroszkópiával mérhető magas laktát-felszabadulás azonban szemléltető célokra szolgál, mivel agresszív metasztázis esetén jellemző.
A genetikai és epigenetikai változások elősegítik az aerob glikolízist
Asztal 1
| A funkciómutációk/törlések elvesztése | ||
| TP53 | 50-80 | A p53 elvesztése nukleáris és mitokondriális DNS instabilitásához, megnövekedett oxidatív stresszhez, az OXPHOS csökkenéséhez és a glikolízis felfelé szabályozásához vezet (áttekintve 46, 47) |
| NOTCH1 | 14-15 | A hipoaktív Notch csökkenti a p53 szintet és gyengíti a mitokondriális funkciókat, ami áttérést okoz a glikolízisre és a glükózfüggőségre48 |
| PTEN | 7 | A PTEN ellensúlyozza a glikolízist azáltal, hogy megfordítja a foszfatidil-inozitol1,4-bifoszfát (PIP2) PI3K által közvetített konverzióját foszfatidil-inozitol1,4,5-trifoszfáttá (PIP3), amely az Akt-mTOR jelátvitel aktiválásához szükséges. A PTEN elvesztése ezért fokozza az Akt aktiválódását. A PTEN a glutaminolízist is ellensúlyozza azáltal, hogy PI3K-független útvonalon keresztül csökkenti a glutamináz szintjét49 |
| Funkciómutációk/amplifikációk nyeresége | ||
| PIK3CA | 6-20 | A PIK3CA a p110a-t kódolja, amely az 1A osztályú foszfatidil-inozitol-3-kináz (PI3K) 110 kDa katalitikus alegységének izoformja. A PI3K-Akt-mTOR útvonal az egyik leggyakrabban hiperaktivált jelátviteli kaszkád a tumorsejtekben. A fokozott Akt szignálozás Warburg-fenotípust indukál, és fokozza a glikolízis és a mitokondriális citromsav-ciklus kapcsolását, amely intermediereket eredményez a bioszintetikus utakhoz és a NADH-t, mint az OXPHOS elsődleges elektrondonorát (áttekintve 50-ben) |
| HRAS | 4-5 | A HRAS kódolja a kicsi GTPáz H-Ras-t, az enzimek Ras szupercsaládjának egy tagját, amelyek a GTP-hez kötődve válnak aktívvá. A sejtek túlélése és szaporodása szempontjából fontos egyéb utak mellett a Ras-GTP közvetlenül aktiválja a PI3K p110-et. Az onkogén H-Ras aktiváció csökkenti a mitokondriális légzést, a transzformált sejteket a glükóz és a glikolízis függvényében alakítják |
A HNC sejtek sebezhetősége a CHO restrikcióval szemben
2. táblázat
| Magas vércukorszint (glikolitikus enzimek felső szabályozása) | Vércukorszint ↓, zsírsavak ↑ (A zsírsavak gátolják a legfontosabb glikolitikus enzimeket) |
| Hypoxia | Vércukorszint ↓, ketonok ↑ (Gyenge tápanyagellátás a hipoxiás sejtekben; hipoxiás sejtek nem képesek hatékonyan oxidálni a ketonokat) |
| Onkogén jelátvitel (inzulin/IGF-1 - PI3K - Akt - mTOR) | Vércukorszint ↓, inzulin ↓ (ellensúlyozza a PI3K útvonalat; aktiválja az AMPK-t is, gátolva az mTOR-t) |
| Ketonok ↑ (I. és II. Osztályú HDAC inhibitorok) | |
| Gyulladás (A magas vércukorszint és a ROS elősegíti a gyulladásos citokin felszabadulást) | Vércukorszint ↓ (csökkenti a ROS-t és a gyulladást) |
A CHO-korlátozás csökkenti a glikolízist
A CHO korlátozása különösen problémás a hipoxiás sejtek esetében
A hipoxia szerepe a glikolitikus enzimek és a glükóz sejtekbe jutásának szabályozásában jól megalapozott. Warburg már tisztában volt a tumorszövet gyenge kapilláris hálózatával, és feltételezte, hogy a daganatok rosszabb „ellátási csatornáik” miatt kiszolgáltatottabbak az egyidejű glükóz- és oxigénhiánynak 19. Elvileg a vércukorszint csökkentése teljesen kikapcsolhatja a véredényektől távol eső krónikusan hipoxiás sejteket. Ha a CHO-k elég szigorúan korlátozottak, a máj nagyobb mennyiségű ketontestet is termelni kezd, amelyek kiváló minőségű üzemanyagként szolgálnak a normál szövetek, különösen az agy és az izmok számára92. Bár a HNSCC-s betegeknél végzett mérések azt mutatták, hogy daganataik felveszik a ketontesteket, az abszolút mennyiségek kicsiek voltak, és metabolikus sorsukat nem határozták meg8. Még akkor is, ha a HNSCC rendelkezik a keton testek felhasználásához szükséges enzimekkel - ami sok más daganatsejt esetében nem igaz 93 - 96 -, a ketonok felhasználása oxigént igényel, ezért a tumor nagy részein károsodik40. Így a vércukorszint csökkentése sokkal nehezebb hatással lesz a hipoxiás daganatos sejtekre, mint normális sejtekre, amelyek metabolikusan rugalmasak és ép tápanyagellátó hálózattal rendelkeznek.
A CHO-restrikció gátolja az onkogén jelátvitelt
A CHO-korlátozás képes ellensúlyozni a jelátvitelt a rapamicin foszfatidil-inozitol-3 kináz-Akt-emlős célpontján keresztül (PI3K-Akt-mTOR). Ezt az utat az inzulin és a növekedési faktorok, például az inzulinszerű növekedési faktor-1 (IGF-1) aktiválják, és hatása többek között a glikolízis felfelé szabályozása50, 97. Az IGF jelátviteli hálózat, a tirozin-kináz összetettsége a receptor áthallás, valamint a nem megcélzott receptorok autokrin aktiválása mind rezisztencia mechanizmust biztosítanak a túl specifikus tirozin-kináz inhibitorokkal szemben, amelyek emellett gyakran szisztémás mellékhatásokat váltanak ki 98, 99. Ezzel szemben a CHO korlátozás nem toxikus stratégia ugyanazon molekuláris utak egyidejű megcélzásához. amelyek egyénileg gyógyszeres gyógyszerekkel vannak megcélozva.
Az IGF-1 és a rák közötti összefüggésről ellentmondásos és gyakran negatív eredményekről számoltak be különféle rákos megbetegedések esetén, beleértve a HNC98-at is. Ez az inzulint, a hiperglikémiát és a gyulladást a megalapozott metabolikus szindróma-rák kapcsolat valószínűbb közvetítőjeként hagyja el100. Egy nemrégiben végzett tanulmány kiterjesztette ezt a kapcsolatot a HNC-vel, megmutatva, hogy az elhízás független kockázati tényező a betegség-specifikus halálozáshoz a korai stádiumú orális SCC-től kezdve, amikor a rákkal kapcsolatos súlycsökkenés hatását figyelembe vesszük101. Így a korai stádiumban a HNSCC inzulin gátlása CHO restrikció révén előnyös lehet a tumor glikolízisével és a progresszióval szemben. A CHO korlátozás emeli az AMP kináz (AMPK) aktivitást, amely egy intracelluláris energiaérzékelő. Bár az AMPK aktivációja egyes sejtekben akutan fel tudja szabályozni a glikolízist, hosszabb távon „anti-Warburg” tumor szuppresszorként működik és gátolja az mTOR jelátvitelt102. Az AMPK ezért vonzó rákellenes célpontként jelent meg, amelyet cukorbetegség elleni gyógyszerekkel, például metforminnal próbálnak aktiválni99, 103.
Összefoglalva, a CHO-korlátozás és különösen a KD-k szisztémás hatást gyakorolnak az onkogén jelátviteli utakra, amelyek ellensúlyozzák a tumor glikolízisét, de - az érintett jelátviteli hálózatok bonyolultsága és a HNC-daganatok nagy genetikai heterogenitása miatt - tovább kell vizsgálni.
A CHO korlátozás a gyulladást célozza meg
A gyulladás és a HNSCC kapcsolata nyilvánvalóvá válik egy magyarországi vizsgálatból, amely a szájon át szedett gyulladásos, premalignus és rákos elváltozások gyakoribb előfordulását mutatja a cukorbetegek körében az egészséges kontrollokhoz képest111. Ezek a szerzők azt is megállapították, hogy 14,6% -kal, illetve 9,7% -kal a cukorbetegség prevalenciája és az emelkedett vércukorszint (> 6,1 mmol/L) szignifikánsan magasabb volt 610 orális karcinómás betegnél, mint tumormentes kontrollcsoportban. A magas vércukorszint dózisfüggő módon elősegíti a gyulladásos citokinek és ROS felszabadulását a monocitákból és makrofágokból121, 113; mind a gyulladásos citokinek, mind az ROS a HIF-1α és így a glikolízis aktivátorai. A gyulladás és a magas vércukorszint közötti összefüggés a rákos cachexia szindrómában is megfigyelhető12. Valójában már 1885-ben Ernst Freund 70 rákbetegből 70-ben leírta a hiperglikémia jeleit, ami arra a következtetésre késztette, hogy a rendellenesen magas vércukor-tartalomra szükség lenne egy karcinóma fennállásához114. Ezen a vonalon a hiperglikémia ma már megalapozott előrejelzője a rossz túlélésnek számos rákban115 - 122.
A CHO-korlátozás feltételezett hatása a normális és a tumorszövetre. A sugárterápia során a CHO korlátozás differenciális stresszreakciót válthat ki a normál és a tumorsejtek között, így az előbbi védelmet élvez az ionizáló sugárzással szemben, az utóbbi pedig érzékeny az ionizáló sugárzásra. Ezenkívül a keton testek és a zsírsavak emelkedésével a CHO korlátozás segít megőrizni az izomszövetet.
Kevés kivétellel a normál szövetek könnyen oxidálják a ketontesteket, ezáltal csökkentve a mitokondriális NADP +/NADPH arányt. Ez viszont megnöveli az ROS130 elszívására rendelkezésre álló csökkentett GSH mennyiségét. A ketontesteknek ez az antioxidáns tulajdonsága nem lenne előnyös azoknak a tumorsejteknek, amelyek a szükséges enzimek hiánya miatt nem képesek metabolizálni őket a szükséges 93–96 enzimek vagy a hipoxia40 miatt. Ezzel szemben a ketonok HDAC gátló aktivitása hasznos lehet a HNSCC őssejtekkel szemben, amelyek jellemzően a legmagasabb radiorezisztenciát mutatják109.
A CHO-korlátozás a sugárterápiás frakciók során is ronthatja a tumor újratermelését, és késleltetheti a felgyorsult szaporodást, amelyről ismert, hogy a HNSCC-ben a sugárkezelés során valamikor megindul. Korábban áttekintettük a rengeteg preklinikai adatot, amelyek azt mutatják, hogy a CHO korlátozás önmagában késlelteti a tumor növekedését a különféle tumor modellekben12. Ezeknek a tanulmányoknak a többsége KD-ket tesztelt, és az in vitro adatok azt mutatják, hogy maguk a ketontestek is képesek antiproliferatív hatással lenni egyes tumorsejtekre134, 135. Sajnos a legtöbb humán tanulmány, amely KD-k révén értékeli a növekedés gátlását, kifejezetten az előrehaladott stádiumú asztrocitómás betegekre összpontosít. különösen rossz prognózis 88, 89, 136. Ezenkívül az eddigi vizsgálatokban az alanyok száma kicsi, ami csökkenti az eredmények statisztikai megbízhatóságát. Ennek ellenére kis kísérleti kísérletekben találtunk néhány tippet a tumorsejtek proliferációjának csökkentésére CHO-restrikcióval az extrakraniális daganatokban90, 137.
Néhány preklinikai vizsgálat azt is kimutatta, hogy a CHO-korlátozás, akár teljes kalória-korlátozás formájában138 - 140, akár nem korlátozott KD141, célozhatja a vaszkuláris endotheliális növekedési faktor útvonalát, amelyet a bevacizumab (Avastin) gyógyszer is megcéloz, és amelynek klinikai előnyei bizonyultak, amikor rádió- és/vagy kemoterápiával kombinálva a HNSCC142-ben. A VEGF gátlást alkalmazzák a tumor érrendszerének normalizálása és a daganat szövetének radioszenzitizálása érdekében az oxigén és kemoterápiás gyógyszerek bejuttatásának megkönnyítésével. Ezen mentén hiperbarikus oxigénterápiát (HBOT) alkalmaztak a sugárterápia hatékonyságának fokozására. A Cochrane-vizsgálat arra a következtetésre jutott, hogy a HBOT a sugárterápia során jelentősen csökkenti a tumor megismétlődésének kockázatát egy és öt év alatt a HNSCC-ben, de a megnövekedett normál szöveti sérülés és a központi idegrendszer oxigén-toxicitásának rovására. Ebben az összefüggésben érdekes megjegyezni, hogy két preklinikai vizsgálat bizonyítékot szolgáltat arra vonatkozóan, hogy a ketontesteknek szinergikus hatása lehet a HBOT143-mal, és jelentősen késleltetheti a HBOT által kiváltott rohamok kialakulását144.
Összefoglalva, bizonyítékok vannak arra, hogy a CHO restrikció citotoxikus szenzibilizátorként működik a tumorszövetben, miközben egyidejűleg védi a normál szövetet, amely támogatja annak megvalósulását a HNC standard kezelése során. A főbb hatásokat a 2. ábra, a közelmúltban pedig közzétették az alapjául szolgáló mechanizmusok alaposabb áttekintését14.
CHO korlátozás a testösszetétel pozitív befolyásolására
HNC-s betegeknél még az „elegendő” energia- és fehérjebevitel is elégtelennek bizonyult a kezelés során a súly és a sovány szövetveszteség megelőzésére169. Ennek megfelelően az Európai Onkológiai Iskola munkacsoportjának nemrégiben kiadott álláspontja szerint „minden erőfeszítést meg kell tenni az izomvesztés megakadályozására, ahelyett, hogy az elveszettek visszaszerzésének kísérleteire támaszkodnánk” 170. Ezt az állítást követve egy ilyen erőfeszítés részeként a keton-észterek vagy a KD-k kipróbálhatók.
Megbeszélés: reális-e a CHO-korlátozás a HNC-s betegeknél?
Folyamatábra, amely bemutatja az alacsony CHO diéta javasolt megvalósítását a HNC beteg számára. A képek olyan ketogén étrenddel kompatibilis ételeket mutatnak, amelyek krémes állagúak és így könnyen lenyelhetők.
Összegzésképpen elmondható, hogy a HNC-beteg CHO-korlátozása megvalósíthatónak és ezért reálisnak tűnik, de további időt és erőfeszítést igényel, mivel azt az egyes betegekhez kell igazítani. Ez azonban általános probléma a HNC-s betegeknél, és a táplálkozási tanácsadással kapcsolatos erőfeszítések általában megtérülni látszanak. Nyilvánvaló, hogy a CHO-korlátozott étrendek tolerálhatósága és az azokra adott válasz is egyéni, és egyes betegek könnyebben jutnak el a ketózishoz, mint mások. Remélhetőleg a jövőbeni vizsgálatok megmutatják, hogy mely betegek részesülnek leginkább a CHO korlátozásban. Jelenleg az Iowai Egyetemen folytatott I. fázisú klinikai vizsgálat (> NCT01975766) HNSCC-s betegeket toboroz a KD és az egyidejű kemoradiáció biztonságosságának vizsgálatára, másodlagos eredményként a progressziótól mentes túlélést. Az eredmények közzétételéig ez a cikk remélhetőleg arra ösztönzi az orvosokat, hogy saját tapasztalataikat szerezzék meg a CHO-korlátozás felajánlásával a betegeik számára, mint nem toxikus megközelítés a HNC elleni küzdelemben.
Köszönetnyilvánítás
Ez a cikk ugyanazon a címen készült beszélgetésen alapul, amelyet meghívtak az ASTRO 2014 multidiszciplináris fej- és nyakrák szimpóziumára Scottsdale-be, Arizonába. Szeretném megköszönni Dr. David Rabennek ezt a kedves meghívást. Szeretnék köszönetet mondani Xi-Shan Hao professzornak, aki meghívott és motivált, hogy írjam ezt a cikket a rákbiológiához és orvostudományhoz.
Lábjegyzetek
Potenciális összeférhetetlenséget nem hoznak nyilvánosságra.
- Tegyen reális súlycsökkenési célokat ezzel az ingyenes munkalapkal
- Új tanulmányok azt mutatják, hogy az alma segít a fogyásban és a rák elleni küzdelemben, ha nem; t hámozzon!
- Fehérjében gazdag, kiváló a fogyáshoz, most vegye be ezt a gabonát étrendjébe!
- Az első dolog, amit meg kell enni, hogy lefogyjon a jóért Egyél ezt nem azt
- Az első ok arra; re Nem veszíted el a hasi zsírt Egyél ezt nem azt