A szterol 14α-demetiláz mint antitripanoszomális terápia lehetséges célpontja: enzimgátlás és parazita sejtnövekedés
Galina I. Lepesheva
1 Biokémiai Tanszék, Vanderbilt University School of Medicine, Nashville, TN, 37232-0146, USA
Robert D. Ott
2 Mikrobiológiai és Immunológiai Tanszék, Vanderbilt Egyetem Orvostudományi Kar, Nashville, TN, 37232-0146, USA
Tatiana Y. Hargrove
1 Biokémiai Tanszék, Vanderbilt University School of Medicine, Nashville, TN, 37232-0146, USA
Julija Y. Kleshchenko
3 Mikrobiális patogenezis és immunválasz tanszék, Meharry Medical College, Nashville, TN 37208, USA
Inge Schuster
4 Gyógyszerészeti Kémiai Intézet, Bécsi Egyetem, Oesterreich, Ausztria
W. David Nes
5 Kémiai és Biokémiai Tanszék, Texas Tech University, Lubbock, TX 79409-1061, USA
George C. Hill
2 Mikrobiológiai és Immunológiai Tanszék, Vanderbilt Egyetem Orvostudományi Kar, Nashville, TN, 37232-0146, USA
Fernando Villalta
3 Mikrobiális patogenezis és immunválasz tanszék, Meharry Medical College, Nashville, TN 37208, USA
Michael R. Waterman
1 Biokémiai Tanszék, Vanderbilt University School of Medicine, Nashville, TN, 37232-0146, USA
Társított adatok
Összegzés
A szterol-14α-demetilázok (CYP51) a gombaellenes gyógyszerek elsődleges célpontjai és a CYP51-ek specifikus gátlása a protozoon parazitákban. A Trypanosoma brucei (TB) és a Trypanosoma cruzi (TC) hatékony kezelési stratégiát jelenthet az emberi trypanosomiasok számára. Az elsődleges inhibitor kiválasztása kezdetben a citokróm P450 ligandumkötésre adott spektrális válaszán alapul. A legerősebb kötődési paramétereket mutató ligandumokat a rekonstitutált TB és TC CYP51 aktivitás inhibitoraként vizsgáltuk in vitro. Közvetlen összefüggés a vegyületek mint CYP51 inhibitorok hatékonysága és parazitaellenes hatása között a TB és TC sejtekben alapvető követelményeket támaszt az endogén szterin termeléséhez mindkét tripánoszómában, és új ólomszerkezetet javasol egy meghatározott régióval, amely a legígéretesebb a további módosításokra. Az itt kidolgozott megközelítés felhasználható az új CYP51 inhibitorok további nagyszabású keresésére.
Bevezetés
A TB és TC genomok szekvenálása [7] az összes szterin bioszintetikus enzim jelenlétét mutatta ki a parazitákban, ideértve a szterol-14α-demetilázt (CYP51), egy citokróm P450-et, amely az út specifikus posztkvalén részének kezdeti szakaszában működik, és egy három- a 14a-metilcsoport oxidatív eltávolításának lépéses reakciója az újonnan ciklizált szterin prekurzorokból [30]. A gombaellenes terápia során a CYP51 az azol-származékok elsődleges célpontja. A gombákban a CYP51 reakció gátlása 14α-metilezett szterinek felhalmozódásához vezet, amelyek a szterikus akadály miatt nem képesek az ergoszterint helyettesíteni a membránban [11].
A TB-ből és a TC-ből származó CYP51-ek csak ~ 25% aminosav-azonosságot mutatnak a gombás ortológusokkal, és 83% -ban azonosak egymással. Megmutattuk, hogy míg a TCCYP51 előnyben részesíti a C4-dimetilezett 24-metiléndihidrolanoszterint, a fonalas gombákból származó CYP51 természetes szubsztrátját, a TBCYP51 szigorúan specifikus a C4-monometilezett növényszerű szubsztrátok (obtusifoliol és norlanoszterol) és aminosav alapján szekvencia, az összes többi szekvenált protozoon CYP51 aktivitásában hasonlít a TBCYP51-re [31-33].
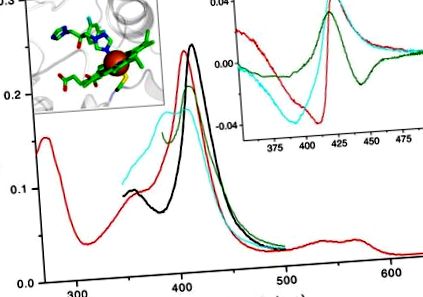
Fő panel: 2 μM TBCYP51 abszolút spektruma: oxidált ligandum mentes (piros), redukált ligandum mentes (zöld), oxidált 47% magas spinű obtusifoliollal kötött (cián), azol 4 -kötött (fekete). A Soret-sáv maximális kék eltolódását (417 és 394 nm között) az okozza, hogy egy vízmolekula kiszorul a hem vas hatodik koordinációs szférájából (pl. Szubsztrát, amely maga nem képez koordinációs kötést a vasal). Ez a spektrális válasz (1. típus) tükrözi a vas átmenetét a hexa-koordinált alacsony spin-állapotból a penta-koordinált magas-spin-állapotba. Egy bázisatom (pl. Alifás vagy aromás nitrogén) közvetlen koordinációja a hem-vashoz vörös eltolódást okoz a Soret-sávban (426–429 nm-re), amelyet a 2. típusú válaszként is ismerünk a különbségspektrumokban. Jobb betét: az oxidált, redukált és szubsztráttal kötött TBCYP51-hez való azolhoz való kötődésekor megfigyelt 2. típusú különbségspektrumok (színkód a fentiek szerint) Bal oldali betét: a flukonazol és a hem vas koordinációja a Mycobacterium tuberculosisból származó CYP51 kristályszerkezetében [1ea1]. A vas barna gömb, a hem koordinált Cys-maradék (ötödik axiális ligandum) a vas alatt helyezkedik el, a kénatom sárga színnel, a fehérje-rész szürke színnel jelenik meg.
A. A P450 spektrális válaszokból becsült kötési affinitások alapján kiválasztott vegyületek. B. Azolok hozzáadása a szerkezet/aktivitás összefüggés elemzése után. A sejttanulmányokban használt vegyületeket szürke háttérrel jelöljük. * Látszólagos disszociációs állandók, μM. Az enzim/szubsztrát komplexeknél a Kds-nél magasabb Kds-értékkel rendelkező azolok gátló hatása (1,2 és 0,8 μM a TBCYP51 obtusifoliollal, illetve a TCCYP51 24-metiléndihidrolanoszterollal való kölcsönhatására [31, 32]) sokkal gyengébb volt; összetett 5. példaként szerepel. ** mólarányú inhibitor/P450, amely az aktivitás kétszeres csökkenését eredményezi. *** Az I/E2 a katalízis kezdeti sebességére (5 ') gyakorolt hatásként számítva (I/E2 a szubsztrát konverziójának 1 órás (60') reakció utáni százalékos hatásaként számítva). Négy kísérlet eredményét átlagként mutatjuk be; a szórás nem haladja meg a 10% -ot.
A legerősebb CYP51 inhibitorok azonosítása
A rekonstituált enzimreakció gátló hatásának becslése in vitro
Magas kötési affinitásuknak megfelelően a vegyületek erős gátló hatást fejtenek ki a katalízis kezdeti sebességére. A reakció kétszeres lassításához szükséges inhibitor/enzim (I/E2) arányok minden esetben alacsonyabbak voltak, mint a vegyület 5. (mindkét trypanosomális CYP51 esetében), ketokonazol és flukonazol a TB ortológus számára (2. ábra).
Nyilvánvalóan a legjobb inhibitorokat különböztetjük meg az idő múlásával, összehasonlítva az azolok hatásait az ekvimoláris arányban az enzimekkel (3. ábra). Ilyen körülmények között a szubsztrátkonverzió még egy óra reakció után sem mutatható ki vegyületek esetén 2 vagy 4 hozzáadódnak. 4 óráig terjedő inkubációs intervallumokat teszteltünk ugyanazzal az eredménnyel, míg a reakcióban lévő enzim több mint 90% -a aktív P450 formában maradt. Így a vizsgált időn belül a vegyületek hatása 2 és 4 mindkét trippanoszomális CYP51-en visszafordíthatatlan marad.
- Fájdalomkezelés Fényterápia Egyesült Királyság
- A parciális ragasztó vékonybél obstrukció nem sebészeti kezelése orális terápiával randomizált
- Nutraceuticals szerepe a hipolipidémiás terápiában
- Az ápolószemélyzet több táplálkozási képzésen vesz részt az elhízás megcélzásához Ápolási idők
- Nutrológiai proteolitikus enzim hasnyálmirigy