A természetes immunglobulin M kritikus szerepe azonnali védekezésben a szisztémás bakteriális fertőzés ellen
Marianne Boes
* A rákkutató központ és a biológiai tanszék részéről, Massachusettsi Műszaki Intézet, Cambridge, Massachusetts 02139; és a Research Vérkutató Központ, Harvard Medical School, Boston, Massachusetts 02135
Andrey P. Prodeus
* A rákkutató központ és a biológiai tanszék részéről, Massachusettsi Műszaki Intézet, Cambridge, Massachusetts 02139; és a Research Vérkutató Központ, Harvard Medical School, Boston, Massachusetts 02135
Tara Schmidt
* A rákkutató központ és a biológiai tanszék részéről, Massachusettsi Műszaki Intézet, Cambridge, Massachusetts 02139; és a Research Vérkutató Központ, Harvard Medical School, Boston, Massachusetts 02135
Michael C. Carroll
* A rákkutató központ és a biológiai tanszék részéről, Massachusettsi Műszaki Intézet, Cambridge, Massachusetts 02139; és a Research Vérkutató Központ, Harvard Medical School, Boston, Massachusetts 02135
Jianzhu Chen
* A rákkutató központ és a biológiai tanszék részéről, Massachusettsi Műszaki Intézet, Cambridge, Massachusetts 02139; és a Research Vérkutató Központ, Harvard Medical School, Boston, Massachusetts 02135
Absztrakt
A természetes immunglobulin (Ig) M szerepének értékeléséhez a mikrobiális fertőzés elleni azonnali válaszban olyan mutáns egereket teszteltünk, amelyeknek szekretált IgM-je hiányos, akut peritonitis modellben, amelyet cecalis ligáció és szúrás indukált (CLP). A vad típusú egerek 20% -a elhunyt a CLP-től számított 32 órán belül, míg az sIgM-hiányos egerek 70% -a ugyanabban az időszakban halt meg. A megnövekedett érzékenység a tumor nekrózis faktor (TNF) -α csökkent szintjével, csökkent neutrofil toborzással és a hashártya megnövekedett baktériumterhelésével, valamint a keringésben megnövekedett endotoxin és gyulladásgátló citokinek szintjével járt. Az sIgM-hiányos egerek CLP-rezisztenciáját helyreállítottuk normál egérszérumból származó poliklonális IgM-mel történő rekonstrukcióval. A foszfatidilkolinra, a konzervált sejtmembrán-komponensre specifikus monoklonális IgM-mel való feloldás szerény hatást fejt ki, de a foszfokolinra specifikus monoklonális IgM nem véd. Ezek az eredmények demonstrálják a természetes IgM kritikus szerepét a súlyos bakteriális fertőzés elleni közvetlen védekezésben.
A spontán előforduló immunglobulinokat az emberi köldökzsinórvérben, „antigénmentes” egerekben és normál egyénekben látszólagos antigénstimuláció hiányában természetes antitesteknek nevezzük (az áttekintéseket lásd az 1–3. Referenciákban). Ezen antitestek többsége a B-1 sejtek által termelt IgM osztályba tartozik. A B-1 sejtek abban különböznek a hagyományos B sejtektől, hogy túlnyomórészt a magzat és az újszülött fejlődése során keletkeznek (4–6). A JH-proximális VH génszegmensek preferenciális használata és a prekurzor B sejtekben a terminális dezoxinukleotidil-transzferáz aktivitás hiánya miatt a korai ontogenitás során (7–9) a természetes antitestek repertoárja sokkal korlátozottabb, mint a hagyományos B sejtek által termelteké. A természetes antitestek nagy része polireaktív a filogenetikailag konzervált struktúrákra, például a nukleinsavakra, a hősokk-fehérjékre, a szénhidrátokra és a foszfolipidekre (4–6, 10). Például az egér B-1 sejtjeinek 5–15% -a expresszálja a foszfatidilkolinra (PtC) specifikus IgM-et, amely egy közös membránkomponens, amelyet a vörösvértestek proteolitikus bromelain enzimmel történő kezelése után tettek ki (11, 12).
A természetes antitestek fiziológiai funkciói régóta érdekeltek. Számos feltételezett funkció közül a természetes IgM, a veleszületett immunitás tényezőivel együtt, feltételezhetően első védelmi vonalat nyújt a mikrobiális fertőzések ellen (1–3). Természetes jelenléte mellett az IgM pentamer és molekulánként 10 antigéndeterminishez kötődhet. A polireaktivitás lehetővé teszi, hogy egyidejűleg antigének széles spektrumával reagáljon. Továbbá az IgM erős komplement aktivátor. A komplement aktiválása közvetlenül a behatoló baktériumok lízisét vagy a fertőző részecskék opszonizációját eredményezheti a hatékony fagocitózis érdekében makrofágok és polimorfonukleáris leukociták által. Megfelelő állatmodellek hiánya miatt azonban a természetes IgM feltételezett működését fiziológiai körülmények között nem vizsgálták kritikusan.
Korábban készítettünk egy mutáns egér törzset, amelyben a B-sejtek specifikusan hiányosak a szekretált (k) IgM-ben, de mégis expresszálják a membránhoz kötött IgM-et és más Ig-izotípusokat választanak ki (13). A természetes IgM baktériumfertőzésben betöltött fiziológiai szerepének meghatározásához megvizsgáltuk az sIgM-hiányos egerek fogékonyságát akut szeptikus peritonitis modellben, amelyet cecalis ligáció és szúrás indukált (CLP [14]). Megmutattuk, hogy az sIgM-hiányos egerek sokkal érzékenyebbek, mint a vad típusú egerek, ezt jelzi, hogy nem képesek kitisztítani a baktériumokat a peritoneumból, szisztémás felszabadulású proinflammatorikus citokinek és magas mortalitási arány. Az sIgM-hiányos egerek CLP-vel szembeni rezisztenciáját helyreállítottuk normál egérszérumból származó poliklonális IgM-mel, és kisebb mértékben PtC-re specifikus monoklonális IgM-mel, de nem foszfokolinnal (PC) való helyreállítással. Eredményeink bemutatják a természetes IgM kritikus szerepét az akut szisztémás bakteriális fertőzés elleni azonnali válaszban.
Anyagok és metódusok
Az sIgM-hiányos egereket korábban leírták (13). A vegyes C57BL/6 × 129 hátterű vagy tiszta 129 háttérű mutáns egereket specifikus kórokozóktól mentes létesítményekben tartottuk fenn, és 6–8 hetes korban használtuk őket. A vizsgálatokat az állatok felhasználására és gondozására vonatkozó intézményi irányelvek szerint végezték.
A műtéti eljárást a leírtak szerint hajtották végre (15). Röviden, az egereket avertinnel altattuk (0,2 ml 2,5% -os oldat/10 g testtömeg), és a hashártyán 0,5 cm-es középvonalú bemetszést végeztek. A vakbél disztális kétharmadát selyemvarrattal ligáltuk, majd a vakbélet 18,5-es tűvel egyszer megszúrtuk, majd finoman megszorítottuk, hogy a lyukak teljesen kinyíljanak. A vakbél visszatért a peritoneális üregbe, a testfalat varrva, és a bemetszést 9 mm-es rozsdamentes acélból készült sebkapcsokkal lezárták. Az álellenőrzéseket ugyanúgy működtettük, de ligálás és szúrás nélkül. Néhány kísérletben az egereket 3 órával a CLP után leöltük. A peritoneális öblítést 3 ml PBS 2% FCS-sel történő injektálása után gyűjtöttük be, és további vizsgálatokhoz használtuk fel (lásd alább). Más kísérletekben az egereket 1,5, 3, 6 és 12 órával a farokvénán keresztül elvéreztük, miután a CLP-t és a szérumokat használtuk a további vizsgálatokhoz. A túlélés statisztikai elemzését a Stata programmal végeztük (Stata Corp., College Station, TX).
IgM tisztítás.
Eredmények és vita
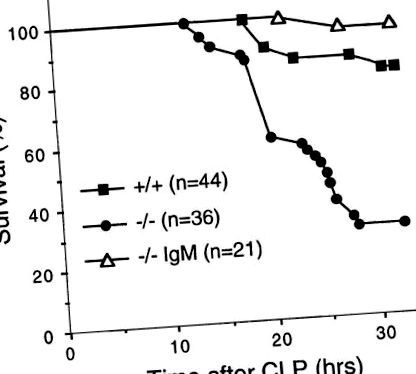
A természetes IgM szerepének vizsgálatához a mikrobiális fertőzésre adott azonnali válaszban meghatároztuk az sIgM-hiányos egerek érzékenységét a CLP által kiváltott akut szeptikus peritonitisre, amely endogén baktériumokat szabadít fel a cecumból a peritonealis üregbe. 32 órával a CLP után az sIgM-hiányos egerek 70% -a pusztult el, szemben a vad típusú egerek 20% -ával (1. ábra, 1. ábra), ami azt jelzi, hogy a természetes IgM hiánya miatt a mutáns egerek sokkal érzékenyebbek a az akut bakteriális fertőzés (P (1. ábra). 1). Hasonlóképpen, az sIgM-hiányos egerek érzékenyebbek voltak az egyes patogén baktériumok, például a B csoport Streptococcus által történő fertőzésre is. Az 50% -os (LD50) fertőzött állatok halálos dózisa tízszer alacsonyabb volt az sIgM-hiányos egereknél, mint a vad típusú egereknél (publikálatlan megfigyeléseink). Az sIgM-hiányos egerek az opportunista baktériumok, köztük a Pasteurella pneumotropica által okozott spontán bakteriális fertőzések gyakoribb előfordulását is kimutatták specifikus kórokozóktól mentes létesítményekben (publikálatlan megfigyeléseink). Ezek az adatok azt mutatják, hogy a bakteriális fertőzések elleni védelemhez természetes IgM szükséges.
A természetes IgM rezisztenciát kölcsönöz a CLP-vel szemben. 6-8 hetes sIgM-hiányos (-/-) és vad típusú (+/+) egereken CLP-t alkalmaztak. Az IgM-tal rekonstruált sIgM-hiányos egereket (-/- IgM) egyszeri, 0,5 mg-os dózisban adtuk be iv. teljes IgM affinitás - normál egér szérumból tisztítva 4 órával a CLP előtt. Az egerek túlélését monitoroztuk az első 32 órán belül.
A CLP-vel szembeni rezisztencia függ a komplementtől, a hízósejtektől és a TNF-α-tól (17–20). Az sIgM-hiányos egerek érzékenysége a CLP-re hasonló a C3 vagy C4 komplement komponensben vagy hízósejtekben hiányos egerekhez (17–19). A CLP-vel szembeni rezisztencia iránti természetes IgM követelménye valószínűleg azon a képességen alapul, hogy képes megkötni a baktériumokat és aktiválni a komplementet. Ennek a lehetőségnek a tesztelésére meghatároztuk az azonnali választ a TNF-α, IL-6 és LPS szintjének, a neutrofil infiltráció és a baktériumterhelés vizsgálatával a peritoneális öblítésben 3 órával a CLP után. A C3-hiányos egerekhez hasonlóan a mutáns egerekben a TNF-a és az IL-6 szintje megközelítőleg a fele volt a vad típusú egerek szintjének (1. táblázat). CLP nélkül mind az sIgM-hiányos, mind a vad típusú egerekben nagyon kevés neutrofil volt a hashártyában (1. táblázat, 1. táblázat, és az adatok nem láthatók). Ezenkívül tízszer több E. coli került elő az sIgM-hiányos egerek peritoneális öblítéséből, mint a vad típusú egerekből (táblázat (1. táblázat) .1). A magasabb baktériumterheléssel összefüggésben az sIgM-hiányos egerekben körülbelül az endotoxin (LPS) mennyiségének kétszeresét detektálták, mint a vad típusú egerekben. Az sIgM-hiányos egerek teljes IgM-mel történő feloldása helyreállította a TNF-a és a neutrofilek szintjét, és csökkentette az E. coli terhelést a peritoneális mosás során (1. táblázat (1. táblázat), 1), összhangban a megnövekedett túléléssel. Ezek az adatok azt mutatják, hogy az sIgM hiányának a TNF-α indukciójára, a neutrofil infiltrációra és a peritoneum baktériumterhelésére gyakorolt hatása nagyon hasonló a C3 hiányában tapasztaltakhoz, ami azt jelzi, hogy a természetes IgM a komplement útvonalon keresztül működik.
Asztal 1
A peritoneális lemosás elemzése 3 órával a CLP után
| TNF-α (pg/ml) | 1,507 | 892 | 2,068 | 1,643 | 304 |
| IL-6 (pg/ml) | 2,734 | 1,401 | ND | ND | ND |
| Neutrofilek (%) | 81.7 | 54.8 | 83.5 | 69.6 | 22.1 |
| E. coli (CFU) | 34,9 × 10 3 | 350 × 10 3 | 2,3 × 10 3 | 62,5 × 10 3 | 510 × 10 3 |
| LPS (EU/ml) | 36.7 | 62.9 | 23.8 | 51.2 | 64.0 |
sIgM-hiányos egereknek (-/-), vad típusú egereknek (+/+) és IgM-re rekonstruált sIgM-hiányos egereknek CLP-t alkalmaztunk. A hashártya átöblítését 3 ml injekcióval injektáltuk. 2% FCS-t tartalmazó PBS 3 órával a CLP után. Az IgM-re rekonstruált egereknek egyszeri, 0,5 mg-os dózist kaptak iv. tisztított poliklonális IgM normál egér szérumból vagy PtC-re vagy PC-re specifikus monoklonális IgM 4 órával a CLP előtt. Az sIgM-hiányos és vad típusú egerek peritoneális öblítését hét egérből egyesítettük, és meghatároztuk a TNF-a, IL-6 és LPS, E. coli szám és neutrofil szinteket (lásd: Anyagok és módszerek). A TNF-α és LPS szintjét, az E. coli-számokat és a neutrofileket peritonealis átmosással vizsgáltuk egyedi IgM-re rekonstruált egerekből. Négy egér átlaga látható. Hasonló eredményeket kaptunk egy külön kísérletben is.
Az IgM a legerőteljesebb komplement aktivátor az Igs öt osztálya között. Egyetlen megkötött IgM molekula elegendő a vörösvértest líziséhez szükséges komplement aktiválásához (21). A természetes IgM baktériumokhoz való kötődése közvetlenül a fertőzés után valószínűleg a komplement aktiválódását eredményezi a klasszikus úton. Mivel az sIgM-hiányos egerek széruma ugyanolyan hatékonyan lizálta az antitesttel opszonizált vörösvértesteket, mint a vad típusú egerek széruma egy hemolitikus vizsgálatban (az adatokat nem mutatjuk be), az sIgM-hiányos egerek CLP-re való fokozott érzékenysége valószínűleg a hiány hiányával jár IgM által közvetített komplement aktiváció. Úgy tűnik, hogy a C3- vagy C4-hiányos egerek még érzékenyebbek a CLP-re, mint az sIgM-hiányos egerek, ezt 24 órán belül 100% -os mortalitás jelzi (17). Ennek oka lehet, hogy a komplement az alternatív és a lektin útvonalon keresztül is aktiválható, és a komplement fontos a baktériumok hatékony eltávolításában. Ezenkívül az sIgM-hiányos egerekben viszonylag normális az IgG-szint (13), amelyek közül néhány valószínűleg természetes ellenanyag. Bár az IgG fehérjék hozzájárulhatnak az sIgM-hiányos egerek túléléséhez, nyilvánvalóan nem elégségesek a természetes IgM hiányának teljes kompenzálására.
Az LPS, a TNF-a és az IL-6 szintjének összehasonlítása az sIgM-hiányos és a vad típusú egerek szérumában a CLP után különböző időpontokban. A szérumokat a CLP után 1,5, 3, 6 és 12 órával gyűjtöttük össze, és négy csoportra osztottuk az egerek genotípusa és annak alapján, hogy az egerek elpusztultak vagy túléltek-e a CLP után 32 órával. Az álellenőrzést ligálás és szúrás nélkül operáltuk. Az LPS, a TNF-a és az IL-6 koncentrációit ELISA-val határoztuk meg. A hibasávok jelzik az SD-t. A TNF-α assay esetében az egerek száma az egyes kategóriákban a következő: -/- elhalt, 12; -/- túlélte, 10; +/+ halott, 10; és +/+ túlélte, 16. Nyolc egeret alkalmaztunk minden kategóriában az IL-6 vizsgálathoz. Minden kategóriában hat egeret alkalmaztak az LPS vizsgálatához. A TNF-α, IL-6 és LPS álkontrollok száma 2, 1, illetve 1 volt.
Köszönetnyilvánítás
Köszönjük Dr. Leonore A. Herzenberg és J. Latham Claflin anti-PtC és PC hibridómák esetében; Dr. Yong Wang és Jay Austen a hemolitikus assay segítéséért; Dr. Herman Eisen a kézirat kritikai elolvasásáért; és a laboratórium tagjaival segítségért és megbeszélésért.
- 6 olyan színész, akinek le kellett fogynia egy filmszerepért
- 1 LB Voronezh kréta 100% -ban tiszta természetes szennyeződések és Etsy
- Sárgabarack természetes fogyás étel HowStuffWorks
- A béta-adrenerg receptorok kritikus fontosságúak a fogyás szempontjából, de a más anyagcsere-adaptációk szempontjából nem
- 6 borbolya egészségügyi előnyei Gyümölcs; amp; Kiegészíti a természetes antibakteriális 1MD-t