A TLR4 antagonista Eritoran megvédi az egereket a halálos influenza fertőzésektől
Tárgyak
Ez a cikk frissült
Absztrakt
Sürgősen szükség van alternatívák kifejlesztésére az éves influenza elleni oltásoknak és az influenza fertőzésének enyhítésére engedélyezett vírusellenes szereknek. Korábbi tanulmányok arról számoltak be, hogy a kémiai vagy mikrobiális sértések okozta akut tüdőkárosodás másodlagos a gazda eredetű, oxidált foszfolipid képződéséhez képest, amely hatásosan stimulálja a Toll-szerű receptor 4 (TLR4) -függő gyulladást 1. Ezt követően beszámoltunk erről Tlr4 -/- az egerek nagymértékben refrakterek az influenza okozta letalitásra 2, és azt javasolták, hogy a TLR4 jelátvitel terápiás antagonizmusa megvédje az influenza okozta akut tüdőkárosodástól. Itt beszámolunk arról, hogy az Eritoran (más néven E5564) - egy erős, jól tolerálható, szintetikus TLR4 antagonista 3,4 - terápiás alkalmazása blokkolja az egerek influenza okozta letalitását, valamint a tüdő patológiáját, a klinikai tüneteket, a citokint és az oxidált foszfolipidet. expresszióját, és csökkenti a vírustitereket. A CD14 és a TLR2 szintén szükséges az Eritoran által közvetített védelemhez, és a CD14 közvetlenül megköti az Eritorant és gátolja a ligandum MD2-hez való kötődését. Így a TLR szignalizáció Eritoran-blokkolása új terápiás megközelítést jelent az influenzával és esetleg más fertőzésekkel járó gyulladásokhoz.
Az influenza folyamatosan fejlődik, és évente új antigén variánsok jelennek meg, amelyek szezonális járványokat okoznak. Az éves influenzajárványok során a lakosság 5–15% -át sújtja felső légúti fertőzés, kórházi kezelés és haláleset elsősorban időseknél és krónikus betegeknél fordul elő. A becslések szerint az éves influenzajárványok világszerte 3-5 millió súlyos betegség és 250 000–500 000 halálesetet eredményeznek 5,6. Ezenkívül hirtelen megjelenhetnek azok a törzsek, amelyekkel szemben az embernek nincs előzetes immunitása, és az ebből eredő járványok katasztrofálisak lehetnek, amint ezt az 1918-as millió milliókat megölt „spanyol influenza” is szemlélteti 7,8. A jövőbeni immunogén epitópok előrejelzéséhez kapcsolódó logisztikai problémák, valamint a termelési és eloszlási problémák gyakran korlátozzák a hatékonyságot és/vagy az oltóanyagok elérhetőségét. Ezenkívül a meglévő vírusellenes terápiával szembeni rezisztencia növelése, valamint annak szükségessége, hogy ezeket a szereket a fertőzés után 2-3 napon belül beadják, korlátozza azok hasznosságát 9, 10, 11. Ezért kritikus szükség van az influenza elleni vakcinák és antivirális szerek biztonságos és hatékony terápiás kiegészítő és/vagy alternatívájára.
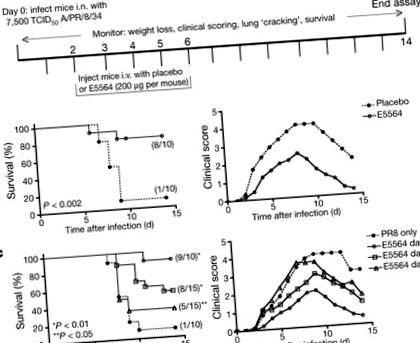
Az 1a. Ábra szemlélteti a kezdeti protokollunkat. A „0. napon” a 6–8 hetes, nőstény C57BL/6J egereket intranazálisan (i.n.) fertőztük meg PR8 dózissal, amelyről megállapították, hogy az egerek ∼ 90% -át elpusztítja (∼ LD90). Két nappal később az Eritoran (E5564) TLR4 jelátviteli antagonistát 5 egymást követő napon keresztül (200 μg/egér; 2-6. Nap) intravénásán (i.v.) adtuk be naponta. Minden egeret lemértek és napi 2 héten keresztül klinikai tüneteket (például letargia, piloerekció, fodros szőr, görnyedt testtartás, gyors sekély légzés, hallható zörgés) értékeltek. Az Eritoran-nal kezelt egerek szignifikánsan védettek voltak az influenza okozta letalitástól, míg a placebót (csak vivőanyagot) kapó egerek 90% -a elhunyt (1b. Ábra, balra). Ezt párosították a súlyosabb klinikai pontszámok (1b. Ábra, jobbra) és a testsúlycsökkenés (kiegészítő 1A. Ábra) a kontroll egerekben, szemben az Eritorannal kezelt egerekkel. Az egerek tízszeres kevesebb Eritorannal (egérenként 20 μg) történő kezelése 40% -ra csökkentette a túlélést (4/10 egér maradt életben; az adatokat nem közöltük). Az Eritoran-kezelés hatékonysága 7500 50% -os szöveti tenyésztési fertőző dózissal (TCID50) fertőzött egerek 90% -os túléléséről 10 000, illetve 20 000 TCID50-vel fertőzött egerek 60% -os és 25% -os túlélésére csökkent (Kiegészítő 1B. Ábra). Az Eritoran-kezelés a nem adaptált, 2009-es humán pandémiás influenza A/California/07/2009 H1N1 törzs halálos dózisával fertőzött egereket is megvédte (1C. Kiegészítő ábra).
További kísérleteket hajtottak végre, amelyek során az Eritoran-kezelést a fertőzés utáni 2., 4. vagy 6. napon kezdték meg. Az 1c. Ábra (balra) azt szemlélteti, hogy azok a PR8-fertőzött egerek 90% -a, akik nem részesültek Eritoran-kezelésben, elpusztultak, míg azoknál az egereknél, amelyek Eritorant kaptak a 2., 4. vagy 6. naptól kezdve, statisztikailag szignifikáns túlélési arány volt 90%, 53% és 33%, illetőleg. Ugyanezen egerek klinikai pontszámai (1c. Ábra, jobbra) azt mutatják, hogy minél később kezdték el az egerek az Eritoran-kezelést, annál súlyosabbak voltak a klinikai pontszámaik. Azok az egerek, amelyek nem kaptak Eritorant, a legsúlyosabb tüneteket és a legmagasabb klinikai pontszámot mutatták. Hasonlóképpen, a súlycsökkenés fokozatosan nagyobb volt, annál később, amikor a fertőzést követően megkezdték a kezelést (az adatokat nem közöljük). Tehát, ellentétben a jelenlegi vírusellenes szerekkel, amelyeket nem sokkal a fertőzés után kell beadni, az Eritoran-kezelés jelentősen növelte a túlélést, még akkor is, ha a fertőzés után 6 nappal később kezdték el.
Annak megállapítására, hogy az Eritoran terápiás hatása kiterjed-e az emberi influenza fertőzés más állatmodelljeire is, kísérleteket végeztünk pamut patkányokon (Sigmodon hispidus) 14,15. Az A/Wuhan/359/95 (H3N2), egy humán nem adaptált influenza törzs, az 1. napon a gyapot patkányok tüdejében replikálódik, és a fertőzés után a 4. napon csúcsos tüdőpatológiát produkál (2d. Ábra, középső; és 2e. Ábra)., Csak H3N2). A H3N2-fertőzés után Eritorannal kezelt állatok szignifikáns csökkenést mutattak a tüdő patológiájában a 4. napon a vivőanyaggal kezelt állatokhoz képest (2d. Ábra, jobb; és 2e. Ábra, H3N2/E5564).
A 3a. Ábra azt mutatja, hogy a fertőzés utáni 6. napon az Eritoran-kezelés statisztikailag szignifikáns csökkenést eredményezett a tüdő vírustiterében, amelyet tovább csökkent a 7. (3b. Ábra) és a 8. (az adatokat nem ábrázolt) nap. Ez nem volt az Eritoran közvetlen hatása a vírusreplikációra (1. kiegészítő táblázat). A 14. napra az összes túlélő egér a kezeléstől függetlenül teljesen megtisztította a vírust. Mivel az influenza fertőzés rendszerszintű 16, a májenzimek alanin-aminotranszferáz (ALT) és aszpartát-aminotranszferáz (AST) szintjét szérumokban mértük. Bár a PR8 fertőzés az ALT és az AST szintjének jelentős növekedését eredményezte, ezek a fertőzés után 6 nappal az Eritoran-nal kezelt egereknél szignifikánsan alacsonyabbak voltak (2. ábra).
Az influenza fertőzés hatásosan indukálja mind a pro-, mind a gyulladásgátló gének expresszióját in vivo amelyek hozzájárulnak a gyulladásos reakcióhoz 1,17. Annak megállapítására, hogy az Eritoran enyhíti-e a PR8 által indukált génexpressziót is, az egércsoportokat a 0. napon fertőztük meg, a 2. napon kezdtük az Eritoran kezelését, a 2. napon (3 órával az Eritoran-kezelés után), valamint a 4. és a 6. napon megöltük. tüdőhomogenátumokból extraháltuk, és a génexpressziót kvantitatív polimeráz láncreakcióval mértük kvantitatív valós idejű reverz transzkripcióval (qRT – PCR). Az Eritorannal kezelt egerek mindegyik időpontban szignifikánsan tompított pro- és gyulladásgátló génexpressziót mutattak (4a. Ábra és 3A. Kiegészítő ábra; P 4. ábra: Az Eritoran-kezelés elnyomja az influenza által kiváltott citokin gén expressziót.
Ifnb -/- az egerek nagyon érzékenyek a PR8-ra, és nem védik őket a hatékony IFN-β induktor, az 5,6-dimetil-xantenon-4-ecetsav 18. Ezenkívül endogén IFN-β szükséges számos proinflammatorikus citokin normális bazális és LPS-indukálható expressziójához makrofágokban 19. PR8-fertőzött Ifnb -/- az egereket nem védte az Eritoran (4. ábra). Ez azt jelzi, hogy bár gyulladáscsökkentő és Ifnb a génexpresszió tompa a PR8-fertőzött, Eritoran-nal kezelt vad típusú egerekben (4a. ábra, b), jelentős IFN-β kidolgozása szükséges a vírusellenes védelemhez jelentős priming hiányában.
A TLR4 leghatékonyabb aktiválása LPS-sel az LPS-kötő fehérje (LBP) által katalizált extrakciótól és az egyes LPS-molekulák aggregált LPS-ről CD14-re, majd CD14-ről MD2-re történő átvitelétől, majd a TLR4 bekapcsolódásától és dimerizációjától függ. A kristálytani elemzésből kiderült, hogy az Eritoran, az LPS lipid A monomerhez hasonlóan, az MD2 mély hidrofób zsebében kötődik; azonban az A lipiddel ellentétben az Eritoran nem indukálja a TLR4 dimerizációt és aktivációt, így TLR4 antagonistaként működik 20 .
Megerősítettük a 2. megállapítást, miszerint a PR8 által kiváltott letalitás egerekben TLR4-függő volt (5a. Ábra), de meglepő módon azt is megállapítottuk, hogy az influenza mortalitása nem függ CD14-től, amint azt a vad típusú és a PR8-fertőzésből származó hasonló mortalitás is jelzi. Cd14 -/- egerek versus ellenállása Tlr4 -/- egerek (5a. ábra). Ezek az eredmények arra utalnak, hogy a TLR4-függő influenza mortalitást az influenza által indukált TLR4 agonisták közvetítik, amelyek az LPS-sel ellentétben nem a CD14-től függenek a TLR4/MD2 bekapcsolódása és aktiválása szempontjából. Ezzel szemben a vad típusú egerekben kiváltott védelem, amikor az Eritoran-kezelést a fertőzés hiánya után a 2. napon kezdik meg, Cd14 -/- egerek, jelezve, hogy az Eritoran védőhatása ebben az influenza fertőzési modellben CD14-függő (5a. ábra).
Az Eritoran által közvetített védelem CD14-függőségének egyik lehetséges magyarázata az, hogy Eritoran MD2-vel való kapcsolata és a TLR4 antagonizmusa a CD14-től függ. Ennek a lehetőségnek a tesztelésére megvizsgáltuk in vitro az Eritoran azon képessége, hogy megkötje a CD14-et és az MD2-t azáltal, hogy az Eritoran gátolja a tríciumozott lipooligoszacharid ([3H] LOS; Neisseria) CD14-re (5b. ábra, balra), valamint a [3H] LOS átvitele CD14-ről MD2-re (5b. ábra, jobbra). Mivel az Eritoran gátló hatása az [3 H] LOS MD2-re történő átvitelére 100-szor erősebb, ha LBP és oldható CD14 van jelen, ez azt jelzi, hogy az Eritoran és az MD2 kölcsönhatása a leghatékonyabban az Eritoran és az Eritoran LBP-függő kölcsönhatása után következik be CD14.
Bár az MD1 homológot, amely az A2 lipidet is megköti, alternatív célpontnak tekintették az Eritoran számára, ezt a lehetőséget elvetették, mert az MD1 nem pótolta az MD2-t a TLR4 jelátvitel engedélyezéséhez (5. ábra).
A diacilezett lipidek TLR2 agonistaként működhetnek. Ennélfogva, ha az oxidált gazdafoszfolipideknek (például OxPAPC) szerepe van a TLR4-függő influenzában, elképzelhető, hogy ezek a diacilezett lipidek a TLR2-t tartalmazó receptor-komplexeket is képesek megkötni, és hogy az influenza által kiváltott mortalitás szintén TLR2-függő lehet. azonban, Tlr2 -/- az egerek hasonló érzékenységet mutattak a PR8 fertőzés iránt, mint a vad típusú egerek (5a. ábra), azzal érvelve, hogy a TLR2 fontos szerepet játszik az influenza okozta mortalitásban. Figyelemre méltó, hogy az Eritoran-kezelés által kiváltott védelem a fertőzés utáni 2. napon kezdődött Tlr2 -/- egerek, ami a TLR2 új szerepét javasolja az eritorani akcióban.
Ha az általunk megfigyelt PR8 által kiváltott akut tüdőkárosodás és mortalitás alapvetően az influenza által indukált oxidált gazdaszervezet foszfolipidjeinek köszönhető, amint azt korábban már javasoltuk 1, ezeknek a vegyületeknek a TLR4 (szemben a TLR2) preferenciális aktiválódását kell mutatnia, és az Eritoran gátolhatja őket. A kereskedelemben előállított OxPAPC összehasonlíthatóan aktiválva van Il6 gén expresszió vad típusú és Tlr2 -/- peritonealis makrofágok, de in 84% -ban gátolta Tlr4 -/- makrofágok a vad típusú válaszhoz képest. Az OxPAPC által végzett sejtaktiválást az Eritoran szintén jelentősen gátolta, ideértve a TLR4-független Il6 -ban megfigyelt mRNS Tlr4 -/- makrofágok (6. ábra). Ez azt jelzi, hogy az OxPAPC-re adott válasz túlnyomórészt TLR4-függő és Eritoran-érzékeny.
Az Eritoran fertőzés során az oxidált foszfolipidek termelésére gyakorolt hatásának értékeléséhez mátrix-segített lézeres deszorpciós ionizációs képalkotó tömegspektrometriát (MALDI-IMS) alkalmaztunk az egér tüdő lipidösszetételében bekövetkező változások azonosítására PR8 fertőzés után, Eritoran kezeléssel vagy anélkül . Várható oxidációs termékek (tömeg/töltés arány (m/z) 650, 830) 1-palmitoil-2-arachidonil-sn-glicero-3-foszfokolint (PAPC) vagy más, többszörösen telítetlen foszfatidilkolinokat, amint azt korábban leírtuk 1, nagyobb mennyiségben észleltünk PR8-fertőzöttekben, mint álfertőzöttekkel vagy fertőzöttekkel és Eritorannal kezelt tüdő (7. ábra). Ezeket az eredményeket elektrospray ionizáció – tömegspektrometriával igazoltuk (az adatokat nem mutatjuk be). Ezek az eredmények együttesen azt jelzik, hogy oxidált foszfatidilkolinok vannak jelen az influenzával fertőzött tüdőben, és azt mutatják, hogy az Eritoran-kezelés csökkenti e jellegzetes ionok relatív bőségét. Így az influenzával fertőzött egerek Eritoran-kezelése nemcsak blokkolja az influenza által indukált endogén TLR4 agonisták által súlyosbított citokin-vihart, hanem gátolja bizonyos oxidált foszfolipidek termelését és felhalmozódását a fertőzött tüdőben, beleértve az OxPAPC-t és esetleg másokat.
Módszerek összefoglalása
In vivo mérések
Az egereket és a pamut patkányokat megfertőztük i.n. influenza vírussal jelezve, majd kontroll vagy Eritoran iv. Megmértük a túlélést, a klinikai pontszámot, a súlycsökkenést, a citokin gén expressziót, a vírustitereket, az OxPAPC bőségét és az ALT/AST szintet.
Sejtkultúra mérések
Az elsődleges egér makrofág tenyészetet TLR agonistákkal vagy OxPAPC-vel kezelték Eritoran-nal vagy anélkül, és Il6 Az mRNS-t qRT – PCR-rel mértük.
Biokémiai mérések
Az Eritoran azon képességét, hogy gátolja az LPS kötődését a CD14-hez, vagy az LPS átvitelét a CD14-ből az MD2-be, 22,23 .
- Miért Natures Sunshine egészségügyi kiegészítők, Nature s Sunshine termékek, NSP, táplálékkiegészítők
- Az új humanitárius erőfeszítések a széleskörű tuberkulózis-fertőzés leküzdésére
- Dolgozz a természeted fogyásával
- Xilit; Fogyás Gyere vissza a természetbe SweetLife
- Az állatok munkája madarak és ember-erő által repült