A vérlemezkék túlaggregabilitása magas zsírtartalmú táplált patkányokban: Szerep a vérlemezkékben lévő reaktív oxigén fajok termelésében
Absztrakt
Háttér
Az adipozitás nagymértékben növeli az aterotrombotikus események kockázatát, egy olyan kóros állapotot, ahol a jelentések szerint az oxidatív stressz krónikus állapota játszik nagy szerepet. Ez a tanulmány az (NO) -oldható guanilil-cikláz (sGC) jelátviteli út szerepének vizsgálatát célozta a magas zsírtartalmú (HFF) patkányok vérlemezke-diszfunkciójában.
Mód
A hím Wistar patkányokat 10 hétig etettük standard chow-val (SCD) vagy magas zsírtartalmú étrenddel (HFD). Kiértékeltük az ADP (10 μM) - és a trombin (100 mU/ml) által kiváltott mosott vérlemezke-aggregációt. Az ROS szint intracelluláris szintjének mérését áramlási citometriával végeztük. A ciklikus GMP szinteket ELISA kitek segítségével értékeltük.
Eredmények
A magas zsírtartalmú táplált patkányok a testtömeg, az epididymális zsír, az éhomi éhgyomri glükózszint és a glükóz intolerancia növekedését mutatták az SCD csoporthoz képest. Az ADP által kiváltott vérlemezke aggregáció (n = 8) és HFD patkányokból származó trombin (n = 8) szignifikánsan nagyobbak voltak (P
Háttér
A vérlemezkék fontos fiziológiai funkciót töltenek be a vérzéscsillapító rendszerben az érrendszeri sérülésekre reagálva a vérzés megelőzésével [1]. A hatékony vérlemezke-adhézió és -aggregáció megköveteli a többszörös receptor-ligandum kölcsönhatások szinergikus hozzájárulását, amelyek aktiváló jeleket közvetítenek, és számos vérlemezke-biokémiai és morfológiai reakciót indítanak el, összekapcsolódva a citoszkeleton átalakulásával, a szemcsék szekréciójával, valamint endogén oldható agonisták, például ADP és tromboxán A2 (TXA2) [2–5].
Az endoteliális sejtekből származó nitrogén-oxid (NO) gátló hatást fejt ki a thrombocyta működésében a cGMP/PKG útvonal aktiválásával, ami viszont a Ca 2+ koncentrációjának csökkenéséhez vezet, megakadályozva ezzel a vérlemezkék tapadását és aggregálódását az érfalhoz [ 6]. Mindazonáltal a bizonyos kóros állapotokban előforduló endothelium diszfunkciót az alacsony NO biológiai hozzáférhetőség jellemzi, amely a vérlemezkék rendellenes aktiválódását idézi elő, ami vaszkuláris trombózishoz vezet [7, 8]. A thrombocyta-diszfunkció a cardiovascularis szövődmények végstádiumának tekinthető a II-es típusú diabetes mellitusban, az elhízásban és az ateroszklerózisban, amely olyan klinikai eredményeket eredményez, mint miokardiális infarktus, stroke és perifériás artériás betegség [9].
Az elhízás minden korosztályt és társadalmi-gazdasági csoportot érintő fontos közegészségügyi probléma, amely jelentősen megnöveli a szív- és érrendszeri, valamint az endokrin-anyagcserezavarok előfordulását. Az oxidatív stressz és a gyulladás krónikus állapota az adipozitás jellemzője, amelyek döntő szerepet játszanak e rendellenesség fiziopatológiai eseményeiben [10, 11]. Ezek a gyulladáscsökkentő és prooxidáns hatások a megnövekedett reaktív oxigén fajok (ROS) termelésével és a NO biohasznosulásának csökkenésével járnak, ami növeli az athero-trombotikus események kockázatát [12]. Mindazonáltal a pontos mechanizmusokat, amelyek révén az adipozitás indukálja a vérlemezkék diszfunkcióját, továbbra sem vizsgálták kellőképpen. Ezenkívül a trombotikus szövődmény következményeként bekövetkező halálos kardiovaszkuláris események többsége nem a teljes vaszkuláris szűkülethez, hanem a gyulladáscsökkentő és prooxidáns biomarkerek megváltozásához kapcsolódik, amelyek megjósolhatják a jövőbeni kardiovaszkuláris eseményeket. Feltételeztük, hogy az intraplatelet ROS-termelés zsírosodásban hozzájárul az endokrin-metabolikus rendellenességek trombotikus eseményeihez. Ezért megvizsgáltuk az ex vivo thrombocyta reaktivitást ADP és trombin hatására magas zsírtartalmú patkányokban, valamint a thrombocyta eredetű ROS és NO-cGMP útvonal szerepét a thrombocyta reaktivitásának modulálásában.
Mód
Állatok és magas zsírtartalmú étrend
A kísérleti protokollokat a brazil állatkísérleti főiskola (COBEA) által elfogadott állatkutatás etikai alapelvei hagyták jóvá és az ARRIVE állatkísérleti irányelveinek [13] megfelelően hajtották végre. A hím Wistar patkányokat szabályozott hőmérsékletű helyiségekben helyezték el, 12 órás világos-sötét ciklus alatt. Az állatokat két ketrecben helyeztük el, és 10 hétig etettük standard chow-étrenddel (szénhidrát: 70%; fehérje: 20%; zsír: 10%) vagy magas zsírtartalmú étrenddel, amely elhízást váltott ki (szénhidrát: 29%; fehérje): 16%; zsír: 55%), korábbi munkánk szerint [14].
Testtömeg, epididymális zsírtömeg és glikémia
A testtömeg és a mellékhártya zsírtömegét a vizsgálat kezdetén és végső időpontjában értékeltük. A glükózkoncentrációt a farokvénából származó vérben mértük (Accu-Check Performa, Roche Diagnostics, Indianapolis, IN, USA).
Orális glükóz tolerancia teszt (OGTT) és inzulin tolerancia teszt (ITT)
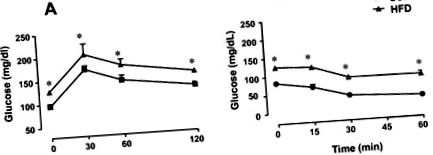
Az orális glükóz tolerancia tesztet 12 órás éhgyomorra végeztük. A kontroll és a magas zsírtartalmú (HFF) elhízott patkányok 20% -os glükózoldatot (2 g/kg) kaptak szondával. Vérmintákat gyűjtöttünk a farokvénából alapállapotban, 30, 60 és 120 perc glükózterhelés után. Az egész test inzulinérzékenységét az inzulin tolerancia teszt (ITT) segítségével elemeztük. A vénás vérmintákat (0 perc), valamint 15, 30 és 60 perccel a rendszeres inzulin intraperitoneális injekciója után (0,75 E/kg) gyűjtöttük.
Vérlemezkék izolálása és aggregációs vizsgálatok
A patkányokat izofluránnal altattuk, és a vért a hasi aortából vettük 1: 9 (v/v) ACD-C-ben (12,4 mM nátrium-citrát, 13 mM citromsav, 11 mM glükóz). Trombocitákban gazdag plazmát (PRP) kapunk a teljes vér centrifugálásával 200 g-on 15 percig szobahőmérsékleten. Öt milliliter PRP-t adtunk 7 ml mosópufferhez (140 mM NaCl, 0,5 mM KCl, 12 mM trinátrium-citrát, 10 mM glükóz, 12,5 mM szacharóz, pH 6), és centrifugáltuk (800 ml). g, 13 perc). A pelletet mosópufferben szuszpendáltuk, és az eljárást egyszer megismételtük. A vérlemezkéket finoman szuszpendáltuk Krebs-oldatban (118 mM NaCl, 25 mM NaHCO3, 1,2 mM KH2PO4, 1,7 mM MgS04, 5,6 mM glükóz, pH 7,4). A thrombocytaszámot 1 mM CaCl2 jelenlétében 1,2 × 108 thrombocyta/ml-re állítottuk be. A vérlemezke aggregációt kétcsatornás aggregométerben (Chronolog Lumi-Aggregometer 560-Ca modell, Havertown, PA, USA) mértük 37 ° C-on keverés közben (1000 fordulat/perc). A thrombocyta aggregációs vizsgálatokat ADP (10 μM) vagy trombin (100 mU/ml) alkalmazásával végeztük.
A reaktív oxigénfajok (ROS) mérése áramlási citometriával
Az ROS intracelluláris szintjének mérését egy korábbi tanulmány szerint végeztük [15]. Röviden, a megmosott (a fent részletezett módon nyert) vérlemezkéket Krebs-Ringer oldatban újraszuszpendáltuk 1,2 × 108 trombocita/ml koncentrációban 1 mM kalcium és 5 μM 2'-7'-diklór-fluoreszcin-diacetát (DCFH-DA) jelenlétében. . A vérlemezke-szuszpenziót (500 μl) előzetesen inkubáltuk N-acetil-ciszteinnel (NAC, 1 mM) vagy PEG-katalázzal (1000 U/ml) 15 percig, mielőtt DCFH-DA-t adtunk volna hozzá. A trombocita szuszpenziót 20 percig inkubáltuk ADP-vel (20 M) vagy H2O2-val (8 mM; pozitív kontroll), vagy sem. A vérlemezke-mintákat ezután centrifugáltuk (800 g, 10 perc), és az üledéket Krebs-oldatban (500 μl) újraszuszpendáltuk. A mintákat Becton Dickinson áramlási citométerrel (FACSCalibur, Becton Dickinson, San José, Kalifornia, USA) 488 nm hullámhosszú argon lézerrel, 510 × 540 nm sáváteresztő szűrőkkel szereltük fel. A vérlemezkéket az előre- és az oldalsó szórásjelek alapján azonosították. Tízezer thrombocyta-specifikus eseményt kezdetben elemeztek a citométerrel. Az aktiválatlan és aktivált vérlemezkéket kapunyitották, hogy ne elemezzék a vérlemezke-aggregátumokat és a mikrorészecskéket. A kapukat ezután elemezték átlagos fluoreszcencia szempontjából.
A cGMP kivonása és mérése
A megmosott vérlemezkéket (1,2x108 vérlemezke/ml) 15 percig inkubáltuk a foszfodiészteráz inhibitor 3-izobutil-1-metil-xantinnal (IBMX; 2 mM). Ezután a vérlemezkéket nátrium-nitroprussiddal (SNP, 10 μM), S-nitrozo-N-acetilpenicillaminnal (SNAP, 10 μM) vagy a BAY 41-2272-vel (10 μM) inkubáltuk 3 percig, majd a reakciót az adagolással megszakítottuk. hideg savanyított abszolút etanol (67 térfogat%/térfogat) és a mintákat erőteljesen keverjük 30 másodpercig. A sejtmintákat centrifugáltuk (4 000 g, 30 perc 4 ° C-on). A felülúszókat nitrogénáram alatt 55-60 ° C-on szárítottuk. A ciklikus GMP-t a Cayman Chemical (Ann Arbor, MI) kit készletével mértük. A vizsgálatokat két példányban hajtottuk végre. A cGMP kimutatási határérték 1 pmol/ml.
Anyagok
Az adenozin-difoszfátot (ADP), a trombint, a PEG-katalázt, az N-acetil-ciszteint (NAC), a nátrium-nitroprusszidot, az S-nitrozo-N-acetil-penicillamint (SNAP) a Sigma Chem-től szereztük be. Co. (St. Louis, MO, USA). Az 5-ciklopropil-2- [1- (2-fluor-benzil) -1H-pirazolo [3,4-b] piridin-3-il] -pirimidin-4-il-amint (BAY 41-2272) a Pharma Research szolgáltatta. Center, Bayer (Wuppertal, Németország). Az Iloprostot Schering (Németország) szállította.
Statisztikai analízis
Az adatokat átlag ± SEM értékként fejezzük ki n patkányok. A csoportok közötti statisztikai szignifikanciát egyirányú ANOVA alkalmazásával, majd Bonferroni teszttel határoztuk meg. Adott esetben párosítatlan Student-féle t-tesztet használtak az egyes csoportok összehasonlításához. Jelentőségét a P
Eredmények
Testtömeg, orális glükóz tolerancia teszt (OGTT) és inzulin tolerancia teszt (ITT)
A magas zsírtartalmú étrenddel (HFD) kezelt patkányoknál a testtömeg és az epididymális zsír jelentősen megnövekedett, összehasonlítva a standard-chow étrendben részesülő állatokkal, körülbelül 20% és 135% (P 1. táblázat A magas zsírtartalmú étrend hatása a testtömegre, az epididymális zsírtömegre és a glükózszintre
ADP- és trombin-indukálta mosott vérlemezke-aggregáció
Az ADP által kiváltott vérlemezke aggregáció (10 μM) szignifikánsan nagyobb volt (P 2. ábra
A NAC és a PEG-kataláz hatása a HFF patkányok vérlemezkék hiperaggregabilitására
A vérlemezkék NAC (1 mM, 3 perc) vagy PEG-kataláz (1000 U/ml, 3 perc) előkezelése nem befolyásolta szignifikánsan a trombin vagy ADP által kiváltott vérlemezke aggregációt SCD patkányokban (n = 4-7; 3. ábra). A NAC és a PEG-kataláz azonban teljes mértékben megakadályozta a thrombin vagy az ADP által kiváltott thrombocyta hiperaggregabilitást a HFD csoportban (3. ábra).
A nátrium-nitroprusszid (SNP), az S-nitrozo-N-acetilpenicillamin (SNAP) és a BAY 41-2271 hatása a vérlemezke aggregációra és a cGMP intracelluláris szintjére
SCD patkányokban az ADP által kiváltott vérlemezke aggregáció nagymértékben csökkent az NO donor SNP-vel történő előzetes inkubálás (10 μM; n = 4) és SNAP (10 μM; n = 5), valamint NO-független oldható guanilil-cikláz stimulátorral, BAY 41-2272 (10 μM; n = 7), amint azt a 4A. Ábra mutatja. Az SNP, SNAP és a BAY 41-2272 által okozott vérlemezke-aggregáció csökkenése 7,0-, 7,6- és 12,3-szoros növekedéssel járt (P 4. ábra
Az iloprost hatása a thrombocyta aggregációra
A vérlemezkék előkezelése iloprosttal (1 μM, 3 perc), egy prosztaciklin analóg, amely közvetlenül hat a cAMP/PKA jelátviteli útvonalon, majdnem megszüntette az ADP által kiváltott vérlemezke-aggregációt, amint azt mind az SCD, mind a HFD patkányokban megfigyelték (n = 4; 2. táblázat). Nem találtunk statisztikai különbséget a kontroll és a HFF patkányok között.
Vita
Jelen tanulmány azt mutatja, hogy a magas zsírtartalmú étrenddel (HFD) táplált patkányok ex-vivo vérlemezke-hiperaggregabilitást mutatnak az ADP és a trombin iránt, ami magasabb intraplatelet ROS-termeléssel jár. A vérlemezkék túlaggregabilitását a PEG-kataláz és a NF antioxidáns vegyületek megakadályozták a HFD csoportban, jelezve az intracelluláris ROS kritikus szerepét ebben a jelenségben. Ezenkívül a NO donor SNP és SNAP, valamint az oldható guanilil-cikláz stimulátor, a BAY 41-2272 alacsonyabb hatékonyságot mutatott a thrombocyta-aggregáció gátlásában HFD patkányokban, valószínűleg ennek következtében az alacsonyabb thrombocyta cGMP-termelés következménye ebben az étrend által kiváltott elhízási modellben.
Trombociták, hiperglikémia és oxidatív stressz
A megnövekedett oxidatív stressz az NO biohasznosulásának csökkentésével is befolyásolhatja a vérlemezkék működését [12]. A nitrogén-oxid egy olyan ROS, amely számos biológiai funkcióban vesz részt, amelyek nélkülözhetetlenek a kardiovaszkuláris rendszerhez és a thrombocyta működéséhez. Ennek megfelelően vizsgálatunkban az NO donorok, az SNP és az SNAP jelentősen csökkentették az ADP által kiváltott vérlemezke aggregációt SCD patkányokban, ami a várt módon a cGMP szintjének jelentős emelkedésével járt. Érdekes módon a HFD patkányokban a vérlemezkék rezisztensek voltak a cGMP-emelkedésre az SNP és SNAP hatására, valamint ezen szerek gátló hatására a thrombocyta-aggregációra. Valószínű, hogy a HFD patkányok vérlemezkeiben az O2 termelésének feleslege inaktiválja az SNP és SNAP eredetű NO-t. Ez összhangban áll az elhízott alanyoknál és a 2-es típusú cukorbeteg elhízott betegeknél végzett vizsgálatokkal, ahol a vérlemezkék ellenállnak a gliceril-nitrátnak és az SNP-nek [33, 34].
A vérlemezkék túlaggregálhatósága és a ciklikus nukleotidok szerepe
Az NO - cGMP - PDE5 út mellett a vérlemezkék aktiválódását gátolják a cAMP-emelő szerek [46]. Az intracelluláris cAMP-szintek megemelkedését az adenilát-cikláz aktiválásával érhetjük el, közvetlenül vagy megfelelően összekapcsolt membránreceptorokon keresztül, valamint a cAMP ciklikus nukleotid-foszfodiészterázok általi hidrolízisének megakadályozásával. Vizsgálatunk során az iloprost (stabil prosztaciklin analóg) cAMP-emelő szer elnyomta az ADP által kiváltott vérlemezke-aggregációt mind az SCD, mind a HFD csoportokban, kizárva, hogy a HFD patkányok hiperaggregabilitása tükrözi a cAMP jelátviteli út változását.
Következtetések
Eredményeink egyértelműen azt mutatják, hogy a patkányok HFD következtében bekövetkező metabolikus rendellenességek a vérlemezkék hiperaggregabilitását okozzák, ami fokozott intraplatelet ROS termelést és csökkent NO biohasznosulást, esetleges hibák kíséretében az sGC protetikus haem csoportjában.
- A Keystone fajok szerepe az ökoszisztéma National Geographic Society-ben
- A megváltozott vese lipid anyagcsere szerepe a magas zsírtartalmú vesekárosodás kialakulásában
- Csendes-óceáni heringfaj-profil, Alaszkai Hal- és Vadminisztérium
- Csendes óceáni laposhal fajprofil, Alaszka Hal- és Vadminisztérium
- Nem tejtermékben erjesztett italok; probiotikum; prebiotikus hordozó szerepe