Agouti: egértől emberig, bőrtől zsírig
Kooperatív Diagnosztikai Kutatóközpont, Queenslandi Műszaki Egyetem, Brisbane, Ausztrália
Kooperatív Diagnosztikai Kutatóközpont, Queenslandi Műszaki Egyetem, Brisbane, Ausztrália
Kooperatív Diagnosztikai Kutatóközpont, Queenslandi Műszaki Egyetem, Brisbane, Ausztrália
Kooperatív Diagnosztikai Kutatóközpont, Queenslandi Műszaki Egyetem, Brisbane, Ausztrália
Absztrakt
Rövidítések
BEVEZETÉS
Két kulcsgén, agouti és kiterjesztés, részt vesznek az egér melaninváltásában. A kiterjesztés gén kódolja a melanokortin 1 receptort (Mc1r), míg a agouti a gén egy 131 aminosavfehérjét kódol, amely egy szignálpeptidből, glikozilezési helyből, egy bázikus doménből és egy ciszteinben gazdag C-terminálisból áll (1). A agouti gént számos fajban feltérképezték és izolálták. Kimutatták, hogy szerepet játszik juhok, standard ezüst róka és patkányok szőrének meghatározásában, és sertésben is izolálták (2-7). Az emberi homológ agouti a 20. kromoszómán helyezkedik el, és 132 aminosavfehérjét, agouti szignálfehérjét (ASIP) kódol (8, 9). A nagyfokú fehérjehomológia (az egerekkel megegyező aminosavak 80% -a) ellenére az expressziós mintázat meglehetősen eltérő. Agouti újszülött egerekben általában a szőrtüszőkben fejeződik ki, és nem agouti expresszió számos egér felnőtt szövetben található meg, beleértve az agyat, a májat, a tüdőt, a lépet és a vesét, bár kifejeződik a here heréjében (1). Emberben, EGY KORTY a herében, valamint a petefészekben, a szívben, a zsírszövetben és alacsonyabban a májban, a vesében és a fitymában is kifejeződik (8, 9).
Ez a felülvizsgálat elsősorban az ASIP emberben betöltött szerepével foglalkozik, valamint azzal, hogy az expresszió hogyan befolyásolja a pigmentációt és az elhízást. Bár van némi megértésünk arról a szerepről, amelyet az agouti játszik az egérben, az ASIP szerepét az emberekben még nem határozták meg. Ezen áttekintés során az egér gént a következőként emlegetjük agouti mivel emberi ortológusára a továbbiakban hivatkozunk EGY KORTY. A fehérjét egoutként agoutinak, az embereknél ASIP-nek fogják nevezni.
PIGMENTÁLÁS
A pigmentációs markerek szabályozása Agouti által
Az egerek által jelzett α-Melanocita stimuláló hormon (α-MSH) vagy az agouti a Mc1r-en keresztül szabályozza a termelt melanin típusát. α- Az MSH és Mc1r kölcsönhatása eumelanin termelést eredményez, és ennek az interakciónak az agouti antagonizmusa feomelanin termelést eredményez. Három új gént találtak feljebb az agouti fehérje, köztük egy potenciális DNS-replikációs kontroll fehérje (minikromoszóma fenntartó fehérje, MCM6), egy alapvető spirál-hurok-spirál transzkripciós faktor (immunglobulin transzkripciós faktor 2, ITF2) és a retina sejtjeiben expresszálódó, ismeretlen funkciójú gén (10). Az agouti fehérje szintén szabályozza a géneket, hogy gátolja az eumelanin szintézist. Az egér melanocitáinak kezelése agouti fehérjével csökkent gének expresszióját eredményezi, mint pl, tirozinázzal kapcsolatos fehérje 1 (Tyrp1) és dopachrom-tautomeráz (Dct) és kisebb mértékben, tirozináz (11) Az expozíciót követően α-MSH, tirozináz expresszió növekedett a melanocitákban, de ennek hatása nem volt nyilvánvaló Tyrp1 vagy Dct. Hasonló hatások tapasztalhatók az egér melanoma sejtvonalainál (12).
Az ASIP szerepét az emberek pigmentációjában még nem vizsgálták alaposan. In vitro vizsgálatok kimutatták, hogy az emberi ASIP az egér agouti fehérjéhez hasonló módon működik, mivel lefelé szabályozza a melanin géneket, amelyek az emberi melanocitákban szabályozzák az eumelanin szintézist (13). Ez arra utal, hogy az ASIP szerepet játszik az emberi pigmentációban, azonban további vizsgálatokra van szükség annak meghatározásához, hogy a bőr melyik sejttípusa expresszálódik EGY KORTY és ha az ASIP megváltoztatja más pigmentációs gének expresszióját. A fotovédelemben és a kockázati tényezők azonosításában fontos annak a biokémiai mechanizmusnak a jellemzése, amely miatt a gének átállnak a feomelanin termelésére.
Agouti és MC1R
A melanokortin 1 receptor az egyetlen gén, amely az emberek hajszínének normális variációjával jár. Változatai a MC1R gén (R151C, R160W, D294H, R142H, 86insA és 537insC) a világosabb bőrtípushoz és a vörös hajhoz kapcsolódik (14-18). Egy másik lokusznak a vörös haj öröklésében való részvételét bizonyítja, hogy vannak olyan vörös hajúak, amelyeknél nincs MC1R variánsok (14, 17) és néhány dizigótikus ikerpár összhangban vannak MC1R variáció, de a hajszín szempontjából ellentmondásos (16). Az emberi variáció a haj és a bőr pigmentációjában a következők kombinációjából származhat EGY KORTY és MC1R allélok, mint például a német juhászkutya (19) esetében, némelyikkel MC1R az ASIP-vel eltérő módon kölcsönhatásba lépő variánsok az eumelanin és a feomelanin termelésének eltérő arányát eredményezik.
Agouti mutációk
Recesszív agouti Az egér mutációi az eumelanin fokozódásával és a feomelanin termelés csökkenésével járnak, és magukban foglalják nem agouti (a), fekete és barnás (nál nél ), halálos nem agouti (a x ), nem agouti halálos (a l ), tanoid (a td ) és extrém nem agouti (a e ) (29-31). A mai napig nem EGY KORTY emberben polimorfizmusokat azonosítottak. Meghatározott etnikai csoportok polimorfizmus-vizsgálata, amely a bőr és a haj pigmentációjában változó, nem mutatott ki polimorfizmust a EGY KORTY kódoló régiót, és szintén nem mutatott polimorfizmust a MC1R a fenotípusokkal ellentétes genotípusok (32). Ez nyitva hagyja annak lehetőségét, hogy az emberi pigmentációval összefüggő polimorfizmusok létezzenek a nem kódoló régióban EGY KORTY.
Agouti kifejezés
Az Agouti az egér vad típusú szőrzetszíne, amelyet szubapikális sárga hegyű fekete haj jellemez. Átmeneti kifejezése agouti az eumelanin feomelaninra váltását eredményezi a hajciklus 4–6. napjától, és a 6. nap után visszatér az eumelaninhoz. A feomelanin termelésére való átállást a nők agouti antagonizmusa szabályozza. α-MSH jelzés Mc1r-en keresztül (33). Az agouti egér bőrének immunhisztokémiai vizsgálata magas szintű fehérje expressziót mutatott ki a 6 napos vadtípusban agouti egerek, de nem nem agouti egerek. Heterozigóta halálos sárga egereknél az expresszió szintje korrelált a szőrzet színintenzitásával, jelezve, hogy az agouti fehérje a follikuláris melanocitában helyezkedik el, ahol stimulálja a feomelanin termelést és gátolja az eumelanin termelést (34, 35). Transzgenikus egerek expresszálják agouti a bazális epidermális sejtekben sárga hajszálak alakulnak ki, amelyek megfelelnek az epidermális régióinak agouti expresszió, ami az agouti fehérje működését sugallja parakrin módon az egérben (36).
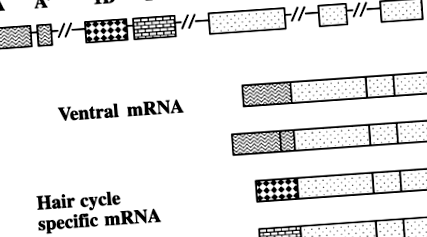
Agouti a fenotípusok egyetlen kódoló szekvenciából származnak, alternatív promóterek által szabályozva, amelyek egymástól függetlenül szabályozzák a hátsó és a hasi szőrzet színét (29, 37) (1. ábra). A hajspecifikus promóter a hajciklus 4–6. Napjától aktiválódik a háti és a hasi bőrben egyaránt, és a jellegzetes szubapikális sárga hegyet eredményezi. A ventrális specifikus promoter az egész hajciklus alatt aktiválódik, ami sárga hajat eredményez, de csak a ventrumban. A hajspecifikus promótert érintő mutációk, mint pl fekete és barnás (nál nél ) sárga hasú és fekete hátsó egereket eredményeznek.
Alternatív agouti promóterek. Vrieling és mtsai. (37) 5 napos egerek teljes bőr RNS-jéből izolált cDNS. A cDNS-klónok többsége három kódoló exont és egy nem transzlált 5'-exont tartalmazott. Néhány klónnak azonban más volt az 5 ′ vége. Ennek kivizsgálására cDNS-t izoláltak egynapos könnyű hasú hasi bőr RNS-ből agouti egerek. Négy RNS-izoform volt jelen. Az 1A és az 1A 'exon ~ 120 kb-rel helyezkedik el a 2-es exon előtt, és csak a agouti mRNS a ventrális bőrből. Az 1B és 1C exonok (szőrspecifikusak) ~ 16 nukleotidot választanak el egymástól, és körülbelül 18 kb-tal helyezkednek el a 2 exontól.
A MELANOCORTIN RECEPTOROK ANTAGONIZMUSA
A melanokortin receptorok agonizmusa és antagonizmusa. Adrenokortikotrop hormon (ACTH), α-Melanocita stimuláló hormon (α-MSH) és γ-MSH a melanokortin receptorok ligandumai; a humán agouti szignálfehérje (ASIP) különböző mértékben antagonizálja mind az öt melanokortin-receptort. A humán ASIP az MC1R és az MC4R erős antagonistája és az MC2R, MC3R és MC5R gyenge antagonistája, amint azt a szaggatott vonalak jelzik. A melanokortin-receptorok együttesen széles körben expresszálódnak, és szabályozzák a pigmentációt, a lipolízist, az ételbevitelt, a termogenezist, a szexuális viselkedést, az emlékezetet, a gyulladáscsökkentő és a lázcsillapító hatásokat.
Agouti és Attractin
A demonstráció, hogy az egér mahagóni és a patkány zitter mind az atraktint kódoló lokuszok spekulációkhoz vezettek e fehérje szerepéről és az agoutival való kölcsönhatásáról. Az egér mahagóni mutáció, a közelmúltban átnevezték Atrn mg, elnyomja a szőrzet sárga színét és elhízását A y egerek, amelyek azt sugallják, hogy az agouti szignalizáció downstream közvetítője (52-54). Atrn feltételezik, hogy a melanocortin receptoroktól felfelé hat, mivel nem képes visszafordítani a Mc1r és Mc4r knockout egerek (53-55). A homozigóta egerek Atrn mg és a funkcióvesztés Mc1r e az allél fenotípusosan nem különböztethető meg a homozigótától Mc1r e egerek megerősítve ezt Atrn genetikailag feljebb van Mc1r. Míg Atrn mg elnyomja az elhízás fenotípusát Mc4r hiányos egerek, nem nyomja el a leptin receptor mutációi által okozott elhízást (Lepr db ), karboxipeptidáz E (cpe zsír ) vagy pocakos jelezve, hogy az Atrn fehérje bizonyos specifitással működik a melanokortin szignálútban.
ELHÍZOTTSÁG
Egér modell
Újabban a Mc3r szerepe szerepet játszik a testtömeg-szabályozásban. Mc3r a knock-out egereknél nagyobb a zsírtömeg, csökkent a sovány tömeg és nagyobb az etetési hatékonyság, mint a vad típusú egerekben (61). Ezenkívül mindkettőnek kieső egerek Mc3r és Mc4r lényegesen nagyobb súlyt nyerjen a Mc4r kieső egerek. Úgy tartják Mc4r a kieső egerek etetése fokozott és Mc3r és Mc4r a kieső egerek hatékonyabban tárolják a kalóriákat.
Agouti-hoz kapcsolódó fehérje (Agrp)
An Agouti-kapcsolódó fehérje (Agrp) A cDNS-t szekvencia-homológia révén azonosítottuk agouti (62, 63). Mint agouti, Agrp egy melanokortin receptor antagonistát kódol, amely antagonizálja Mc3r és Mc4r (63). Valószínű, hogy Agrp a Mc3r és Mc4r természetes antagonistája, mivel a hipotalamuszban kifejeződik. Az Agrp-t túlzottan expresszáló transzgénikus egereknél elhízás alakul ki, és hasonló fenotípusaik vannak az agouti transzgenikusokkal szemben (63), de nem alakul ki sárga szőrzetük, mivel az Agrp nem antagonizálja a Mc1r-t. Ezenkívül az Agrp beadása serkenti az etetést, utánozva a Mc3r és Mc4r antagonisták hatását (64).
Az adipocitás szabályozása Agouti által
A leptin hormon a zsírszövetben termelődik, és az agyba kering, ahol a leptin receptorhoz kötődik, jelezve az élelmiszer-bevitel csökkenését és az energia-anyagcsere növekedését, ezáltal korlátozva az elhízás mértékét (67, 68) (3. ábra). A zsírszövetben a leptin szintje megnő agouti transzgenikus egerek, ami arra utal, hogy az agouti kölcsönhatásba léphet más elhízási géntermékekkel, hogy kulcsszerepet játsszanak a súlyszabályozásban (69). Az Agouti bizonyítottan részt vesz a leptin szabályozásában a halálos sárga egérben (69).
Az MC4R antagonizmusa emberekben. α-A melanocita stimuláló hormon (α‐MSH) a hipotalamuszban kötődik az MC4R-hez, szabályozva az energia homeosztázisát. A hipotalamuszban is expresszált AGRP antagonizálja az MC4R-t, megváltoztatva a súlyszabályozást. Az emberekben a zsírszövetben általában expresszálódó agouti szignálfehérje (ASIP) szintén antagonizálhatja az MC4R-t, ami energiaháztartást eredményez.
A magas szintet expresszáló transzgénikus egerek testtömege agouti zsírszövetben és a többi szövet alacsony szintje változatlan (70). Mindazonáltal, ha napi inzulininjekciókat kaptak, a súlygyarapodás jelentős növekedését tapasztalták, ami arra utal, hogy az inzulin által kiváltott súlygyarapodás agouti útján történik. Valószínű, hogy az agouti méhen kívüli expressziója a hasnyálmirigyben stimulálja az elhízott sárga egér inzulin felszabadulását. Érdemes megjegyezni, hogy az emberek általában expresszálnak EGY KORTY a zsírszövetben (8, 9) és a hasnyálmirigy alacsonyabb szintjén (71), ami azt jelzi, hogy az ASIP és az inzulin együttesen szabályozhatják az emberek zsírosságát.
Az agouti fehérje kalcium jelzéssel stimulálja a zsírszövet lipogenezisét (71). A rekombináns agouti fehérje dózisfüggő növekedést okoz az intracelluláris kalciumkoncentrációban az egér és az emberi adipocitákban, jelezve az inzulin felszabadulását (75, 76). Ezen kívül hasnyálmirigyben β- a sejtvonalak, valamint az emberi hasnyálmirigy-szigetek, az agouti fehérje megemelte a kalciumszintet és az inzulin felszabadulást, ami arra utal, hogy az ASIP működhet az inzulinszabályozásban emberben (77).
Agouti és Attractin az elhízásban
Mutációk az egérnél Atrn vagy a patkány zitter a lokusz olyan fenotípust eredményez, amelyben az állatok neurológiai rendellenességeket mutatnak, mint testremegés, valamint a központi idegrendszer (CNS) progresszív hypomyelinációja és vakuolizációja. Ismert tény Atrn az etetést és az anyagcserét függetlenül ellenőrzi agouti elnyomás (52). Atrn mutáns egerek többet esznek, mint a normál egerek, de nem híznak, valószínűleg azért, mert fokozott az anyagcseréjük és a motoros aktivitásuk (52, 54). Érdekes módon az egyetlen rendellenes hatás, amelyet He et al. a központi idegrendszeren kívül Atrn mg ‐ 3J a homozigóta egereknél csökkent a zsírtartalom mind a barna, mind a fehér zsírszövetben (78).
A legújabb tanulmányok kimutatták, hogy az Atrn az agouti receptorai, az Agrp azonban nem. Az Atrn kölcsönhatása az agouti N terminális régióján keresztül megy végbe, amelynek szekvenciája homológiailag alacsony az Agrp-val, míg a melanokortin receptor kölcsönhatása a C-terminális régión keresztül történik, amely jelentős szekvencia homológiával rendelkezik az Agrp-val. Az in vitro és in vivo kísérletek azt mutatják, hogy Atrn elnyomja az agouti által kiváltott elhízást, de nem az Agrp által kiváltott elhízást (78). Ezek az eredmények azt sugallják, hogy az agouti N-terminális régiójához Atrn-kötődés szükséges a Mc1r-en keresztül közvetített agouti fehérjeszignalizációhoz. Az atrn és az agouti kötődése szintén kritikus lehet az agyban a Mc4r jelátvitel szempontjából.
Míg az egérben az agouti általában nem expresszálódik a zsírszövetben, és ezért valószínűleg nem játszik szerepet a normál energia homeosztázisában, EGY KORTY emberi zsírszövetben fejeződik ki. Az ASIP szerepe az energia homeosztázisban szerepet játszik az atraktin és a melanokortin jelátviteli útján történő jelzésben. További vizsgálatokra van szükség az emberben az Atrn és a melanokortin receptorok közötti pontos kölcsönhatások meghatározásához.
Emberi modell
Az ASIP lehetséges szerepe emberben az energia homeosztázisának szabályozása az MC4R antagonizmusával. Amint fentebb említettük, a Mc4r kulcsszerepet játszik az etetés szabályozásában Mc4r a knock-out egerek a kontrollokhoz képest elhízottak és heterozigóta Mc4r a knock-out egerek közepes testtömegűek, a nőstények hajlamosabbak a súlygyarapodásra (79). A funkcióvesztés mutációi MC4R elhízott embereknél is azonosítottak (80, 81). 63 elhízott gyermekből álló kohorszban [átlagos testtömeg-index (BMI), 34 kg/m 2] egy alany heterozigóta volt egy 4 bp-os delécióval, ami nem funkcionális receptort eredményezett. Ugyanezt a mutációt domináns módon örökölték az elhízott apától (BMI, 41 kg/m 2).
Az emberi elhízás valószínűleg számos gén ritka mutációiból származik. MC4R egy ilyen génnek tűnik, mivel elhízott egyéneknél magas a mutációk elterjedtsége. Az elhízott egyének nagy francia populációjában (n = 209) 4% -uk ritka heterozigóta MC4R mutációt hordozott, míg ugyanezeket a mutációkat egyik nem elhízott kontrollban sem találták (n = 254) (82). Az MC4R polimorfizmusai a genetikai elhízás eddigi leggyakoribb okai.
Mutációk Pre-ProOpiomelanocortin (POMC), a prekurzor fehérje α- Az MSH-t elhízással is összefüggésbe hozták. Két egymással nem rokon személyről kiderült, hogy a POMC gén, mellékvese-elégtelenség, vörös haj és korai elhízás (83). A mellékvese elégtelenségét valószínűleg az MC2R jelátvitel hibája okozza, a vörös haj az α‐MSH kötődése az MC1R-hez és az MC4R jelátviteli hibák által okozott elhízás. Ezenkívül az egereknek hiányoznak a POMC-eredetű peptidek (ACTH, α-, β-, és γ-MSH és β‐Endorfin) fenotípusai hasonlóak az emberhez POMC mutánsok, beleértve az elhízást, a mellékvese elégtelenségét és a sárga kabátot (84). Kezelés a α-MSH agonista csökkentette az elhízást ezekben az egerekben, jelezve a melanokortinek lehetséges terápiás alkalmazását az elhízás kezelésében. Nem valószínű, hogy a POMC az elhízás gyakori okai az embereknél, mivel 96 elhízott beteg mutációs szűrése nem mutatott ki elhízással járó polimorfizmusokat (85).
Az egér sárga elhízott modellje különösen hasznos az emberi elhízás tanulmányozásában, részben azért, mert egy új szövetben (például zsírban vagy hipotalamuszban) történő expresszió Mc4r antagonizmusához vezet. A mai napig nem számoltak be polimorfizmusról EGY KORTY és összefüggése az emberek elhízásával. Emberi mutációk, amelyek mindenütt jelen vannak EGY KORTY expresszió az MC4R krónikus antagonizmusát eredményezheti a hipotalamuszban, megzavarva annak funkcióját a súlyszabályozásban (3. ábra). Az is lehetséges, hogy vad típusú EGY KORTY közvetlen szerepe lehet az emberek zsíranyagcseréjében, mivel mindkettő EGY KORTY és MC4R zsírszövetben fejeződnek ki.
KÖVETKEZTETÉSEK
Lábjegyzetek
Köszönetnyilvánítás
Ezt a munkát a diagnosztikai technológiákkal foglalkozó kooperatív kutatóközpont támogatta a JV-nek. A szerzők köszönetet mondanak Phillip Morris docensnek, Dr. Flavia Huygensnek és Dr. Adele Millisnek a kézirat kritikai felülvizsgálatáért.
- Basal Cell Carcinoma figyelmeztető jelek és képek - The Skin Cancer Foundation
- Basal Cell Carcinoma - Bőrbetegségek - Merck Manuals Consumer Version
- Hajdina allergia - Wieslander - 2001 - Allergia - Wiley Online Könyvtár
- American Journal of Agricultural Economics - Wiley Online Könyvtár
- Alkalmazott gazdasági perspektívák és politika - Wiley Online Könyvtár