Alacsony szénhidráttartalmú és magas zsírtartalmú étrendet fogyasztó patkányok glükóz toleranciájának megsértése
Endokrin kutató egység, Medizinische Klinik und Poliklinik IV, Klinikum der Ludwig-Maximilians-Universität (LMU), München, Németország;
Az újranyomtatási kérelmek és egyéb levelezés címe: M. Bielohuby, Klinikum der Universität München, Medizinische Klinik und Poliklinik IV, Endokrin Kutatóegység, Ziemssenstrasse 1, 80336 München, Németország (e-mail: [email protected]).
Cincinnati Gyermekkórház Orvosi Központ, Cincinnati, Ohio;
Metabolikus Betegségek Intézete, Orvostudományi Főiskola, Cincinnati Egyetem, Cincinnati, Ohio;
Klinikai Állatorvosi Központ, Állatorvosi Patológiai Intézet, LMU, München, Németország;
Endokrin kutató egység, Medizinische Klinik und Poliklinik IV, Klinikum der Ludwig-Maximilians-Universität (LMU), München, Németország;
Nephrologisches Zentrum, Medizinische Klinik und Poliklinik IV, Klinikum der LMU, München, Németország; és
Endokrin kutató egység, Medizinische Klinik und Poliklinik IV, Klinikum der Ludwig-Maximilians-Universität (LMU), München, Németország;
Endokrin kutató egység, Medizinische Klinik und Poliklinik IV, Klinikum der Ludwig-Maximilians-Universität (LMU), München, Németország;
Cukorbetegség és elhízás Intézete, Helmholtz Egészségügyi és Környezetvédelmi Központ és Műszaki Egyetem, München, Németország
Klinikai Állatorvosi Központ, Állatorvosi Patológiai Intézet, LMU, München, Németország;
Cukorbetegség és elhízás Intézete, Helmholtz Egészségügyi és Környezetvédelmi Központ és Műszaki Egyetem, München, Németország
Metabolikus Betegségek Intézete, Orvostudományi Főiskola, Cincinnati Egyetem, Cincinnati, Ohio;
Endokrin kutató egység, Medizinische Klinik und Poliklinik IV, Klinikum der Ludwig-Maximilians-Universität (LMU), München, Németország;
Absztrakt
Állattenyésztés
Diéta összetétele és étrendi csoportok
Dinamikus tesztek a szőlőcukor-tolerancia értékelésére párosított patkányokban
3 hét múlva a megfelelő étrenden a patkányokat több csoportra osztották orális glükóz tolerancia tesztek (OGTT), intraperitoneális glükóz tolerancia tesztek (IPGTT) és ITT céljából. Minden dinamikus teszthez egy új patkánycsoportot használtunk (5-6 patkány/diéta csoport és dinamikus teszt). Az OGTT és az IPGTT esetében a patkányokat 16-18 órás böjt után lemértük. Ezt követően egy 2 g/testtömeg testtömeg frissen elkészített 50% -os glükózoldatot adtunk be szájon át egy szondán keresztül vagy intraperitoneálisan (ip). Vérmintákat vettünk a farokvénából a kiinduláskor és 15, 30, 60, 120 és 180 perccel a glükóz-provokáció után (ezen felül 5 perc múlva az IPGTT-k esetében). Az ITT-k esetében a patkányokat 6 órán át éheztettük, és 0,75 U inzulint/testtömeg-kg-ot injektáltunk hozzájuk (ip).
Hiperinzulinémiás euglikémiás bilincs kísérletek
A kísérleti eljárások részletes leírását másutt publikálták (45). Röviden, az éjszakán át éheztetett patkányok a kísérleti időszak alatt eszméletlenek voltak és féktelenek voltak. A vizsgálat reggelén a patkányokat lemértük, és az exteriorizált katétereket meghosszabbítottuk a hozzáférés megkönnyítése érdekében. A glükóz kinetika méréséhez egy előkalibrált, nagy teljesítményű folyadékkromatográfiával tisztított [3- 3 H] glükóz (Perkin-Elmer Life Sciences, Boston, MA) alapozott (26 μCi) állandó (0,26 uCi/perc) infúzióját adtuk be. infúziós szivattyú (Harvard Apparatus, South Natick, MA) 0–120 percnél. 120–240 perc múlva a [3- 3H] glükóz infúzióját 0,53 μCi/min-re növeltük, hogy az állandó fajlagos aktivitás fennmaradjon. 155–240 perc alatt előre kitöltött (56 pmol · kg –1 · min –1) folyamatos (28 pmol × kg –1 · min –1) inzulininfúziót (Eli Lilly, Indianapolis, IN) adtunk be egy előre kalibrált infúzióval. szivattyú (Harvard Apparatus). Változó sebességű, 50% -os dextróz infúzióval a vércukorszint ~ 7,7 mmol/l volt. A kísérleti periódus alatt 5–10 percenként vért vettünk a vércukorszint mérésére, a kísérleti periódusban 10 percenként a [3- 3H] glükózszintre, és 140-szer és 240 perc a plazma inzulinszintjét.
Patkányok boncolása
4 hét múlva a megfelelő étrenden a patkányoknak 1 órán keresztül hozzáférést kaptak az élelemhez a világítás után, majd 6 órán át éheztünk (a gyomor-bélrendszeri töltés standardizálása érdekében), majd rövid izoflurán érzéstelenítés mellett lefejezték. A törzsvért további elemzés céljából összegyűjtöttük, és a centrifugált EDTA plazma mintákat az elemzésig -80 ° C-on tároltuk. A patkányokat feldaraboltuk, és a májat, az epididymális, az inguinalis és a perirenalis zsírpárnákat (mindegyik zsírpárnának csak az egyik oldala) és a hasnyálmirigyet kivágtuk, gondosan kiszabadítottuk a tapadó szövetekből, és 0,1 mg pontossággal lemértük őket (Scaltec Instruments, Goettingen, Németország ). Szövetminták M. gastrocnemius vettük, és azonnal szárazjégen tároltuk (Oil Red O festés), vagy azonnal 4% paraformaldehidben rögzítettük (a GLUT4 expresszióhoz). Végül az összes megmaradt szervet eltávolítottuk, és a bőrt előkészítettük a tetemtől (azaz sovány masszától) mentesen. Ezután a tetemet lemérték. A máj- és zsírpárnák relatív súlyát úgy számítottuk ki, hogy a szervtömegeket elosztottuk a patkányok testtömegével. A kontrollok relatív súlyát 100% -ra állítottuk be, és az LC-HF csoportok szervtömegét a chow kontrollok százalékában fejeztük ki.
A vér glükóz-, lipid- és keringési anyagcsere-hormonjainak mérése
Az összes vérmintát a korábban ajánlottak szerint kezelték, dolgozták fel és tárolták (8). A dinamikus vizsgálatok során az éhomi vércukorszintet és a glükózt glükóz-oxidáz módszerrel (EcoSolo; Care Diagnostica, Voerde, Németország) mértük. A plazma triglicerideket, valamint a teljes és HDL-koleszterint automatizált rendszerrel (Cobas Integra 800; Roche Diagnostics, Mannheim, Németország) mértük. A plazma inzulint, C-peptidet (Alpco, Salem, NH), rezisztint (Bertin Pharma, Montigny le Bretonneux, Franciaország) és glükagont (Wako Chemicals, Neuss, Németország) kereskedelemben kapható (patkányokra specifikus) készletek alkalmazásával elemeztük. a gyártó utasításait. Az összes plazma glükózfüggő inzulinotróp polipeptidet (GIP; Merck Millipore, Billerica, MA) proteáz inhibitor koktéllal (Complete; Roche, Mannheim, Németország) és egy specifikus dipeptidil peptidáz IV inhibitorral (Merck Millipore) stabilizált mintákban mértük.
A hasnyálmirigy kvantitatív sztereológiai és morfometriai elemzése
Intramyocelluláris lipidek, izomtriglicerid tartalom és csontváz GLUT4 expressziójának kimutatása immunhisztokémiai úton
A p-p70 S6 kináz expressziójának elemzése
Legalább 40 μg fehérje (májból és citromból kivont) M. quadriceps minták) SDS-PAGE segítségével felbontottuk, majd PVDF membránra vittük át, amelyet metanollal előkezeltünk 1 percig. A membránokat 3% száraz tejet tartalmazó TBST (Tris-pufferolt sóoldat és 0,1% Tween-20) oldatban blokkoltuk 60 percig, állandó keverés közben. Blokkolás után a PVDF membránt a p-p70 S6 kináz (Thr 389; New England Biolabs, Frankfurt am Main, Németország) ellen irányított primer nyúlantitesttel (1: 1 000 hígítás TBST-ben) inkubáltuk egy éjszakán át 4 ° C-on. A membránokat 10–20 ml TBST-ben (háromszor 5 percig) mostuk, és 1 órán át inkubáltuk nyúlellenes IgG torma-peroxidázzal konjugált másodlagos antitesttel szobahőmérsékleten 1: 2 000 hígítás mellett, állandó keverés mellett, fokozott kemilumineszcencia előtt (Thermo, Schwerte, Németország) és a film expozíciója.
Statisztikai analízis
A statisztikai elemzéseket a GraphPad Prism (5. verzió; GraphPad Software, La Jolla, CA) segítségével végeztük. A három étrendi csoport statisztikai összehasonlításához Kruskal Wallis nemparametrikus ANOVA elemzését végeztük a későbbi Dunn többszörös összehasonlító tesztekkel. P értékek
1. táblázat: Testtömeg, szervtömeg, keringő éhomi vér lipidek és glükóz, valamint a plazma hormon koncentrációja patkányokban, amelyek 3 különböző étrend izoenergetikus mennyiségét táplálták
Az adatokat átlag ± SE értékként adjuk meg. LC-HF-1, 1. alacsony szénhidráttartalmú, magas zsírtartalmú étrend; LC-HF-2, 2. alacsony szénhidráttartalmú, magas zsírtartalmú étrend; GIP, gyomor-gátló peptid.
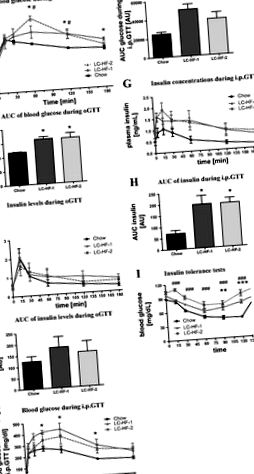
1. ábra.Glükóz és inzulin tolerancia tesztek. Vércukor- és plazma inzulinszint [és a görbe alatti terület (AUC)] azoknál a patkányoknál, akik a megfelelő étrend izoenergetikus mennyiségét táplálták 3 hétig az orális glükóz-tolerancia teszt (OGTT; A-D) és intraperitoneális glükóz tolerancia teszt (IPGTT; E-H). én: glükózkoncentráció patkányoknál, akik 3 hétig izomergetikus mennyiségben táplálták a megfelelő étrendet inzulin tolerancia teszt során (0,75 U inzulin/testtömeg-kg). Fekete, kontroll chow (CH) étrend; szürke és folytonos vonal, „Atkins-féle” alacsony szénhidráttartalmú/magas zsírtartalmú (LC-HF) diéta (LC-HF-1); szürke és szaggatott vonalú, ketogén LC-HF-2 diéta. Az adatokat átlag ± SE értékként adjuk meg. A különböző szimbólumok jelentős különbségeket jeleznek a chow-val etetett kontrollokhoz képest az egyes időpontokban (CH vs. LC-HF-1: *P
A keringő glükózszint minden diétacsoportban 2 órával az ITT megkezdése után csökkent (1. ábraén). A chow-vel táplált patkányokkal összehasonlítva azonban az ITT során a glükóz csökkenése jelentősen késleltetett azoknál a patkányoknál, akik LC-HF diétát fogyasztottak. Ezen túlmenően, az inzulin-provokáció lényegesen alacsonyabb glükózszintet eredményezett 120 perccel az inzulin beadása után a chow-vel táplált patkányoknak (chow, 42,7 ± 1,7 mg/dl; LC-HF-1, 75 ± 3,6 mg/dl; LC-HF-2 (93,1 ± 6,5 mg/dl). Nem volt szignifikáns különbség az LC-HF-1 és az LC-HF-2 csoportok között. Ahogy az várható volt, a keringő glükózszint minden csoportban ismét emelkedett 6 órával az exogén inzulinterhelés után.
Hiperinzulinémiás euglikémiás bilincsek.
A szorító kísérletek utolsó 30 percében minden patkányban állandó glükózkoncentrációt értek el (2. ábraA). A várakozásoknak megfelelően a keringő inzulin koncentrációja minden étrendi csoportban több mint kétszeresére nőtt a szorító végén, összehasonlítva a kiindulási értékkel (inzulin infúzió előtt; az adatokat nem közöljük). A glükóz infúzió sebessége körülbelül háromszor nagyobb volt a chow-val táplált patkányokban, összehasonlítva mindkét LC-HF diéta csoporttal, ami az egész test inzulinrezisztenciáját jelzi az LC-HF táplált csoportokban (P
2. ábra.Hiperinzulinémiás euglikémiás bilincsek patkányoknál 3 hétig izoenergetikus mennyiségű etetéssel. A: vércukorszint a hiperinsulinémiás euglikémiás bilincsek alatt. B: glükóz infúziós sebesség a hiperinsulinémiás euglikémiás bilincsek alatt. C: a glükóztermelés változása. D: glükóz clearance. Fekete, CH diéta; szürke a folytonos vonalakon, Atkins-féle LC-HF-1 diéta; szaggatott vonalakon szürke, ketogén LC-HF-2 diéta. Az adatokat átlag ± SE értékként adjuk meg. * és # Jelentős különbségek a kontroll chow-val összehasonlítva. *P
Kalória korlátozás LC-HF diétákkal
Ahogy az várható volt, az LC-HF diéták napi energiafogyasztásának csökkentése a páros táplálkozású csoportok által elfogyasztott mennyiség 80% -ára alacsonyabb testsúlyt eredményezett, összehasonlítva a chow- és a pár-etetett csoportokkal. Sőt, a kalória 80% -os korlátozásával a zsírtömeg mindkét LC-HF étrendcsoportban nem különbözött a megfelelő chow-táplált kontroll patkányokétól (2. táblázat). Az éhomi glükóz és az inzulin koncentrációja tovább csökkent az LC-HF csoportokban, 80% kalória-korlátozással, szemben a 100% páros táplálású LC-HF csoportokkal (2. táblázat). A kalória-korlátozott LC-HF-1 és LC-HF-2 csoportok között nem észleltünk szignifikáns különbséget a test és a szerv tömegében, illetve az éhomi glükózban és inzulinban. Az OGTT során mindkét kalóriatartalmú LC-HF étrendcsoport nagyobb növekedést mutatott a maximális glükózkoncentrációban a chow-hoz képest. Különösen kifejezett volt a különbség LC-HF-2-vel etetett patkányokban, ami szintén szignifikánsan magasabb AUC értéket eredményezett a glükóz számára az OGTT során [chow, 12 986 ± 801; LC-HF-1 (80%), 15 662 ± 1111; LC-HF-2 (80%), 23 809 ± 1 485; CH vs. LC-HF-1 (80%), P = 0,087; CH vs. LC-HF-2 (80%), P
2. táblázat: Testsúlyok, sovány testtömeg, zsírpárnák súlya, valamint a keringő éhomi vércukorszint és plazma inzulin patkányokban csak a páros táplálású LC-HF csoportoknak adott adag 80% -át táplálták (chow ad libitum)
Az adatokat átlag ± SE-ként adjuk meg.
* P ** P
3. ábra.OGTT-k patkányokban, amelyeket a páros táplálású LC-HF étrend-csoportok 80% -ával tápláltak. Vércukorszint (A) és a plazma inzulin (B) koncentrációk OGTT alatt patkányokban, akik a megfelelő LC-HF-étrendet kalóriakorlátozás mellett (80%) táplálták 3 hétig (chow 100% -ig táplálva). Fekete, CH diéta; szürke a folytonos vonalakon, Atkins-féle LC-HF-1 diéta; szaggatott vonalakon szürke, ketogén LC-HF-2 diéta. Az adatokat átlag ± SE-ként mutatjuk be. #P
Hasnyálmirigy-morfológia és proliferatív/apoptotikus index
Az összes hasnyálmirigy-térfogat alacsonyabb volt az LC-HF-1-ben (−21%, P −6): chow, 1,84 ± 0,76; LC-HF-1, 1 ± 1,23; LC-HF-2, 1,18 ± 1,05; n = 5/csoport; nem jelentős]. Hasonlóképpen nem volt szignifikáns különbség a β-sejtek proliferációjának markerként β-sejtterületenként számított PCNA-pozitív magprofilok számában (chow, 17,3 ± 12,2; LC-HF-1, 11,6 ± 6,2; LC-HF- 2, 22,6 ± 18,5; látható számok × 10-6; n = 5/csoport; nem jelentős).
4. ábra.A hasnyálmirigy és a sziget morfológiája. Hasnyálmirigy térfogata (A), a teljes β-sejt térfogata (B) és a hasnyálmirigy β-sejtjeinek térfogatsűrűsége (normalizálva a hasnyálmirigy térfogatára és testtömegére; C) kvantitatív sztereológiai módszerekkel meghatározva hasnyálmirigy-metszetekben patkányokból, amelyek 4 hét múlva megfelelő tápoldatok izoenergetikus mennyiségét táplálták. D: alacsonyabb β-sejttömeg patkányoknál, akik LC-HF táplálékkal táplálták (barnás szín: inzulin). Fekete rudak, CH diéta; sötétszürke rudak, Atkins-féle LC-HF-1 diéta; világosszürke oszlopok, ketogén LC-HF-2 diéta. ** P
Intramyocelluláris lipidek és GLUT4 expresszió meghatározása
Úgy tűnik, hogy az LC-HF-étrendet páros tápláló patkányok Oil Red O-val festett csontvázizom-szakaszai (m. Gastrocnemius) több intramyocelluláris lipidet tartalmaznak, mint a chow-vel táplált patkányok (5. ábraA). A lipidcseppek nagyobbak és nagyobbak voltak mindkét LC-HF csoportban. A trigliceridek vázizmokból (m. Gastrocnemius) történő izolálása Folch-extrakcióval és az azt követő kvantifikációval mindkét LC-HF étrendcsoportban magasabb teljes triglicerid-koncentrációt mutatott, alátámasztva az Oil Red O elemzés eredményeit (chow, 15,1 ± 4,0 mg/dl; LC -HF-1, 30,3 ± 2,6 mg/dl; LC-HF-2, 42,8 ± 8,3 mg/dl; chow vs. LC-HF-1: nem szignifikáns; chow vs. LC-HF-2: P
5. ábra.A-C: intramyocelluláris lipidek, GLUT4 expresszió meghatározása az izmokban és a p-p70 S6 kináz máj expressziójának meghatározása. A: patkányok izomszelvényei párhuzamosan táplált izoenergetikus mennyiségben 3 különböző étrendből festettük az intramyocelluláris lipideket (Oil Red O). Az intramyocelluláris lipidek vörös lipidcseppekként jelennek meg. B: A GLUT4-et Cy3-mal (piros) festettük, amely mindkét LC-HF csoport plazma membránján és citoszolos vezikuláiban csökkent expressziót mutatott a CH csoporthoz képest. A sejtmagok kék színnel jelennek meg (DAPI). C: a phopho-p70 S6 kináz máj expressziója szignifikánsan alacsonyabb volt az LC-HF-1-gyel (LC-1) táplált patkányokban a CH (P
A p-p70 S6 kináz expressziója a májban és az izmokban
A p-p-aktinhoz viszonyítva a p-p70 S6 kináz expressziója az LC-HF-1-vel táplált patkányok májában szignifikánsan alacsonyabb volt a chow-hoz képest (P A Ludwig-Maximilians-Universität, München, Németország Orvostudományi Kar FöFoLe programja (744. számú támogatás).
Minden szerző kijelenti, hogy nincsenek pénzügyi vagy egyéb összeférhetetlenségük a nyilvánosságra hozatalhoz.
M. Bielohuby, D.A.S., R.W., R.J.S. és M. Bidlingmaier hozzájárultak a kutatás megtervezéséhez és megtervezéséhez; M. Bielohuby, S.S., N.H., A.Z., M.F., D.M., B.J.S. és K.S. elvégezte a kísérleteket; M. Bielohuby, S.S., D.A.S., N.H., D.M., B.J.S., K.S. és M. Bidlingmaier elemezte az adatokat; M. Bielohuby, S.S., D.A.S., N.H., A.Z., B.J.S., R.W., M.H.T., R.J.S. és M. Bidlingmaier értelmezte a kísérletek eredményeit; M. Bielohuby és S. S. elkészítette az ábrákat; M. Bielohuby, N. H. és M. Bidlingmaier elkészítette a kéziratot; M. Bielohuby, M. F., M. H. T., R. J. S. és M. Bidlingmaier szerkesztette és átdolgozta a kéziratot; M. Bielohuby, S.S., D.A.S., N.H., A.Z., M.F., D.M., B.J.S., K.S., R.W., M.H.T., R.J.S. és M. Bidlingmaier jóváhagyta a kézirat végleges változatát.
KÖSZÖNETNYILVÁNÍTÁS
Köszönjük Sarina Meurer és Amon Horngacher (Medizinische Klinik und Poliklinik IV, München, Németország), valamint Lisa Pichl (Állatorvosi Patológiai Intézet, München, Németország) kiváló technikai segítséget. Továbbá köszönetünket fejezzük ki Simon Gahr-nak (Medizinische Klinik und Poliklinik IV, München) a Western blot szakképzett segítségéért.
- Alacsony szénhidráttartalmú étrend és glikémiás kontroll az 1. típusú cukorbetegségben - European Medical Journal
- Csökkent glükóz tolerancia
- Javult glükóz tolerancia magas szénhidráttartalmú táplálkozással enyhe cukorbetegség esetén; NEJM
- Alacsony szénhidráttartalmú diéták megváltoztatják a máj glükózképződését - ScienceDaily
- Hogyan ártanak a divatos diéták az egészségednek - Fogyókúra - Egészségügyi Folyóirat