Anyai táplálkozás és az elhízás programozása
Beverly Sara Mühlhäusler
1 Felnőtt Egészségügyi Kutatócsoport korai származása; Szanszom Intézet; Dél-ausztráliai Egyetem; Adelaide Ausztrália
Clare L Ádám
2 Elhízás és anyagcsere-egészségügy osztály; Rowett Kutatóintézet; Bucksburn; Aberdeen, Skócia, Egyesült Királyság
Én Caroline McMillen
1 Felnőtt Egészségügyi Kutatócsoport korai származása; Szanszom Intézet; Dél-ausztráliai Egyetem; Adelaide Ausztrália
Absztrakt
Az elhízás gyakoribb előfordulása a fejlett és a fejlődő világban az elmúlt évtizedben szükségessé tette annak megértését, hogy milyen fiziológiai mechanizmusok hajlamosíthatják az egyéneket súlygyarapodásra csecsemőkorban, gyermekkorban és felnőttkorban. Jelenleg jelentős bizonyítékok állnak rendelkezésre, amelyek azt mutatják, hogy az elhízás útja nagyon korán megkezdődhet, és hogy a nem megfelelő táplálkozási szintnek való kitettség a prenatális és/vagy a korai posztnatális fejlődés során hajlamosíthatja az egyéneket az elhízásra a későbbi életben az étvágy és az étkezési preferenciák szabályozásának középpontjában áll, és egyre inkább felismerik, hogy a központi étvágyszerkezetek kialakulása érzékeny a táplálkozási környezetre mind a születés előtt, mind közvetlenül utána. Ez az áttekintés összefoglalja azt a munkát, amely rávilágított az agy kritikus szerepére az elhízás korai kialakulásában, és néhány perspektívát mutat be e kutatási eredmények klinikai környezetben történő lehetséges alkalmazásával kapcsolatban.
Bevezetés
Az étvágy szabályozása a felnőttekben
Ennek a hálózatnak a részletes összefoglalása meghaladja a jelen áttekintés kereteit, ezért itt csak röviden foglalkozunk vele. Van azonban egy sor korszerű és átfogó áttekintés, amely leírja a felnőttek étvágyának és anyagcseréjének szabályozásáért felelős komplex ideghálózatot. 7 - 9
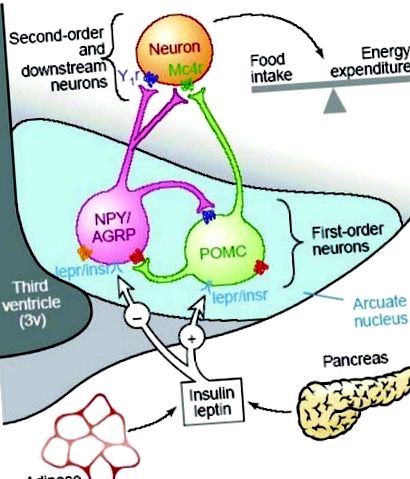
Az étvágy és az energiaegyensúly szabályozását a hipotalamusz neuropeptidek gyűjteménye közvetíti, amelyek elsősorban a hipotalamusz íves magjában (ARC) expresszálódnak (1. ábra). 7, 8, 10, 11 Ez a hipotalamuszos neuronhálózat integrálja az energiaellátással, az energiafelhasználással és a teljes energiatartalommal kapcsolatos jeleket annak érdekében, hogy megfelelően szabályozza az élelmiszer-bevitelt és az energiafelhasználást az energiamérleg fenntartása érdekében. Az ezeket a neuropeptideket expresszáló idegsejtek kiterjedt vetületeket mutatnak a hipotalamusz egyéb magjaival, beleértve a dorsomedialis hipotalamust (DMH), az laterális hipotalamuszt (LHA) és a paraventricularis magot (PVN), ahol további orexigén jeleket toboroznak. 7 Az energiabevitelhez, az energiafelhasználáshoz és a teljes energiatartalékhoz kapcsolódó hormonális és metabolikus jeleket az ARC első rendű idegsejtjei fogadják, és innen továbbítják más hipotalamusz magokban lévő másodrendű idegsejtekhez. Az összes orexigén és anorexigén szignál terminálja véglegesen konvergál a PVN-en, és felvetődött, hogy ez a hipotalamusz régió felelős ezen jelek integrálásáért és a megfelelő metabolikus kiigazítások elindításáért az energiamérleg fenntartása érdekében. 12.
Az étvágyszabályozó utak vázlatos áttekintése a felnőtt hipotalamuszban. (A 9. hivatkozástól engedéllyel.)
A hipotalamusz étvágyszabályozói közül a legjobban az orexigén neuropepetideket, az Y neuropeptidet (NPY) és az agouti rokon peptidet (AGRP), valamint az anorexigén neuropeptideket, a pro-opiomelanocortin (POMC) által vezetett α-melanocita-stimuláló hormont (α-MSH) valamint a kokain és amfetamin által szabályozott átirat (CART), amelyek mind az ARC-ben vannak kifejezve. Az NPY az eddigi leghatásosabb étvágystimulátor, és az NPY központi beadása a PVN-be az étvágyvágy és az élelmiszer-bevitel jelentős növekedését eredményezi. 13 - 16 Mind az NPY mRNS expressziója az ARC-ben, mind az NPY felszabadulása a PVN-be jelentősen megnőtt az éhgyomorra vagy az étel korlátozására adott válaszként, mind in vivo, mind in vitro. 17 Ezzel ellentétben az NPY expressziója az alacsony energiatárolók, köztük a leptin, az inzulin és a glükóz megnövekedett jeleire reagálva csökken. 8, 18, 19
A melanokortin szignálrendszer biztosítja az ellentétes anorexigén hajtóerőt, amely POMC-eredetű α-MSH-ra épül, és amely a melanokortin-receptorokon (MC3R és MC4R) keresztül hat az élelmiszer-bevitel elnyomására. 20 - 23 A POMC mRNS expressziója az ARC-ben a magas energiafogyasztás időszakában fel van szabályozva, és éhgyomorra vagy étkezéskorlátozásra csökken. Az Agouti-val rokon fehérje (AGRP) az MCR-ek endogén antagonistájaként működik, és az AGRP expressziójának növekedése ezért gátolja a melanokortin szignalizációt és növeli az étvágyat. Így a melanokortin szignalizáció fiziológiai hatásai az ARC-n belüli POMC (α-MSH) és AGRP expresszió közötti egyensúlytól függenek.
A CART a központi étvágyszabályozó hálózat másik fontos eleme, amely az etetés erős gátlója. A CART peptid központi adagolása drámai módon csökkenti a rágcsálók táplálkozását, míg a CART CART antitestekkel történő blokkolása az élelmiszer-bevitel jelentős növekedését eredményezi. A rágcsálóban a CART a POMC-vel együtt expresszálódik az ARC-ben, ami arra utal, hogy a CART kölcsönhatásba léphet a melanokortin jelzőrendszerrel. A leptin receptorok a hipotalamusz CART pozitív neuronjain vannak jelen, a leptin pedig növeli a c-Fos aktivitását a CART peptid pozitív neuronokban. 28, 29 Ezenkívül a CART mRNS expressziója az ARC-ben csökken a rágcsálókban történő éhezés során. 30
Az étvágy szabályozása a méhben
Amint azt korábban elmondtuk, a hipotalamusz különböző régióit összekötő neuronális áramkör, amely kritikus a táplálkozási viselkedés integrált szabályozása szempontjából, a születés előtt jelen van a juhokban és a főemlősökben, valamint az emberben. 32 - 34, 36 A rágcsálókban azonban ez a neuronális áramkör teljesen kialakulhat csak a születés után 16 nappal. 33, 37, 38 Ezért egyértelmű, hogy a fejlődés kritikus ablakai, amelyek során a megváltozott tápanyagszintnek való kitettség hosszú távú hatást gyakorol ennek a tengelynek a fejlődésére, rágcsálókban különböznek, mint a nagy állatmodelleknél és az embereknél, és hogy ez fontossá válik, ha figyelembe vesszük a jelenlegi kutatási eredmények lehetséges klinikai következményeit.
Működik-e a születés előtt az étvágyszabályozás központi ideghálózata?
Történelmileg a magzatot a transzplacenta táplálkozás passzív befogadójának tekintik, korlátozottan képes reagálni a jelenlegi táplálkozási állapot perifériás jeleire. Most azonban egyre nyilvánvalóbbá válik, hogy az a rendszer, amely szabályozza az étvágyat a posztnatális életben, már a születés előtt reagál a táplálkozási állapotra, azaz a glükózra és az inzulinra. Több mint tíz évvel ezelőtt Singh és munkatársai kimutatták, hogy patkányok születése előtti hiperglikémia és hiperinsulinémia expozíció csökkentette az NPY expresszióját a magzati hipotalamuszban a késői vemhesség alatt. 39 Kimutatták azt is, hogy a patkánykölykök 24–36 órás anyatejhez való hozzáférésének megfosztása az NPY mRNS expressziójának jelentős növekedését eredményezi az ARC-ben már a posztnatális 2. naptól kezdve, ami arra utal, hogy az étvágyszabályozó rendszer reagál a tápanyaghiányra a posztnatális élet korai szakaszában, még mielőtt az idegsejt áramkör teljesen kiépülne. 33 Azóta hasonló vizsgálatokat végeztek nagy állatmodellekben, például a juhokban, amelyekben ezek a rendszerek születésük előtt fejlődnek, mint az emberi.
Annak megállapítása érdekében, hogy az idegsejtek áramköre képes-e reagálni a juhok születése előtti megnövekedett glükózellátásra, és milyen mértékben, meghatároztuk a késői terhességi magzati hiperglikémia és hiperinsulinémia hatását az étvágyat szabályozó neuropeptidek expressziójára. Az intrafetális glükózinfúzió (130–140. Terhességi napon; időtartam = ∼150 nap) a plazma glükóz 2,5-szeresével és a plazma inzulin-koncentrációjának ∼2-szeres növekedésével járt együtt a magzati keringésben, miközben a plazma leptin-koncentrációját ez nem befolyásolta . 40 Fontos, hogy ez a prenatális hiperglikémia a POMC mRNS expressziójának jelentős növekedését eredményezte az ARC-n belül (2. ábra). Az anorexigén neuropeptid, a CART és az orexigén peptidek, az NPY és az AGRP expressziója nem változott a glükózzal infúziós magzatokban. 40 Ezek a megállapítások bizonyítékot szolgáltattak arra, hogy a magzati hipotalamuszban található POMC-tartalmú idegsejtek, de nem azok, amelyek NPY-t, AGRP-t vagy CART-ot tartalmaznak, közvetlenül reagálhatnak a magzat keringésében megváltozott glükóz- és/vagy inzulin-koncentrációkra a késői terhességben. A terhesség közepén lévő juhmagzatok (81 nap) további vizsgálata szintén pozitív összefüggést talált az ARC-ben lévő POMC mRNS és a magzati glikémia között ebben a korábbi szakaszban (C. L. Adam és munkatársai, publikálatlan adatok).
A leptin infúzió a magzati juhokban 131–134 d. Terhesség alatt a plazma leptin-koncentrációjának hatszoros növekedését eredményezte, de nem változott sem az anorexigén (POMC és CART), sem az orexigenikus (AGRP és NPY) neuropeptidek expressziója a magzatban. hipotalamusz az infúziós periódus végén. 49 Ugyanebben a vizsgálatban azonban volt néhány bizonyíték a szöveti gyűjtés napján a leptin-koncentrációk és az NPY mRNS expressziója közötti összefüggésre a magzati ARC-ben. Míg a további vizsgálatok egyértelműen indokoltak, azt sugalltuk, hogy ez annak a következménye lehet, hogy a juhokban 134 d. Terhességnél az NPY-expresszáló idegsejtek populációjában megjelenik a leptin-válaszkészség. 49 Érdekes, hogy Proulx és munkatársai korábban kimutatták, hogy az újszülött rágcsálókban végzett leptin-kezelés, a juhok és az emberek késői terhességével egyenlő időzítés megváltoztathatja az étvágyat szabályozó NPY és POMC neuropeptidek expresszióját a rostralis ARC-ben, de anélkül hatással van a táplálékfelvételre, ami azt sugallta, hogy a diszkrét hipotalamusz régiók közötti neuronális kapcsolatok befejezése előtt a leptin érzékenység kialakulhat. 50
Az étvágyat szabályozó neuropeptidek korlátozott reakciókészsége a leptinnel a fejlődés korai szakaszában összhangban áll a rágcsálókkal végzett vizsgálatok eredményeivel (51), és arra utal, hogy az étvágyat szabályozó neuropeptidek leptinnel szembeni érzékenysége viszonylag későn jelenik meg e hálózat kialakulásakor. A magzati és újszülött juhokban végzett munkánk arra engedett következtetni, hogy a méhen belüli leptinre való reagálás korlátozott képességének oka a leptin receptor (OBRb) jelátviteli formájának viszonylag alacsony szintű génexpressziójának következménye lehet. ARC neuronok. Felnőtt juhokban a leptin receptorok bőségesen expresszálódnak az ARC-ben, alacsonyabb szinten pedig a ventromedialis hipotalamuszban (VMH), 52 míg a magzati és a korai posztnatális élet során ez az eloszlás megfordul. 35, 40 Továbbá, az ARC OBRb expressziójának a VMN-hez viszonyított bősége nő a terhesség alatt és a korai posztnatális életben; Az OBRb nem mutatható ki az ARC-ben 134 d terhességnél (Muhlhausler és mtsai, publikálatlan megfigyelések), de a VMH-ban való expresszióhoz képest nő 141 d terhességnél, 40 és tovább nő 30 d postnatalis korban (3. ábra). 53
Autradiográfiák ábrázolják az OBRb expresszió tipikus mintáit a magzati juhoknál (A) 134 napos terhességnél (B) 141 napos terhességnél és (C) 30 napnál a posztnatális korban. (D) OBRb expressziójának arányát ábrázoló grafikon az íves magban (ARC) és a ventromedialis hipotalamuszban (VMH) 134 napos terhességnél, 141 napos terhességnél és 30 napos posztnatális kornál. Különböző betűk jelzik a korcsoportok közötti jelentős különbségeket 3 hetes korig. 55 Fontos, hogy az elmúlt évtizedben a Plagemann laboratóriumában folytatott folyamatos munka most meggyőzően bizonyította, hogy a rágcsálók prenatális vagy posztnatális túlzott táplálkozásának való kitettség lényeges változásokat eredményez a hipotalamusz architektúrájának fejlődésében. 55, 56
Áttekintés a jelenlegi hipotézisünkről arról az útról, amelyen keresztül az anyák túlzott táplálkozása az elhízás programozását eredményezi a szülés utáni életben.
A prenatális és a korai posztnatális fejlődés során bekövetkezett csökkenő tápanyagellátás az étvágy és a testösszetétel programozására is rámutatott. A tápanyag által korlátozott patkánygátaknál született kölykök növekedésükkor korlátozottak, a posztnatális életben hiperfágikusak, felnőttkorukban elhízás, inzulinrezisztencia és hiperleptinémia alakul ki. 63, 64 Ez a hiperfágia felerősödik, ha az utódokat az elválasztás utáni időszakban hiperkalórikus étrenddel táplálják, 63 ami arra utal, hogy az utódok étvágyszabályozásának alapértékét véglegesen, magas szinten állítják vissza. Plagemann és mtsai. azt is megállapította, hogy az anyai fehérje terhesség és szoptatás alatt történő speciális korlátozása hipofágiát és csökkent testtömeget eredményezett az utódokban; ez úgy tűnik, hogy az elválasztáskor az ARC-ben, PVN-ben és LHA-ban NPY-t és galanint expresszáló neuronok hipopláziája következménye. 65, 66
Míg az étvágyszabályozó idegháló programozásának alapmechanizmusai még mindig nem teljesen ismertek, Plagemann tanulmányai az inzulint feltételezik ezen adaptációk kulcsszabályozójaként. Mind az anyai cukorbetegség, mind a korai posztnatális túlzott táplálkozás perinatális hiperinsulinémiát eredményez, és a perinatális periódus alatti perifériás vagy intra-hipotalamusz inzulinkezelés hyperphagia-t, fokozott súlygyarapodást, elhízást, hiperinsulinémiát és inzulinrezisztenciát eredményez a felnőtt életben is. 67, 68 Az anyai cukorbetegség rágcsáló modelljeiben az anya glükózkoncentrációját normalizáló kezelések megakadályozzák az elhízás és az anyagcserezavarok kialakulását az utódokban. 69 A magzati és a perinatális inzulin- és glükózkoncentráció egyértelműen fontos, azonban a közelmúltban végzett vizsgálatok kimutatták, hogy a leptin kritikus szerepet játszik az étvágyszerkezetek kialakulásában.
A leptin és az étvágyat szabályozó ideghálózat fejlesztése
Megalapozott, hogy a leptin központi szerepet játszik az étvágyat szabályozó neuropeptidek expressziójának szabályozásában, és ezáltal a táplálékbevitel szabályozásában a felnőttekben. A leptinreceptor (OBRb) hosszú formája az NPY/AGRP és a POMC/CART neuronokon expresszálódik a hipotalamusz ARC-jén belül, és bebizonyosodott, hogy a leptin központi 70 vagy perifériás 71 beadása csökkenti az NPY/AGRP gén expresszióját és növeli a POMC/CART mRNS expresszió az ARC neuronokon belül. 72, 73 Nemrégiben világossá vált, hogy a leptin kritikus szerepet játszhat az étvágygerjesztő struktúrák fejlődésének szabályozásában az élet sokkal korai szakaszában, születés előtt és után is.
A leptin részvétele a hipotalamusz étvágygerjesztő struktúráinak normális fejlődésében központi szerepet játszhat az elhízás programozásában a magzati növekedés korlátozásának modelljeiben. Vickers és munkatársai arról számoltak be, hogy a leptin szubkután bejuttatása a tápanyaggal korlátozott patkánygátak növekedéskorlátozott utódaihoz a korai posztnatális periódusban normalizálja a posztnatális hyperphagiát, és megakadályozza az elhízás és a hyperleptinemia későbbi kialakulását az utódokban. 76 Ezért felvetődött, hogy a magzati és a korai újszülöttek életében a keringésben lévő leptinszintek hatással lehetnek az energiaegyensúly szabályozó rendszereinek fejlődésére a szülés utáni életben. Az alapul szolgáló mechanizmust és a kritikus ablakot, amely alatt a leptin-kezelés hatékony lehet, még nem kell egyértelműen meghatározni, és Yura és munkatársai hasonló tanulmányai nem mutattak be hasonló hatásokat. 77
Ezeknek a megállapításoknak egyértelműen potenciális klinikai alkalmazásuk van, és már felvetődött a leptinnel kiegészített csecsemőtápszerek lehetősége, mint a gyermekkori elhízás terheinek csökkentésére irányuló potenciális stratégia. 79 Mint minden viszonylag új kutatási terület esetében, itt is fontos megérteni egy ilyen kezelés biológiai következményeit, és körültekintően kell eljárni az altiszta fajok eredményeinek az újszülöttre történő extrapolálásában. Az is előfordul, hogy számos olyan tanulmány létezik, amelyek nem mutatták be az újszülöttek leptin kezelésének rágcsálókon gyakorolt hatását az utódok súlygyarapodására, étvágyára vagy testösszetételére. 77, 81 Ezért, bár úgy tűnik, hogy a leptinnek fontos szerepe van a hipotalamusz áramkörének kialakításában, továbbra is szükség van további tanulmányozásra a leptin potenciális szerepéről az elhízás programozásában.
Élelmiszer-preferenciák: Íz a gyorsételekhez, amelyet átadnak a következő generációnak?
Az egyik legfontosabb fogalom, amely felmerül az étvágy és az étkezés bevitelének programozása terén, az a gondolat, hogy az étkezési preferenciák, és nem csak az étvágy kontrollja önmagában, születés előtt kialakulhatnak. 82 Egyre egyértelműbb, hogy az egyes élelmiszereknek a jóllakottság szabályozására gyakorolt hatása nemcsak a bevitt étel mennyiségétől, hanem a minőségétől is függ. 83 Így a nagyon ízletes ételek (sok telített zsírban és/vagy egyszerű cukorban) elősegítik a túlzott táplálkozást és a gyors súlygyarapodást, mint más ételek. Újabb bizonyítékok állnak rendelkezésre arra vonatkozóan, hogy a magas zsírtartalmú és magas cukortartalmú ételek előnyben részesítése programozható a méhen belül.
Langley-Evan csoportja bemutatta az első bizonyítékot arra, hogy a méhen belüli táplálkozási környezet zavarainak való kitettség megváltoztathatja az utódok étkezési preferenciáit. Ezekben a vizsgálatokban az anyák utódjainak, akiket terhesség és szoptatás alatt alacsony fehérjetartalmú étrendnek tettek ki, ad libitum hozzáférést biztosítottak választáshoz magas fehérjetartalmú, magas zsírtartalmú és kontroll állathoz az elválasztás után, lehetővé téve az adott étrend relatív bevitelének mérését. . Az alacsony fehérjetartalmú étrendnek való kitettség a méhben fokozottan preferálta a magas zsírtartalmú ételeket. 84 Ez egy potenciális mechanizmust biztosít ezeknek az utódoknak az elhízás programozásához, amelyet ez és más csoportok széles körben bizonyítottak. 82, 85 Míg az anyák alacsony fehérjetartalmú táplálkozása és a magas zsírtartalmú ételek preferálása közötti összefüggést igazolták, talán helyénvaló, hogy az alacsony fehérjetartalmú étrend egyben szénhidráttartalmú étrend is, mivel a zsírszint állandó szint. A megfigyelt összefüggés tehát inkább a magas szénhidrát, mint az alacsony fehérje hatásának tulajdonítható.
Következtetés és perspektíva
- Az anyák magas zsírtartalmú étrendje és elhízása veszélyezteti a magzati vérképzést - ScienceDirect
- Hogyan befolyásolja az anyai elhízás a rutinszerű magzati anatómiai ultrahang PubMed-et
- Anyák elhízása magas kockázatú terhességek és szülés utáni fertőző szövődmények esetén - ScienceDirect
- Az anyák elhízása megzavarja a hipotalamusz fejlődését Nature Review Endocrinology
- Anyai elhízás és az anyagcserezavarok fejlődési programozása utódokban