Az adipocita hipertrófia és a hipoxia szerepe az elhízással társult zsírszövet gyulladás és inzulinrezisztencia kialakulásában
Pei-Chi Chan és Po-Shiuan Hsieh
Beküldve: 2016. május 17. Felülvizsgálat: 2016. augusztus 31. Megjelent: 2017. március 22
Absztrakt
Kulcsszavak
- zsírsejt
- hipertrófia
- hypoxia
- zsírszövet gyulladás
- inzulinrezisztencia
fejezet és a szerző információi
Szerzői
Pei-Chi Chan
- Nemzetvédelmi Orvosi Központ, Élettani Intézet, Tajpej, Tajvan
Po-Shiuan Hsieh *
- Nemzetvédelmi Orvosi Központ, Élettani Intézet, Tajpej, Tajvan
* Az összes levelezést címezze: [email protected]
A szerkesztett kötetből
Szerk .: Jan Oxholm Gordeladze
1. Bemutatkozás
A zsírszövet gyulladását az elhízással összefüggő kardiometabolikus szövődmények, köztük az inzulinrezisztencia, a 2-es típusú cukorbetegség, az érelmeszesedés és az alkoholmentes zsírmájbetegség (NAFLD) kóros mechanizmusaiban döntő szerepet játszották. A folyamat mögöttes mechanizmusait azonban még vizsgálják.
Az elhízás körüli zsírsejteket, különösen a kóros elhízás esetén, hipertrófia és hipoxia jellemzi, és ezek a fontos források a zsírszövet gyulladásának megindításához. Ezt a gyulladást nagyszámú citokin és kemokin, köztük a tumor nekrózis-faktor α (TNF-α), interleukin-6 (IL-6), monocita kemotaktikus protein-1 (MCP-1), és az aktiváció által szabályozott termelés közvetíti. expresszált és szekretált normális T-sejt (RANTES). Ezek a hipertrófia és hipoxia során az adipociták által termelt citokinek és kemokinek jelentősen hozzájárulnak az elhízással társuló zsírszövet-gyulladás kialakulásához. Az immunmediátorok adipocitákból történő konstitutív és szabályozott felszabadulásának képessége okozati összefüggést mutat az adipociták és az immunsejtek, például a makrofágok és a T-sejtek biológiája között. Ezenkívül feltételezték, hogy a hipertrófiás, hipoxiás adipociták és a zsírszöveti immunsejtek kölcsönhatása kulcsfontosságú szabályozó szerepet játszik az elhízás okozta inzulinrezisztencia kialakulásában.
Ez az áttekintés friss bizonyítékokkal szolgál az adipocita hipertrófia és a hipoxia fontos szerepének hangsúlyozására az elhízással társult zsírszövet (AT) gyulladás és inzulinrezisztencia kialakulásában, és megvitatja az esetleges mögöttes mechanizmust is.
2. Fő tantárgyak
2.1. A zsírszöveti gyulladás döntő mértékben hozzájárul az elhízással összefüggő inzulinrezisztencia és a 2-es típusú diabetes mellitus (DM) patogeneziséhez
Másrészt a felesleges zsírfelhalmozódás elősegíti a zsírszövetből a szabad zsírsavak felszabadulását a keringésbe, és sok más szövetet érint, beleértve a májat, a vázizomzatot és a szívet is. [11]. A zsírsavak és metabolitjaik, például az acil-koenzim A, a ceramidok és a diaciglicerol káros hatásai az inzulinjelzésre az aktiváló protein-kinázok, például a protein-kináz C, a mitogén-aktivált protein-kinázok (MAPK), a c-Jun N-terminális révén beszámoltak a kinázról (JNK) és a nukleáris faktor-ββ kináz B inhibitoráról [12]. Ezenkívül a szabad zsírsavak a Toll-szerű receptor 4 (TLR4) komplex [13] ligandumaként szolgálnak, és stimulálják a makrofágok citokintermelését [14], ezáltal modulálva a zsírszövet gyulladását, amely szintén jelentősen hozzájárul az elhízáshoz kapcsolódó metabolikus szövődményekhez.
2.2. Adipocita hipertrófia és hipoxia kialakulása a zsírszövet gyulladásában
A zsírszövet gyorsan és dinamikusan reagál a tápanyaghiány és a felesleges változásokra az adipocita hipertrófiája és hiperpláziája révén [15]. Különösen a kóros elhízás esetén, szemben az egészség elhízás zsírszövet-bővülésével, amely a zsírszövet megnagyobbodásából áll, az adipogén prekurzor sejtek adipogén programokba történő hatékony toborzása révén, a patogén zsírszövet-bővülés a meglévő adipociták hatalmas megnagyobbodásából és korlátozott angiogenezisből áll, és biztosítja hipoxia [16]. Például az adipociták az elhízás kialakulása során hipertrófiává válnak, és méretük akár 140–180 μm átmérőig is megnő, de az oxigén diffúziós határa legfeljebb 100 μm [17]. Másrészt lehetséges, hogy az adipociták vérellátása csökkenhet a progresszív adipocita megnagyobbodás során, következményes hipoxiával [18].
2.3. Hipotézis és bizonyíték az adipocita hipertrófia és hipoxia hatásáról a zsírszövet gyulladásának és inzulinrezisztenciájának kialakulására
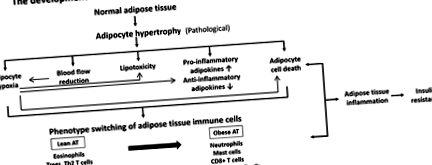
A legújabb tanulmányok kimutatták, hogy a kóros elhízás kialakulása során a zsírszövetet az adipocita hipertrófia jellemzi, amelyet hipoxia, immunsejt-beszivárgás és gyulladáscsökkentő adipocitokinek követnek a krónikus gyulladás előrehaladása során. Ezenkívül a csökkent véráramlási perfúzió, lipotoxicitás és az adipocita sejtpusztulás egyidejű fejlődése szintén tovább rontaná a zsírszövet gyulladásának előrehaladását (1. ábra).
1.ábra.
Az egészségtelen elhízás és az inzulinrezisztencia kialakulása.
2.3.1. Az adipocita hipertrófia hatása a zsírszövet hipoxiájára
Az elhízás, mint a zsírszövet feleslege, az adipociták hipertrófiájának és hiperpláziájának tulajdonítható. Az adipociták korlátozott kapacitással rendelkeznek a hipertrófiára. Az egyik magyarázat az oxigén diffúziós határának tekinthető, amely legfeljebb 100 μm [17]. Ezért lehetséges, hogy a hipertrófiás adipociták kevesebbet bírnak, mint a megfelelő oxigénellátás. Másrészt bebizonyosodott, hogy az elhízott egerek hipoxiája előfordulhat a zsírszöveten belül az adipocita hipertrófia következtében, amely veszélyezteti az erek hatékony O2-ellátását, majd inicializálja a pimonidazol-hidroklorid addíció által jelzett gyulladásos reakciókat (fizikai bizonyíték) valamint a laktátkoncentráció (fiziológiai bizonyíték) [19]. Sőt, arról is beszámoltak, hogy a hipoxia in vitro és állatkísérletekben gyulladást eredményez a zsírszövetben és az inzulinrezisztencia [19–21].
A hipoxia képes a zsírszövetben gyulladást kiváltani azáltal, hogy hipoxiával kapcsolatos génexpressziót indukál az adipocitákban és a makrofágokban. Az oxigénfeszültség változásaival szembeni adaptív válasz fontos és jól jellemzett kulcsszabályozója a hipoxia által indukálható faktor-1a (HIF-1α), egy transzkripciós faktor, amely a hipoxia során felhalmozódik és aktiválja a nukleáris faktor-κβ útvonalakat, ami fokozott gyulladáshoz vezet. és az angiogenezis stimulálása [19].
Megjegyzendő, hogy a hypoxia által indukálható 1a faktor (HIF-1α), amely kulcsfontosságú szerepet játszik a hipoxiára adott válaszban [20], az O2 homeosztázis fő szabályozójának tekinthető. A HIF-1α-t az emberi zsírszövetben azonosították, és arról számoltak be, hogy fokozott az elhízás [21]. Ezenkívül számos rágcsáló-tanulmány kimutatta, hogy az ob/ob, a KKAy és az étrend okozta elhízott egerek fehér zsírszövetében a HIF-1α fokozott génexpresszióját, több hipoxiás területet és alacsonyabb PO2-szintet mutattak ki [22–24]. A csökkent oxigénfeszültséget közvetlenül mérték az elhízott zsírraktárakban egérmodellekben és humán személyekben [23]. A HIF-1α túlzott expressziója az adipocytában szintén pro-fibrotikusabb és pro-gyulladásosabb, mint pro-angiogén [25]. A HIF-1α adipocita-specifikus deléciója korlátozta a magas zsírtartalmú étrend által kiváltott zsírszövet-gyulladást és inzulinrezisztenciát, és a szövet ugyanúgy vaszkularizálódott, mint a vad típusú kontrollok [26]. Ezáltal a HIF-1α expressziójának fokozódása hozzájárulhat a zsírszövet lokalizált gyulladásához, amely az elhízással kapcsolatos társbetegségek kialakulásával járó általános szisztémás gyulladást terjeszt elő [27].
2.3.2. Az adipocita hipertrófia hatása a szabad zsírsavak termelésére (lipotoxicitás)
Ennek ellenére a zsírsejtekbe jutó zsírsav fluxus növekedése az FFA trigliceridekké történő nagyobb szintézisét is eredményezi, ami endoplazmatikus retikulum (ER) stresszhez vezetne, aktiválva a JNK útvonalat, és ezáltal tovább növelve az inzulinrezisztenciát a zsírsejtekben [31].
2.3.3. Az adipocita hipertrófia hatása a zsírszövet véráramlásának csökkentésére
Az egyre növekvő zsírtömeg, különösen a hasi zsírszövet, a zsírszövet véráramlásának kedvezőtlen változásával és az anyagcserezavarok kialakulásával jár együtt elhízás állapotában. A megnövekedett zsírtömegben megmutatkozó csökkent véráramlás elsősorban az adipocita hipertrófia kialakulásának tudható be.
Az elhízás gyakori jellemzője a zsírszöveti perfúzió csökkenése. West és mtsai. [32] kimutatta, hogy a zsírszövet véráramlása, radioaktívan jelzett mikrogömbön mérve, csökkent Zucker elhízott patkányokban. Embereknél a zsírszövet véráramlásának szintjét pozitronemissziós tomográfiával mértük [15 O] -jelölt víz [33] és 133 Xe mosási módszer [34] alkalmazásával, és elhízottaknál alacsonyabbak voltak, mint a nem elhízott alanyok. Ezenkívül a zsírszövet véráramlásának szabályozásában bekövetkezett zavarokat összekötötték az elhízással és az inzulinrezisztenciával [35]. Ez a tanulmány szoros összefüggést mutatott ki az inzulinérzékenység és az étkezés utáni zsírszövet véráramlás szabályozása között, függetlenül az adipozitástól. Ezért a zsírszöveti véráramlás károsodott szabályozása az adipocita hipertrófiájával szintén jelentős és független hozzájárulás lehet az inzulinrezisztencia kialakulásához az elhízás állapotában [35].
2.3.4. Az adipocita hipertrófia hatása az adipocita halálára
Amint fentebb említettük, az adipocita hipertrófia közvetlenül és közvetve adipocita hipoxiát okozhat. A hipoxia potenciális kockázati tényező lehet a zsírsejtek elhízásában az elhízott alanyok zsírszövetében. Az elhízott alanyok zsírszövetében az adipocita halálának növekedéséről számoltak be, és azt javasolták a makrofág infiltráció kiváltására [36]. A sejthalál elősegítheti a lipolízist és az FFA felszabadulását a véráramba inzulinrezisztencia alatt. Ez jelentősen hozzájárul a plazma FFA növekedéséhez az elhízásban. Sőt, bebizonyosodott, hogy az adipocita halálozás gyakorisága szignifikánsan összefüggött a zsírszövetben a TNF-α, IL-6 és MCP-1 zsír gén expressziójával és az egész test inzulinrezisztenciájának kialakulásával [37].
A makrofágok rendkívül jártasak számos molekula eltávolításában, a kis lipidektől kezdve a kórokozók kolóniáin át az elhalt sejtekig. A hipertrófia által vezérelt és az elhízás által felgyorsított adipociták nekrózisa kiemelkedő fagocita stimulus, amely vonzza a makrofágok beszivárgását a zsírszövetbe [18]. Az indukálható lipoatrophia transzgenikus állatmodelljét alkalmazva Pajvani et al. kimutatta, hogy a masszív adipocita halál valóban a zsírszöveti makrofágok (ATM) gyors felhalmozódását ösztönzi, mint a zsírpárnák átalakításának szerves elemét [38]. Ezek a megfigyelések az adipocita hipertrófia fontos szerepét vetik fel az adipocita halálának kialakulásában és a kapcsolódó gyulladásos változásokban az AT és az elhízás szövődményeiben.
2.3.5. Az adipocita hipertrófia hatása az adipokintermelésre
A gyulladásgátló citokinek emelkedését a zsírban és a vérkeringésben, mint például a TNF-α, IL-1, IL-6, MCP-1 és PAI-1, elhízásban dokumentálták [23,25,39]. Az adipokintermelés növekedését az adipocita hipertrófiájában és az oxigénhiányban javasolták a zsírszövet gyulladásos válaszának kialakulásának alapjául, amely elhízott állapotban fordul elő [11,40]. Világosan jelezték, hogy az adipocita mérete fontos meghatározó tényező számos gyulladásos adipokin, például a leptin, az IL-6 és az MCP-1 szekréciójában, ezáltal újabb kapcsolatot biztosítva az adipocita mérete és az elhízásban fellépő gyulladás között [41]. Ugyanebben a tanulmányban arra volt hajlamos, hogy az adipocita méretének növekedésével csökkentsék a gyulladásgátló adipokinek, például az IL-10 és az adiponektin felszabadulását [41].
Másrészt a hipoxiát javasolták a nekrózis és a zsírszövetbe történő makrofág-infiltráció felbujtó etiológiájává, amely ezt követően gyulladással kapcsolatos adipokinek, például leptin, adiponectin, TNF-α, IL-6 termelésének diszregulációját eredményezi. és a vaszkuláris endoteliális növekedési faktor (VEGF) [40,42]. Nemrégiben arról számoltak be, hogy a hipoxia a PAI-1 termelését indukálja, és gátolja az adiponektin 3T3-L1 adipociták általi szintézisét [39]. Beszámoltak arról is, hogy ezekben a sejtekben indukálja a visfatin expresszióját [43]. Az egér vagy humán adipociták egyéb fő adipokintermelésének kifejeződései, beleértve az angiopoietin-szerű 4-es fehérjét (Angptl4), az interleukin-6 (IL-6), a makrofág-migrációt gátló faktort (MIF) és a VEGF-et is [23,40,44]. hipoxia stimulálja. Ennek megfelelően Wang et al. kobalt-klorid (CoCl2) alkalmazásával 24 órán keresztül utánozta a hipoxiát emberi zsírsejtekben. Kimutatták, hogy a HIF-1α, az oxidatív stressz markerekkel, a gyulladásos markerekkel és a leptinnel együtt nőtt, de fordítva, az adiponektin csökkent a hipoxia során [42].
2.4. A hipertrófiában és hipoxiában szenvedő adipociták és az infiltrált immunsejtek kölcsönhatása a zsírszövet gyulladásának és az elhízás szövődményeinek kialakulásában
Az adipocita hipertrófiája és az oxigénhiány döntő szerepet játszik a zsírszövet gyulladásában a gyulladásgátló citokinek, valamint az elhízás korai kialakulásában az immunsejteket vonzó kemokinek előidézésével. Régóta ismert, hogy az elhízás zsírszövete fokozott gyulladásos állapotban van. A közelmúltban átalakult az a tudás, hogy az immunsejtek, mint például a makrofágok és a T-sejtek, beszivároghatnak a zsírszövetbe, és felelősek a gyulladásos citokintermelés és a zsírszöveti gyulladások nagy részéért. Azt is felvetették, hogy az adipociták antigént bemutató sejtként működhetnek az immunsejtek ellen a zsírszövet gyulladásában [45].
2.4.1. Makrofágok
Az adipocita hipertrófia következményei közé tartozik a zsírsav fluxus, a vaszkularizáció, az fokozott adipokin szekréció, a hipoxia és az adipocita sejtek pusztulása. A zsírszövet-terjeszkedés ezen adipocitákkal kapcsolatos következményei fontos szerepet játszanak a kóros elhízás esetén a makrofág-toborzás megkezdésében. A makrofágok beszivárgása a gyulladt zsírszövetben a vér monocita beáramlásából származik, elsősorban az MCP-1 kemokin vonzza, amelyet főleg hipertrófiás adipociták választanak ki [46]. A zsírszöveti makrofágok (ATM) mind a szubkután, mind a zsigeri táguló zsírraktárakban felhalmozódnak [46]. A szám növekedése mellett a zsírszöveti makrofágok az elhízás során fenotípusosan is megváltoznak, az anti-inflammatorikus M2 makrofágokból a gyulladáscsökkentő M1 makrofágokba, dominánsan az elhízott egereknél [5]. Az aktivált M1 ATM-ek a gyulladásgátló citokinek, például a TNF-α és az IL-6 kiemelkedő forrása, amelyek autokrin/parakrin jelátvitellel blokkolhatják az adipociták inzulinhatását, és endokrin szignál révén szisztémás inzulinrezisztenciát is okozhatnak. Megjegyzendő, hogy az adipokintermelés az adipocita hipertrófia és a hipoxia, például a szabad zsírsavak és a TNF-α során az elhízás állapotában megkönnyíti az M1 fenotípusváltást [47].
2.4.2. T-sejtek
Ezenkívül a nemrégiben felfedezett T helper 17 (Th17) sejtek a CD4 + T sejtek új részhalmazát képviselik, amelyet az interleukin 17 (IL-17) termelődése határoz meg [54]. Érdekes, hogy az elhízott humán betegeknél a szérum IL-17-et szabályozzák [55], és az elhízás pozitívan korrelál a léptől izolált T-sejtek fokozott IL-17 expressziójával [56]. Zúñiga et al. feltárta, hogy a T-sejtek által a zsírszövetben szekretált IL-17 fontos negatív regulátora az adipogenezisnek azáltal, hogy elnyomja számos pro-adipogén transzkripciós faktor expresszióját, beleértve a PPAR-γ és C/EBP-α [57], valamint a glükóz metabolizmusát is. súlyosbíthatja az inzulinrezisztenciát [58]. Ezáltal a Th17 sejtek által megnövekedett IL-17 szekréció gátolja az adipocita eredetű őssejtek (ASC) differenciálódását az adipocitákra, és elnyomja az adipociták inzulinreakcióját is. Eljaafari et al. [59] érdekes bizonyítékokat szolgáltat az emberi ASC-k humán mononukleáris sejtekkel (MNC) való együttes kultúrájának felhasználásával, az elhízott donorok ASC-i fokozzák a naiv CD4 + T-sejtek differenciálódását a Th17-sejtek felé, és megváltoztatják az MNC-k fenotípusát a fokozott szekréció révén. IFN-y Th17 sejtekkel. Ezek a megfigyelések együttvéve azt sugallják, hogy az IL-17 és Th17 sejtek fontos szerepet játszanak az elhízással kapcsolatos zsírszövet-diszfunkcióban és szisztémás szövődményekben.
2.4.3. Mások
Ezenkívül nemrégiben készült tanulmányunk [63] azt is bebizonyította, hogy a COX-2 által közvetített PGE2 EP3 jelátvitel az adipocita hipertrófia és a hipoxia kialakulása során fontos a zsírszövet immunsejtjeinek toborzásában és kölcsönhatásban a zsírszövet gyulladásos válaszainak felerősítése érdekében, ami szintén okozati összefüggésben van a szisztémás inzulinrezisztencia kialakulásával.
2.5. Az adipocita hipertrófia szabályozó mechanizmusai az elhízás kialakulásában
Az elhízás során az adipocita hipertrófia kórokozó változását az adipozitás két különálló folyamata határozza meg: az adipocita differenciálódás (adipogenezis) és a lipogenezis. A genetikai hajlamtól és a környezeti környezettől egyaránt függenek. A tartós pozitív kalóriabevitel során az adipocita hipertrófia adipocita diszfunkciót eredményezhet, miközben az adipogenezis károsodott [64,65].
Másrészt az adipocita differenciálódás mechanizmusait alaposan tanulmányozták az elmúlt évtizedekben. Számos kulcsfontosságú transzkripciós tényezőt és adipokint azonosítottak az adipocita differenciálódásban [66]. Ide tartoznak például a peroxiszóma-proliferátor-aktivált receptor (PPAR) család fehérjéi [67], CCAAT/fokozót megkötő fehérje (C/EBP) [68], az adipocita-differenciáció meghatározásától függő 1-es faktor (ADD1) [69] és szterin válasz elemkötő protein 1 (SREBP 1) család fehérjéi [70]. Ezenkívül a tirozin-foszforilált Dok1-ről az is bizonyítottan elősegíti az adipocita-hipertrófiát, hogy ellensúlyozza az extracelluláris szignál-a-szabályozott kináz (ERK) PPAR-γ-ra gyakorolt gátló hatását [71].
Ezenkívül a tartós energiafelesleg megkönnyítheti az energia tárolását a létező adipociták lipogenezisével és hipertrófiájával, mint az új adipociták toborzásával és megkülönböztetésével a pre-adipocytáktól. Végül kóros adipocita-hipertrófiához vezet, amely hozzájárul a zsírszövet-gyulladás és az elhízással összefüggő anyagcserezavarok kialakulásához [72,73].
2.6. A terápiás következmények
Ebben a fejezetben a nemrégiben elért haladást ismertetjük az adipociták szerepével az elhízással társult zsírszövet fejlődésének, növekedésének és átalakításának szabályozásában. Ez az áttekintő cikk tovább kiemeli az adipociták fontos szerepét a hipertrófia és a hipoxia során a zsírszövet gyulladásának kialakulásában és az inzulinrezisztencia követésében. Az adipocita hipertrófia szabályozási mechanizmusának megértése az elhízás kialakulása során jobb stratégiát adhat az elhízással társult 2-es típusú cukorbetegség és metabolikus szindróma megelőzésére és kezelésére.
Köszönetnyilvánítás
A szerzők nagyra értékelik a Tudományos és Technológiai Minisztérium támogatásának támogatását, sz. MOST 105-2811-B-016-004 és MOST 104-2320-B-016-001; Háromszolgálatos Általános Kórház, sz. TSGH-C104-007-007-S01 Tajvanon.
- A lipoprotein lipáz szerepe a zsírszövet fejlődésében és az anyagcserében International Journal
- A karragén és a karboxi-metil-cellulóz szerepe a bélgyulladás kialakulásában
- Az adiponektin szerepe az elhízással összefüggő nőspecifikus karcinogenezisben - ScienceDirect
- Az elhízással társult peptid leptin hipertrófiát indukál az újszülött patkány kamrai myocytáiban
- Miért Ruth Bader Ginsburg az ALS példaképem - ALS News Today