Az androgének, a dehidroepiandroszteron (DHEA) és a tesztoszteron elhízás elleni hatásai
Készítette: Kazuo Kajita, Ichiro Mori, Masahiro, Takahide Ikeda, Hiroyuki Morita és Tatsuo Ishizuka
Beküldve: 2014. május 9. Felülvizsgálat: 2014. október 16. Megjelent: 2015. április 1
fejezet és a szerző információi
Szerzői
Kazuo Kajita *
- Általános Belgyógyászati Klinika, Gifu Egyetem Orvostudományi Kar, 1-1 Yanagido, Gifu, Japán
Ichiro Mori
- Általános Belgyógyászati Klinika, Gifu Egyetem Orvostudományi Kar, 1-1 Yanagido, Gifu, Japán
Masahiro
- Általános Belgyógyászati Klinika, Gifu Egyetem Orvostudományi Kar, 1-1 Yanagido, Gifu, Japán
Takahide Ikeda
- Általános Belgyógyászati Klinika, Gifu Egyetem Orvostudományi Kar, 1-1 Yanagido, Gifu, Japán
Hiroyuki Morita
- Általános Belgyógyászati Klinika, Gifu Egyetem Orvostudományi Kar, 1-1 Yanagido, Gifu, Japán
Tatsuo Ishizuka
- Általános Belgyógyászati és Reumatológiai Osztály, Gifu Városi Kórház, 7-1 Kashima-cho, Gifu, Japán
* Az összes levelezést címezze: [email protected]
A szerkesztett kötetből
Szerkesztette: Colleen Croniger
1. Bemutatkozás
A jelentős kutatások ellenére az elhízás és az anyagcsere-rendellenességek közötti összefüggéseket még nem kell teljesen megérteni. A legújabb bizonyítékok azt mutatták, hogy a zsírraktárak, nem pedig a zsírmennyiség, nélkülözhetetlenek a szisztémás inzulinérzékenység meghatározásában. A zsírszövetet anatómiai elhelyezkedésük szerint zsigeri zsírszövetekké, ideértve az epididymális, mesenterialis és perirenalis zsírokat, valamint a subcutan zsírszöveteket osztályozzák. A zsigeri zsírszövet növekedését az inzulinrezisztenciával összefüggőnek tekintjük [1, 2]. Különösen azt feltételezik, hogy a mesenterialis zsír szorosabban kapcsolódik az anyagcserezavarokhoz, mivel a mesenterialis zsír szabad zsírsavakat és egyéb anyagokat választ ki közvetlenül a portális vénába [3]. Bár a zsíreloszlást szabályozó mechanizmusok továbbra is homályosak, a nemi hormonok vitathatatlanul az egyik meghatározó tényező.
Mivel a férfiak általában sokkal több zsigeri zsírt halmoznak fel, mint a nők, az androgénekről feltételezik az inzulinrezisztencia elősegítését. A gyakorlatban az alacsony szérum tesztoszteronszint elősegíti az elhízást. Számos tanulmány kimutatta, hogy az androgén-deprivációs terápia (ADT) növeli az elhízás, a metabolikus szindróma, a 2-es típusú cukorbetegség és a szív- és érrendszeri betegségek kockázatát a prosztatarákban szenvedő betegeknél [4-8]. Basaria és munkatársai rámutattak, hogy az ADT-vel kezelt prosztatarákban szenvedő férfiaknál magas zsírtömeg, valamint alacsony csontsűrűség és vérszegénység figyelhető meg, összehasonlítva az anélkül kezeltekkel. Arra a következtetésre jutottak, hogy az ADT-ben részesülő betegeknél fokozott az inzulinrezisztencia és a szív- és érrendszeri betegségek kockázata. Katznelson és mtsai arról számoltak be, hogy a testzsír százalékos aránya nagyobb volt a megszerzett hipogonadalis férfiaknál az eugonadal kontrollokhoz képest, amit a tesztoszteron-helyettesítő terápia javított [9].
A közelmúltban elhízással, metabolikus szindrómával és 2-es típusú cukorbetegséggel rendelkező férfiaknál a hipogonadizmus magas gyakoriságát ismerték el. Dhindsa és mtsai arról számoltak be, hogy a teljes tesztoszteron és a szabad tesztoszteron fordítottan viszonyul a BMI-hez és a zsírtömeghez [10] a 2-es típusú cukorbetegeknél. Kapoor és munkatársai egy 355 2-es típusú cukorbeteg alany keresztmetszeti vizsgálatában nyílt és határokon átnyúló hipogonadizmust találtak 42% -ban, e férfiak közül 42-nél szabad tesztoszteronszint volt
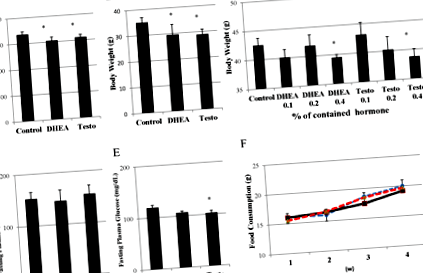
1.ábra.
A DHEA és a tesztoszteron adagolásának hatása a testtömegre. Megmutattuk a 0,4% DHEA-val vagy 4 hét héten át tesztoszteront tartalmazó táplálékkal a kezelés súlyát Wistar patkányokban (n = 6) (A) és C56/fekete egerekben (n = 4) (B) 8 hetes korban. *: p
3.2. A DHEA és a tesztoszteron hatása az adipocitákra
A DHEA vagy a tesztoszteron adagolása elnyomta a zsír tömegét, beleértve a szubkután, epididymális és mesenterialis zsírokat is (2A. Ábra). Ezenkívül mind a DHEA, mind a tesztoszteron ekvivalens módon csökkentette az adipocita méretét (2B. Ábra). Megállapítottuk, hogy a DHEA-val végzett kezelés csökkentette a PPARγ expresszióját az adipocitákban in vivo és in vitro egyaránt [42]. A DHEA-val és a tesztoszteronnal végzett kezelés hasonlóan csökkentette a PPARγ expressziós szintjét a Wistar patkányokból és a 3T3-L1 adipocytákból izolált zsírszövetben (2C. Ábra, D). A PPARγ által szabályozott géneket, például a FABP 4, az LPL és az adiponektint a DHEA és a tesztoszteron egyaránt szabályozta a 3T3-L1 adipocytákban. Egyik hormon sem befolyásolta azoknak a géneknek az expressziós szintjét, amelyeket közvetlenül nem szabályoz a PPARγ, például az SREBP-1 és a FAS (az adatokat nem mutatjuk be). A DHEA vagy a tesztoszteron beadása ugyanolyan mértékben csökkentette a máj és a vázizmok trigliceridtartalmát patkányokban (2. ábra E, F).
2. ábra.
A DHEA és a tesztoszteron adipocitákra gyakorolt hatásai. A 4 hetes DHEA-val vagy tesztoszteronnal történő kezelés hatása a zsír tömegére (fekete: szubkután, zöld: epididymális, kék: mesenterialis zsír, n = 6) (A) és szövettani leletek (B). *: p
Ezután megvizsgáltuk ezeknek a hormonoknak az adipocita differenciálódásra gyakorolt hatását. Megfigyeltük az F442A sejtek differenciálódását, mivel spontán módon érett adipocitákká differenciálódnak, amikor összefolynak. A DHEA és a tesztoszteron elnyomta a triglicerid felhalmozódását (3A. Ábra), valamint a differenciálódási folyamat során a PPARγ és FABP4 mRNS megjelenését. Ezek az adatok azt jelezték, hogy a DHEA és a tesztoszteron hasonlóan elnyomja az adipocita differenciálódást.
3. ábra.
A DHEA-val és a tesztoszteronnal végzett kezelés hatása az F442A adipocyták differenciálódására. Az F442A preadipocitákat DMED-ben tenyésztettük. Amikor a sejtek a morfológiai eredmények (0d) alapján összeolvadást értek el, 50 nM DHEA-t vagy tesztoszteront adtak a táptalajhoz, majd ezt követően inkubálták a jelzett időtartamig. A triglicerid felhalmozódását olajvörös festéssel értékeltük 7d (A) hőmérsékleten. A PPARγ és FABP4 expressziós szintjét valós időben PCR-rel mértük a megadott napon (n = 4) (B). *: p
3.3. A DHEA és a tesztoszteron hatása a mitokondriális biogenezisre
Mint fentebb megjegyeztük, mivel sem a DHEA, sem a tesztoszteron beadása nem befolyásolta az élelmiszer-fogyasztást, feltételeztük, hogy ezek a hormonok növelik az energiafelhasználást. Ezért megvizsgáltuk a tesztoszteron beadásának az energiatermelésre gyakorolt hatását. Az egereket 4 hét múlva tesztoszteronnal vagy anélkül kezeltük, majd közvetett kalorimetriával mértük az oxigénfogyasztást és a mozgásszervi aktivitást. Az O2-fogyasztás és a CO2-termelés jelentősen megnőtt a tesztoszteronnal kezelt egerekben, függetlenül attól, hogy az értékeket testtömeg szerint normalizálták-e vagy sem (4B-E ábra). Ezenkívül a hőtermelés, amelynek értékét testtömeg normalizálta, megemelkedett a tesztoszteronnal kezelt egerekben (4G. Ábra). A kontroll és a tesztoszteronnal kezelt egerek között nem tapasztaltunk különbséget a légzési csere sebességében (4H. Ábra). Meglepetésünkre a tesztoszteron adagolása elnyomta a mozgásszervi aktivitást (4I. Ábra).
4. ábra.
A tesztoszteronnal történő kezelés hatása az oxigénfogyasztásra, a hőtermelésre és a mozgásszervi aktivitásra. A 8 hetes C56/fekete egereket 4 hétig tesztoszteronnal kezelték, és az egyéni oxigénfogyasztást és a mozgásszervi aktivitást közvetett kalorimetriával határozták meg (A). Halmozott O2-fogyasztás 24 órán át (B) és normalizált értékek testtömeg (C), CO2-termelés (D) és normalizált értékek testtömeg (E), hőtermelés 24 óra (F) és normalizált értékek testtömeg (G) ) láthatóak. Az RER (H) és a mozgásszervi aktivitás (I) 24 órás értékeit is bemutatjuk. *: p
Ezek az eredmények azt jelzik, hogy a tesztoszteron beadása növeli az alapanyagcsere sebességét. Ezért értékeltük ezeknek az androgéneknek a mitokondriális biogenezisre és annak upstream szabályozójára, a PGC1α-ra gyakorolt hatásait. A mitokondriális fehérje, a Cox4 és a PGC1a expressziója emelkedett a vázizomzatban, de nem barna BAT vagy máj, izolálva a tesztoszteronnal kezelt patkányoktól (5A. Ábra). A DHEA beadása által kiváltott vázizomzatban a Cox4 növekedése kisebb volt, mint a tesztoszteron (5B. Ábra). A tesztoszteron által kiváltott PGC1α és citokróm C mRNS szintjének növekedése nagyobb volt, mint a DHEA által kiváltott C2C12 myocsőben (5C. Ábra). Ezek az eredmények azt mutatják, hogy ezeknek a hormonoknak a megnövekedett mitokondriális biogenezise az energiafelhasználás fel-szabályozásához vezet, ami csökkent adipozitást eredményezhet.
5. ábra.
A DHEA-val és a tesztoszteronnal végzett kezelés hatása a mitokondriális biogenezisre. A Wistar patkányokat DHEA-val vagy tesztoszteronnal kezeltük 4 hétig. A tesztoszteronnal végzett kezelés hatása a PGC1α és Cox4 expressziójára a vázizomzatban, a BAT-ban és a májban látható (A). A Western blot tipikus eredményeit a bal oldali panelen, a számszerűsített eredményeket pedig a jobb oldalon mutatjuk be (n = 4). Fehér: Kontroll, Fekete: Tesztoszteronnal kezelt. *: p
4. Megbeszélés
Az androgén által kiváltott súlycsökkenés hátterében álló mechanizmusok tisztázása érdekében elemeztük a tesztoszteron beadásának az energiafelhasználásra gyakorolt hatását. A DHEA és a tesztoszteron beadása is növelte a végbél hőmérsékletét patkányokban [44]. Bár rendellenesen magas testhőmérsékletet nem sikerült kimutatni, a tesztoszteronnal kezelt egerekben emelkedett O2-fogyasztást és CO2-termelést figyeltek meg (4A-D. Ábra). Noha a tesztoszteronnal kezelt egerekben nőtt a hőtermelés, ez nem volt szignifikáns, ha ezeket az értékeket nem a testtömeg normalizálta (4E. Ábra). Nincsenek adatok a sovány testtömegről vagy a vízről. Ha a sovány testtömeget nem befolyásolja a tesztoszteron, akkor a tesztoszteron által kiváltott zsírbetegség csökkenése nem következhet be az energiafelhasználás növekedéséből. Másrészt eredményeink azt mutatják, hogy a tesztoszteronnal kezelt egerekben az alapanyagcsere sebessége nő, mivel ezekben az egerekben a hőtermelés nem csökkent a visszafogott mozgásszervi aktivitás ellenére. A tesztoszteronnal kezelt egerekben az elnyomott mozgásszervi aktivitás eredménye váratlan volt, mivel az ARKO-ban alacsonyabb mozgásszervi aktivitásról is beszámoltak [51]. Ezt az eltérést még nem tudjuk megmagyarázni, valószínűleg azért, mert a mozgásszervi aktivitás változása nem fordulhat elő androgén jellel párhuzamosan.
Vizsgálataink eredményeit a 6. ábrán foglaltuk össze. A DHEA és a tesztoszteron egyformán elnyomta a preadipociták szaporodását, az adipociták differenciálódását, valamint a PPARγ és lefelé áramló génjeinek, beleértve az adiponektint is, expresszióját az adipocytákban. Mind a DHEA, mind a tesztoszteron felfelé szabályozta a PGC1α-t és a mitokondriális biogenezist, az utóbbinál aktívabban, mint az előbbinél a vázizomban. Az, hogy melyik szerv játszik a fő szerepet az androgének által kiváltott zsírosodás csökkentésében, továbbra is érdekes probléma. Eredményeink azt sugallják, hogy a tesztoszteronnal kezelt állatok csökkent adipozitása a PPARγ csökkent expressziójából és az adipocitákba történő differenciálódás elnyomásából eredhet. A HX531 antagonista által a PPARγ aktivitás mérsékelt szuppressziója csökkent zsírtömeget és megnövekedett oxigénfogyasztást eredményezett [56], ezért az androgén által indukált PPARγ expresszió csökkentése képes lehet befolyásolni a szisztémás energia-anyagcserét.
6. ábra.
A DHEA és a tesztoszteron hatása az agyra, a zsírsejtekre és a vázizomzatra
Az AR teljes testének elhallgattatása későn megjelenő elhízást eredményez [51, 56]. A legújabb technológia megkönnyítette a gén szervspecifikus deléciójának létrehozását. Az adipocita-specifikus AR-hiányos egerek egy testben 20 hetes korban azonos testtömeget és adipozitást mutattak a vad típussal, bár a szerzők nem mutatták be az idősebb egerek adatait [57]. Mivel a 20 hetes kor utáni késői elhízás a megkülönböztető jellemző az ARKO-ban, ez a pont fontos. Ezzel szemben azoknál az egereknél, akiknek a központi idegrendszerben nincs AR-ja, későn jelentkező elhízás és inzulinrezisztencia alakul ki [59]. Noha számos vizsgálat arról számolt be, hogy a miocita-specifikus AR-leütés nem befolyásolta a testtömeget és az adipozitást [60, 61], a myocyta-specifikus AR-túlexpresszió megnövekedett anyagcserét és a zsír testtömegét eredményezte [62]. Ezek az eredmények arra utalnak, hogy a vázizom és az agy felelős szervek lehetnek az androgén által kiváltott zsírszövet csökkentésében. Jelenleg azonban nem zárható ki az AR adipocitákban betöltött szerepe a szisztémás inzulinérzékenységben. További kísérletekre lesz szükség e kérdések tisztázásához.
- A paradicsomecet ital elhízás- és inzulinrezisztencia-ellenes hatása étrend okozta elhízás esetén
- 8 legjobb tesztoszteron fokozó kiegészítő, amely segíti a tesztoszteron fokozását
- Kiegyensúlyozott étrend Energia étrend Okos vélemények az orvosokról, jellemzők és hatások
- Alli felhasználások, adagolás; Mellékhatásokról szóló információk
- Alternaria allergiás hatások otthoni környezetben