Az apoptózis hatása a máj öregedésére
Shao-Jie Hu
Fiziológiai Tanszék, Orvostudományi Főiskola, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína
Sha-Sha Jiang
Fiziológiai Tanszék, Orvostudományi Főiskola, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína
Jin Zhang
Fiziológiai Tanszék, Orvostudományi Főiskola, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína
Dan Luo
Fiziológiai Tanszék, Orvostudományi Főiskola, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína
Bo Yu
Fiziológiai Tanszék, Orvostudományi Főiskola, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína
Liang-Yan Yang
Fiziológiai Tanszék, Orvostudományi Főiskola, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína
Hua-Hua Zhong
Fiziológiai Tanszék, Orvostudományi Főiskola, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína
Mei-Wen Yang
Nővér osztály, Nanchang Egyetemi Kórház, Nanchang 330006, Jiangxi tartomány, Kína
Li-Yu Liu
Nővér osztály, Nanchang Egyetemi Kórház, Nanchang 330006, Jiangxi tartomány, Kína
Fen-Fang Hong
Kísérleti Oktatási Központ, Nanchang Egyetem, Nanchang 330031, Jiangxi tartomány, Kína
Shu-Long Yang
Élettani Tanszék, Orvostudományi Főiskola, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína. nc.ude.ucn@gnayls
A Kínai Nemzeti Természettudományi Alapítvány támogatása: 81660151; 81660751; és 81260504; a kínai Jiangxi tartomány Tudományos Bizottságának tudományos alapítványa, 20161BBG70067; és a kínai Jiangxi Tartományi Természettudományi Alapítvány, 20171BAB205085 .
Levelező szerző: Shu-long Yang, professzor, az Orvostudományi Főiskola élettani tanszéke, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína; nc.ude.ucn@gnayls
Absztrakt
Az öregedés visszafordíthatatlan és évelő folyamatként a szervek funkcionális és morfológiai csökkenésével jár. Általában az öregedő májban csökken a térfogat és a máj véráramlása. A májsejtvesztés utáni funkcióinak helyreállítását megelőző regenerációs képesség mellett is csökken a bioszintézis és az anyagcsere képessége, és ezeket nehéz visszaállítani a korábbi normákhoz. Az apoptózis egy programozott halálozási folyamat intrinsic és extrinsic utakon keresztül, amelyben a Bcl-2 család fehérjéi és az apoptózissal kapcsolatos gének, például p21 és p53 vesznek részt. Az apoptózis kedvező és kedvezőtlen hatást gyakorol a máj öregedésére. Az apoptózis kiküszöböli a transzformált kóros sejteket, de elősegíti az életkorral összefüggő májbetegségeket, például az alkoholmentes zsírmájbetegséget, a májfibrózist, a cirrhosist és a májrákot. Összefoglaljuk az apoptózis szerepét a máj öregedésében és az életkorral összefüggő májbetegségekben.
Alap tipp: Az öregedő máj funkcionális és morfológiai változásokat mutat. Az apoptózis kiküszöböli a transzformált kóros sejteket, de elősegíti az életkorral összefüggő májbetegségeket, például az alkoholmentes zsírmájbetegséget, a májfibrózist, a cirrhosist és a májrákot. Az apoptózis, beleértve az intrinsic és extrinsic útvonalakat, védő és káros hatással van a máj öregedésére. Az életkorral összefüggő májbetegségek előfordulása, fejlődése és kezelése szorosan összefügg a máj öregedésével és apoptózisával. Ez a cikk az apoptózis máj öregedésre gyakorolt hatását dolgozza fel.
BEVEZETÉS
Sejt-apoptózis jelző utak
A sejtek apoptózisát külön-külön extracelluláris vagy intracelluláris kaszkád jelátviteli útvonalak közvetítik. Az extracelluláris út főleg speciális ligandumokat tartalmaz, amelyek befelé szignalizációs útvonalakon keresztül aktiválják receptorait. Ezzel szemben az intracelluláris apoptózis útja intracelluláris organellákra támaszkodik, mint például a mitokondrium és az ER [17].
EXTRINSZIKUS JELZŐ ÚT
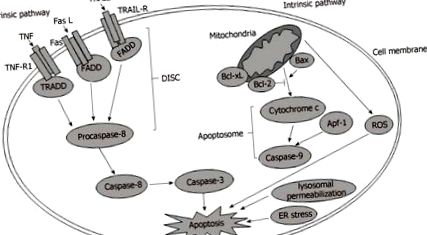
Az extracelluláris ligandumok és a hozzájuk tartozó receptorok kötődése a plazmamembránon az első lépés, amellyel a sejt apoptózisa elindul az extrinsic jelátviteli úton. Ezeket a receptorokat halálreceptoroknak nevezik, beleértve a tumor nekrózis faktor 1 receptorát (TNF-R1), a TNF-hez kapcsolódó apoptózist kiváltó ligandum receptorokat (TRAIL-R) és a Fas-t [18]. A megfelelő extracelluláris ligandumok közé tartozik a TNF-alfa (TNF-a), a TRAIL és a Fas ligandum. Amikor a halálreceptorokat ligandumaik aktiválják, a halálreceptorok konformációs változásai következnek be, és tripolimer képződik. Ezenkívül az aktivált receptorok toboroznak citoplazmatikus adaptermolekulákat, beleértve a Fas-asszociált haláldomént tartalmazó fehérjét és a TNFR-asszociált haláldomént [19]. Sőt, apoptózist jelző molekulákat is toboroznak. Az adaptermolekulák ezután kötődnek az apoptózis-jelző molekulákhoz, hogy a halált kiváltó jelátviteli komplex (DISC) nevű komplexet képezzék [20]. Végül a DISC a kaszpáz-8 aktiválásához vezet, a kaszpáz-8 pedig a hóhér kaszpázokat, például a kaszpáz-3-t aktiválja az apoptózis kiváltásához [21].
INTRINSZIKUS JELZŐ ÚT
Az intrinsic útvonalon belül az organelle diszfunkció különböző szempontokból váltja ki az apoptózist. Például a lizoszomális permeabilizáció, az ER stressz, a mitokondriális diszfunkció és más organellumok perturbációja egyaránt szerepet játszik az apoptózisban [22]. Ezen organellák közül a mitokondrium a főszereplő az apoptózis elindításában és előrehaladásában [23]. A mitokondriális diszfunkció indukálja a mitokondriális permeabilitás átmeneti pórusának (mtPTP) megnyílását, amely lehetővé teszi a pro-apoptotikus fehérjék, például a citokróm c felszabadulását a mitokondriális intermembrán térből a citoplazmába. Ezt követően a citokróm c, az apoptotikus fehérje aktivációs faktor-1 és a kaszpáz-9 részvételével egy apoptoszóma néven ismert komplex képződik, amely a downstream effektor kaszpáz-3-at aktiválja az apoptózis kiváltására (1. ábra: 1. ábra) [24, 25].
Külső és belső útvonalak a máj apoptózisában. ROS: Reaktív oxigénfajok; ER: Endoplazmatikus retikulum; TNF-R1: Tumor nekrózis faktor receptor; TRAIL-R: A tumor nekrózis faktorral összefüggő apoptózis-indukáló ligandum receptor; DISC: Halált kiváltó jelző komplex.
A mitokondriumot közvetlenül vagy ferdén szabályozzák a Bcl-2 család fehérjéi, amelyek három csoportra oszthatók: a Bax, Bak és Bok alkotta pro-apoptotikus multi-domén fehérjék; a csak apoptotikus BH3 fehérjék, például Bad; és az anti-apoptotikus multi-domén fehérjék, beleértve a Bcl-2, Bcl-XL és Bcl-W [26,27]. További proapoptotikus fehérjékkel a pro-apoptotikus fehérjék és az anti-apoptotikus fehérjék, például a Bax/Bcl-2 aránya jelentősen megnő, ami celluláris apoptózist okoz [28]. A mitokondriális diszfunkció ROS keletkezését eredményezi, amelyet elsősorban a telepített elektrontranszport-lánc és a mitokondriumban tapasztalható túlzott stressz vált ki [29]. Tekintettel arra, hogy az oxigén nagy részét a mi-tochondrion fogyasztja, a mitokondrium meghatározza a legtöbb oxigén szabad gyököt és hidroperoxidot. Tekintettel arra, hogy a mitokondriális diszfunkció hozzájárul az ROS túlterheléséhez, a ROS bősége káros és lipotoxicitáshoz, DNS-elváltozáshoz és fehérjekárosodáshoz vezet [30,31].
AZ APOPTÓZIS VÉDELMI HATÁSAI A MÁJ öregedésére
A transzformált sejtek eliminációja
Fiziológiai körülmények között a máj intrinsic apoptózisa az életkor előrehaladtával növekszik [32]. Ha a napi étrendből és a szabad gyökökből származó genotoxinoknak vannak kitéve, a sérült hepatociták a DNS károsodása következtében kellő öntisztulás nélkül neopláziát képezhetnek [33]. Szerencsére az apoptózis időben megszünteti a kóros sejteket a rosszindulatú változások elkerülése és a homeosztázis megőrzése érdekében. A kóros sejtekkel ellentétben a normál májsejtek szaporodnak és megújulnak, ezáltal fenntartva alapvető fiziológiai funkciójukat [34]. Giorgadze és mtsai [35] fiziológiai körülmények között értékelték az életkor hatását hím patkányok hepatocita apoptózisára és szaporodására. Eredményeik azt sugallták, hogy öregedő patkányokban a májsejtekben a poliploid magok mennyisége drámaian magas volt, összehasonlítva a fiatal patkányokéval. A poliploid sejtek azonban kevesebb túlélési lehetőséget mutattak ki, mint a májsejtek. Ha túl sok poliploid sejt van jelen, és hiányoznak a megújuló sejtek, akkor a májkárosodás során meghibásodás léphet fel. Tekintettel arra, hogy a poliploid sejtek apoptózissal eliminálódnak a májelégtelenség elkerülése érdekében, úgy tekintik, hogy az apoptózis védi a máj öregedését.
Az oxidatív stressz csökkenése
Az öregedés szabadgyökök elméletét először Harman javasolta 1956-ban, amelyben úgy gondolták, hogy az oxidatív stressz szorosan összefügg az öregedéssel [36]. A máj öregedése során a túlzott oxidatív stressz ROS-t generál, amely megzavarja az oxidatív és antioxidatív folyamatok egyensúlyát és májkárosodást vált ki. A mérsékelt apoptózis fenntarthatja a máj homeosztázisát a transzformált sejtek megtisztításával. A túlzott oxidatív stressz azonban túlzott apoptózist vált ki, rontja a máj működését és felgyorsítja a máj öregedését [37]. Ezért az oxidatív stressz megoldása érvényes stratégia lehet az apoptózis csökkentésére és a máj megvédésére a ROS túlterheléstől.
Kalória korlátozás
AZ APOPTÓZIS TETT HATÁSAI A MÁJ öregedésére
Mitokondriális diszfunkció
Vas és szfingolipid felhalmozódása
Az öregedés során a különféle káros változások felhalmozódása károsítja a homeosztázis megőrzésének májfunkcióit [62]. A máj tisztító képessége csökken az öregedéssel, ami különféle káros anyagok, például vas és szfingolipid felhalmozódását váltja ki. Az öregedési folyamat eredményeként a vas lerakódása vasfelesleghez vezet, ezáltal növelve a reaktív oxigén- és nitrogéntartalmú anyagok koncentrációját, és a szuperoxid toxicitását és az NO antioxidáns kapacitásának zavarát okozza [63,64]. Az öregedő máj mitokondriumokban a nem hem vas felhalmozódása fokozza az mtPTP megnyílását, ami megváltoztatja a membrán permeabilitását, sőt különféle jelátviteli transzdukciós molekulák felszabadulását okozza, amelyek végül mitokondriális diszfunkciót és oxidatív károsodást váltanak ki [65].
Az apoptózis hibája
Az apoptózis hibája megzavarja az antiapoptotikus és a proapoptotikus homeosztázist, és fokozatosan súlyos szervi diszfunkciókat okoz. A cisztein proteázcsalád részeként a kaszpáz-2 részt vesz az apoptózisban, és az oxidatív stresszhez viszonyított jelekkel aktiválható. Az emlősök májöregedésében a kaszpáz-2 hiányban szenvedő máj megnövekedett oxidált fehérjetartalommal rendelkezik a vad típusú májhoz képest, ami arra utal, hogy a károsodott sejtek eliminálásának aktivitása károsodott. Ezenkívül a kaszpáz-2 hiány apoptózist okozhat azáltal, hogy befolyásolja a hóhér kaszpáz-3-at, majd apoptózis-rendellenességet indukál [76]. Itt foglaljuk össze az apoptózis máj öregedésre gyakorolt hatását szisztematikusan a 2. ábrán 2 .
Az apoptózis folyamatának hatása a máj öregedésére. ER: Endoplazmatikus retikulum; DISC: Halált kiváltó jelző komplex; ROS: Reaktív oxigénfajok; CR: kalória-korlátozás; NAFLD: alkoholmentes zsírmájbetegség; HSC: Májcsillagsejtek.
AZ APOPTÓZIS HATÁSAI AZ ÉLETKORÚSÁGÚ MAKBETEGSÉGEKRE
NAFLD
A túlzott lipidek áttelepedhetnek a telített fehér zsírszövetből a nem zsírszövetekbe, például a májba, és nem oxidatív utakba léphetnek, ahol a toxikus reaktív lipidfajok keletkeznek. A reaktív lipidek által kiváltott lipotoxicitás végül apoptózishoz vezethet a májban [77]. A NAFLD-t, amelyet a lipidek, például trigliceridek, szabad zsírsavak, koleszterin és foszfolipidek jelentős felhalmozódása jellemez, a leggyakoribb krónikus májbetegségnek tekintik [78,79] (ábra (3. ábra). 3). A NAFLD a májbetegségek széles spektrumából áll, a jóindulatú máj steatosistól az alkoholmentes steatohepatitisig (NASH), az előrehaladott fibrózisig, a cirrhosisig, sőt a hepatocellularis carcinomáig is [80,81].
Az alkoholmentes zsírmájbetegség okai és kezelése. NAFLD: alkoholmentes zsírmájbetegség; ER: Endoplazmatikus retikulum; CAT: kataláz; UPR: kibontakozott fehérjeválasz.
Májfibrózis
Tartós májkárosodás során a májfibrózis az extracelluláris mátrix (ECM) termelődésének és lebomlási egyensúlyhiányának következménye. Miután a fibrogenezis meghaladja a fibrolízist, az ECM lerakódik és májfibrózishoz vezet. Valójában a túlzott ECM mellett a májfibrózis krónikus májbetegségek következménye, mint például a NASH és a vírusos hepatitis [101]. A májfibrózis kialakulásában a májstellátum sejtek (HSC) és más myofibroblasztikus sejtek aktiválása a fibrogenezis fő mechanizmusa. A hepatociták jelentősen károsítják a regenerációt, majd krónikus sérülésnek kitéve ECM-mel helyettesítik őket [102]. Így a HSC-k aktiválása és a hepatocita apoptózis részt vesz a májfibrózis előfordulásában [76].
Cirrózis
Szövettani szempontból a cirrhosust regeneratív csomók strukturálják, amelyeket rostos sávok vesznek körül, és a májfibrózis előrehaladott stádiumának tekintik [114]. Néhány beteg számára a NASH és a hepatitis C vírus a cirrhosis két kockázati tényezője [115,116]. A cirrhosis kezdeti klinikai megnyilvánulása a máj érrendszeri rendellenességei, például a portális hipertónia, a terminális cirrhosisra pedig súlyos szövődmények jellemzők, mint például a máj encephalopathia [117].
A telomerek megismétlik a hexanukleotid szekvenciákat, és a kromoszóma vég-fúziójának elkerülésével fenntarthatják a kromoszómák stabilitását. A máj öregedése során a telomerek hosszának arányos csökkenése következik be az öregedés előrehaladtával [118]. Wiemann és munkatársai [119] azt találták, hogy a cirrhosisban lévő telomerek szignifikánsan rövidülnek, mint a nem cirrhosisos mintáknál. Különösen a májcirrhosisban a telomer rövidülése a májsejtekben nyilvánvalóbb, mint a csillagképes sejtekben, a hepatociták öregedése és telomer rövidülése szorosan összefügg a fibrózisból a cirrhosisra való előrehaladással. A cirrhosis stádiumában a telomer rövidítése korlátozza a hepatocita megújulási képességét azáltal, hogy kiváltja a p53/p21 utat, amely megemeli a hepatociták apoptózisát, ezáltal felgyorsítja a cirrhosis fejlődését és progresszióját [120,121]. Ezenkívül az ER stressz cirrhosis kialakulását vonja maga után. Az ER stresszhez kapcsolódó fehérjék, beleértve az inozitot igénylő 1-es enzimet és a C/EBP homológ fehérjét, aktiválódnak és apoptózist indukálnak cirrhosisban [122].
A cirrhosis hepatocelluláris karcinómává válása bonyolult és hosszú távú folyamat, amelynek mechanizmusa még nem tisztázott, de szorosan magában foglalhatja a sejt apoptózis és a cirrhosis kapcsolatát [123]. Xu és mtsai [124] felfedezték, hogy a dietil-nitrozamin által kiváltott patkány májcirrózisában a máj ovális sejtjei aktiválódnak és szaporodnak a hepatocita apoptózis stimulálása alatt, ami a cirrhosis és a hepatocellularis carcinoma közötti fejlődés fő mozgatórugója lehet.
Májrák
A karcinogenezis elválaszthatatlan az apoptózistól és a sejtek öregedésétől. Az apoptózis és az öregedés általában két jó mechanizmus a rák progressziójának elnyomására, de a rák későbbi szakaszában károsra fordulhat [125]. 40 éves kor után a májsejtes karcinóma előfordulása az életkor előrehaladtával fokozatosan növekszik, de 70–75 éves kor körül csökken [126]. Az öregedő májban az apoptózist perturbáció és egyensúlyhiány jellemzi. Így nagyon nehéz fenntartani a hepatocita-szám stabilitását és megőrizni a májfunkciókat. Ennek a folyamatnak a folytatása fokozatosan tovább csökkenti az apoptózist és növeli a májrák előfordulását. Maga az apoptózis megszüntetheti a máj abnormális sejtjeit. Ha az apoptózist túlságosan elnyomják, és a kóros májsejteket nem lehet időben megszüntetni, ezek a kóros sejtek rákossá válhatnak, és végül májrákhoz vezethetnek [33]. A peroxiszóma-proliferátorral aktivált alfa-receptor (PPARα) agonistái, például a peroxiszóma-proliferátorok, elnyomhatják a hepatocita-apoptózist [127]. Az aktivált PPARα a Bax mRNS és Fas mRNS expressziójának csökkentésével és a kaszpáz-2 szintjének csökkentésével elnyomja a máj apoptózisát, ami elősegítheti a májrák kialakulását [128].
KÖVETKEZTETÉS
A máj olyan funkciókkal helyettesíthetetlen szerv, beleértve a fehérjeszintézist és a méregtelenítést, funkciói és állapota hosszú távon kritikus az emberi egészség szempontjából. A máj öregedése természetes és spontán folyamat, amelynek fiziológiai funkciója csökken és morfológiai változásai vannak [1,2]. A belső és az extrinsic útvonal két elsődleges mechanizmus vesz részt az apoptózisban, és egyes esetekben szinergikus hatásokat érhet el [13]. A máj öregedésében az apoptózist kétélű kardhoz hasonlítják: a túlzott apoptózis májsejtvesztést okoz, amely könnyen májelégtelenséghez vezethet, míg az elégtelen apoptózis kóros sejtek felhalmozódásához vezethet, ami rosszindulatú sejtek képződéséhez vezethet [ 133].
Lábjegyzetek
Összeférhetetlenségi nyilatkozat: A szerzők nem érdekeltek ebben a munkában.
Kézirat forrása: Kéretlen kézirat
A szakértői értékelés megkezdődött: 2018. november 26
Első döntés: 2018. december 12
Cikk a sajtóban: 2019. január 26
Specialitás típusa: Orvostudomány, kutatás és kísérlet
Származási ország: Kína
Peer-review jelentés osztályozása
A osztály (Kiváló): 0
B osztály (nagyon jó): B, B
C fokozat (jó): C, C
P-Reviewer: Cheng TH, Demonacos C, Gassler N, Sugimura H S-szerkesztő: Wang JL L-szerkesztő: Wang TQ E-szerkesztő: Wu YXJ
Közreműködői információk
Shao-Jie Hu, Fiziológiai Tanszék, Orvostudományi Főiskola, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína.
Sha-Sha Jiang, Orvostudományi Főiskola, Élettani Tanszék, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína.
Jin Zhang, az Orvostudományi Főiskola élettani tanszéke, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína.
Dan Luo, az Orvostudományi Főiskola élettani tanszéke, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína.
Bo Yu, az Orvostudományi Főiskola élettani tanszéke, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína.
Liang-Yan Yang, Orvostudományi Főiskola, Élettani Tanszék, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína.
Hua-Hua Zhong, az Orvostudományi Főiskola élettani tanszéke, Nanchang Egyetem, Nanchang 330006, Jiangxi tartomány, Kína.
Mei-Wen Yang, ápoló osztály, Nanchang Egyetemi Kórház, Nanchang 330006, Jiangxi tartomány, Kína.
Li-Yu Liu, ápoló osztály, Nanchang Egyetemi Kórház, Nanchang 330006, Jiangxi tartomány, Kína.
Fen-Fang Hong, Kísérleti Oktatási Központ, Nanchang Egyetem, Nanchang 330031, Jiangxi tartomány, Kína.
- A ketogén étrend hatása a zsírszövet, a máj és a szérum biomarkerekre ülő patkányokban és
- Az omega-3 zsírsav hatása alkoholmentes zsírmájbetegségben A metaanalízis
- Tőkehal májolaj egészségügyi előnyei, felhasználása, mellékhatásai, adagolása és kölcsönhatásai
- Ösztrogén őrzi a zsíros máj hatásait a MedPage Today
- A bársony agancs polipeptid hatása az öregedő férfi szexuális viselkedésére és tesztoszteron szintézisére