Az elektroakupunktúra gátolja az étrend okozta elhízott patkányok súlygyarapodását azáltal, hogy aktiválja a hipotalamusz LKB1-AMPK jelátvitelt
Absztrakt
Háttér
A beszámolók szerint az elektroakupunktúra (EA) hatékony kezelés az elhízás szempontjából, de mechanizmusa nem világos. Ez a tanulmány a hipotalamusz LKB1-AMPK-ACC jelátvitel és az EA kapcsolatának vizsgálatát tűzte ki célul.
Mód
Ötven hím Sprague – Dawley patkányt két csoportra osztottunk, vagy chow-val (chow-táplált csoport), vagy magas zsírtartalmú étrenddel (HF-csoport). 4 hetes etetés után a HF-csoport elhízott patkányait (amelyek meghatározása szerint 20% vagy annál nagyobb testtömegűek, mint a chow-táplált csoportban lévő patkányokat) véletlenszerűen osztottak be egy EA vagy Diet által kiváltott elhízás (DIO) csoportba. Az EA csoport 4 héten keresztül kétoldalú ST25 – ST36-on kapott EA-t, míg a DIO csoport további beavatkozást nem kapott. A chow-táplált, DIO és EA csoportok testtömegét hetente mértük. A hipotalamusz LKB1-AMPK-ACC jelátviteli útjának mRNS- és fehérjeszintjét valós idejű (RT) -PCR és Western blot alkalmazásával detektáltuk.
Eredmények
4 hetes EA-kezelés után az EA-csoport patkányainak súlynövekedési trendje gátolt volt, összehasonlítva a DIO-csoportéval. Az RT-PCR és a Western-blottolás azt mutatta, hogy az EA szabályozta az adenozin-5′-monofoszfát-aktivált protein kináz α2 (AMPKα2) transzkripcióját, elősegítette a máj kináz B1 (LKB1) és az AMPKα1 fehérje expresszióját, és gátolta az acetil-CoA karboxiláz (ACC) fehérjét. expresszió a hipotalamuszban.
Következtetések
Ez a tanulmány azt sugallja, hogy a hipotalamusz LKB1-AMPK-ACC jelátvitele fontos szerepet játszik az elhízás EA kezelésében.
Háttér
Az elhízás világméretű közegészségügyi probléma, és olyan betegségekhez vezethet, mint a szívkoszorúér-betegség, a cukorbetegség és néhány rák [1]. Számos vizsgálatot végeztek az egyre növekvő elhízott népesség visszaszorítására, de kevés hatékony farmakológiai kezelés létezik. Az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala csak három gyógyszert hagyott jóvá hosszú távú elhízás kezelésére, nevezetesen a lorcaserint (Belviq), a phentermint plusz topiramátot (Qsymia) és az orlistatot (Xenical, Alli) [2].
Az akupunktúra az egyik legnépszerűbb alternatív terápia, és évezredek óta alkalmazzák az elhízás kezelésére. Az elektroakupunktúra (EA) az akupunktúra egyik általános formája, amelyben az elektromos áramot az akupunktúrás tűk vezetik át. Az EA paraméterei pontosan jellemezhetők, tehát megismételhetőek, és az adatok arra utalnak, hogy az EA hatékonyabb lehet, mint a kézi akupunktúra [3]. A legutóbbi szisztematikus felülvizsgálatok azt mutatják, hogy az EA hatékony kezelés az elhízás ellen [4]. Az EA elhízással kapcsolatos mechanizmusa azonban további vizsgálatokat igényel. Bizonyítékok vannak arra utalva, hogy az EA elnyomhatja az étvágyat a súly kontrollálásához. Az EA hatásának lehetséges mechanizmusai a hipotalamuszra összpontosítanak [5, 6].
A hipotalamusz szabályozza a táplálékfelvételt és az energiaegyensúlyt. A hipotalamusi adenozin-5 ′ monofoszfát-aktivált protein-kinázt (AMPK) a központi idegrendszer tápanyag- és glükózérzékelőjeként, valamint az étvágy szabályozójaként ismerik el [7, 8]. A máj kináz B1 (LKB1) a fő upstream kináz az AMPK kaszkádban. Az LKB1 konstitutívan aktív és az α alegység Thr172-nél foszforilálja az AMPK-t [9–11]. Az AMPK aktivációja megszűnik az LKB1 expresszió hiányában szenvedő sejtekben, vagy rágcsálókban az LKB1 törlése után [12, 13]. Az egyik mechanizmus, amellyel az AMPK szabályozza a lipid anyagcserét, az acetil-CoA karboxiláz (ACC) foszforilezésén és inaktiválásán keresztül történik, amely a malonil-CoA szintézisének fontos sebességkorlátozó enzimje [14]. Az ACC mind a zsírsav-bioszintézis előfutára, mind a hosszú láncú zsír-acil-CoA mitokondriumba történő transzportjának gátlója a β-oxidációhoz [15]. Beszámoltak arról, hogy az ACC1 és az ACC2 leütése/kiütése folyamatos zsírsav-oxidációt, megnövekedett energiafelhasználást és csökkentett zsírtömeget okoz [16, 17].
Számos tanulmány vizsgálta az EA és az AMPK kapcsolatát. Tominaga és mtsai. [18] azt sugallta, hogy az ismételt EA-terápia képes javítani az étrend által kiváltott inzulinrezisztenciát, esetleg AMPK jelátvitel révén a vázizomzatban. Közvetlenül az EA stimuláció után a foszfo-AMPKα (Thr172) szignifikánsan magasabb volt az EA-t kapó állatoknál, mint a kontroll állatoknál. Kim és mtsai. [19] kimutatta, hogy az AMPK gén expressziójának szintje a patkány hipotalamuszában meghatározza az EA által kiváltott fájdalomcsillapítás iránti érzékenység egyéni különbségeit. A hipotalamuszban azonban nem végeztek alapos vizsgálatot az EA és az AMPK tekintetében.
Az étrend okozta elhízás (DIO) patkány modell alapján megfigyeltük, hogy az EA gátolhatja-e a HF étrendet kapó patkányok súlygyarapodását. Vizsgáltuk a hipotalamusz LKB1-AMPK-ACC szignalizációjának szerepét az elhízás patológiájában és az EA kezelés mechanizmusában is.
Mód
Állatok és kísérleti protokoll
54 hetes hím Sprague – Dawley patkányokat (80–100 g) a Dossy Experimental Animals Company-tól (Chengdu, Kína) szereztünk be. Az állatokat szobahőmérsékletű (22 ± 2 ° C) hőmérsékletű létesítményben helyeztük el, és 12/12 órás világos-sötét ciklusokban tartottuk fenn a fényt (7: 00-tól 19: 00-ig világított). Az új környezethez való alkalmazkodás érdekében az összes patkányt standard laboratóriumi chow-val és rendelkezésre álló vízzel etették ad libitum a kísérlet első hetében. Az állatokat véletlenszerűen két csoportra osztottuk: egy chow-táplált csoportra és egy magas zsírtartalmú (HF) csoportra. A chow-táplált csoport (n = 13) standard laboratóriumi chow-t kapott (Dossy Experimental Animals Company, 3,80 kcal/g), amely 5% zsírt, 55% szénhidrátot, 22% fehérjét, 7% hamu és 5% rostot tartalmaz. A HF csoport (n = 35) HF étrendet kapott (4,72 kcal/g), amely 22% zsírból, 39% szénhidrátból, 23,7% fehérjéből, 4% hamuból és 3% rostból állt. A HF-ételek a szerzők laboratóriumában készültek. Minden 100 g HF-táplálék alaptakarmányból (57,5 g), tojássárgája porból (11,79 g), zsírból (10 g), sertés epesóból (0,2 g), kazeinből (7 g), tejből (13 g) állt., só (0,085 g) és élesztőpor (0,425 g). A testtömeget hetente egyszer, 9:00 órakor ellenőriztük.
Négy héten át tartó etetés után 24 HF-étrenddel táplált patkány súlya 20% -kal vagy annál nagyobb volt a chow-takarmány-csoportba tartozó patkányok átlagos súlyánál, és elhízottakként definiálták. Ezeket a patkányokat ezután véletlenszerűen allokáltuk egy EA-csoportba, amely négy hétig EA-stimulációt kapott, és egy DIO-csoportba, amely nem kapott további kezelést, mindegyik csoportban 12 patkánnyal. Az EA, DIO és a chow-táplált csoportokat külön-külön helyeztük el, és a megfelelő étrendjükkel etettük. A táplálékfelvételt és a testtömeget naponta 4 héten keresztül mértük. A vizsgálat végén hipotalamit gyűjtöttek. A tanulmányt a Chengdu Egyetem Hagyományos Kínai Orvostudományának Intézményi Állattenyésztési és Felhasználási Bizottsága hagyta jóvá, és az összes eljárást az Állatkísérleti Irányelveknek és a Kínai Tudományos Akadémia állatgondozásának megfelelően hajtották végre.
EA kezelés
A három csoport patkányait tudatosan visszatartották egy műanyag tartóba. Az EA csoportot kétoldalú Tianshu (ST25) és Zusanli (ST36) akupontokkal kezeltük 20 percig 8:00 és 12:00 óra között, naponta egyszer, heti 6 napon át, összesen négy hétig. A felhasznált tűk eldobható steril rozsdamentes acél tűk voltak, 0,30 mm átmérőjűek és 25 mm hosszúak (Suzhou Hua Tuo Medical Instruments Co. Ltd., Suzhou, Kína). A pontokat a patkányokra vonatkozó szabványok alapján választották ki, amint azt a Kísérleti Akupunktúra és a Moxibustion [20] rögzítette. A Tianshu (ST25) a köldöktől 5 mm-re helyezkedik el (5 mm-re a felső 2/3 és az alsó 1/3 kereszteződéséhez képest a xiphoid folyamat és a szeméremszimmetrikus felső határ közötti vonalban). A Zusanli (ST36) a sípcsont és a fibula között helyezkedik el, körülbelül 5 mm oldalirányban és 5 mm-rel lejjebb a sípcsont elülső tuberkulcsától. Az akupontokat folyamatos hullámú, 2 mA intenzitású és 3 Hz frekvenciájú elektromos ingerrel stimuláltuk 20 percig, hogy a végtagokban enyhe rángatózás keletkezzen. A G6805-II EA műszert (20 101 014, Qingdao Xinsheng Ltd., Qingdao, Kína) használták. A chow-táplált és a DIO csoportban lévő patkányokat 20 percig visszatartottuk EA stimuláció nélkül. A patkányok nem mutattak fájdalmat vagy kényelmetlenséget a kezelések során.
Az összes kísérleti patkányt 10 órán át éheztettük az utolsó beavatkozás után, és testtömegüket feljegyeztük (g). 20% uretán (0,8 g/kg) altatásban a patkányokat eutanizáltuk. Ezután a hipotalamusz szöveteit boncoltuk további vizsgálatok céljából.
Western blot elemzés
A hipotalamikat az optikai chiasm segítségével rostralis iránypontként boncoltuk, és a mammilláris testeket caudálisan 2 mm mélységig. A boncolt hipotalamit azonnal folyékony nitrogénben lefagyasztották. A szöveteket jéghideg lízispufferben homogenizáltuk, amely 0,1% SDS-t, 10 mM Tris-HCl-t (pH 7,4), 1% Triton X-100-ot, 1 mM MgCl2-t és 1% NP-40-t tartalmazott. A homogenátumokat 10 000-nél centrifugáltuk g 10 percig 4 ° C-on a felülúszókat eltávolítottuk, és az alikvot részeket folyékony nitrogénben gyorsfagyasztottuk. A hipotalamus-lizátumot (40 μl) nátrium-dodecil-szulfát - poliakrilamid gélelektroforézisnek vetettük alá (SDS-PAGE) 6% -os poliakrilamid géleken és elektrotranszferrel nitrocellulóz membránon (Millipore, Massachusetts, USA).
A membránokat 1,5 órán át blokkoltuk szarvasmarha-laktó transzfer technika optimalizáló hibridizációs oldatban (50 mM Tris [pH 8,0], 2 mM CaCl2, 0,01% habzásgátló A, 0,02% NaN3 és 0,05% Tween 20), amely 5% sovány tejet tartalmazott. Ezután a membránokat 4 ° C-on, Tris-pufferolt sóoldatban és Tween 20-ban (TBST) vizsgáltuk egy éjszakán át a jelzett antitestek megfelelő hígításával az LKB1 (Abcam, Cambridge, Egyesült Királyság), ACC (Abcam, Cambridge, Egyesült Királyság), p-AMPKα1 ellen. (Abcam, Cambridge, Egyesült Királyság), AMPKα1 (Saierbio, Tianjin, Kína), p-AMPKα2 (Abcam, Cambridge, Egyesült Királyság), AMPKα2 (Saierbio, Tianjin, Kína) és GAPDH (Saierbio, Tianjin, Kína).
A fehérjék kimutatását torma-peroxidáz-konjugált szekunder antitestekkel (kecske nyúlellenes antitest, Saierbio, Tianjin, Kína) és fokozott kemilumineszcencia reagenssel (Western Lightning-ECL; Perkin Elmer, Waltham, MA, USA) használtuk, majd filmnek tettük ki . A fehérje sávok intenzitását a Lab Works 4.0 szoftver (UVP Inc., Upland, CA, USA) segítségével számszerűsítettük.
RNS extrakció és valós idejű PCR
Statisztikai analízis
Valamennyi kísérleti adatot átlag ± szórásként fejezzük ki. A statisztikai elemzést az SPSS Statistics for Windows, 20.0 verzió (IBM, Armonk, NY, USA) és egyirányú ANOVA végezte a csoportok közötti összehasonlításhoz. Minden elemzéshez P
Eredmények
Az EA gátolja a HF-diéta súlygyarapodását
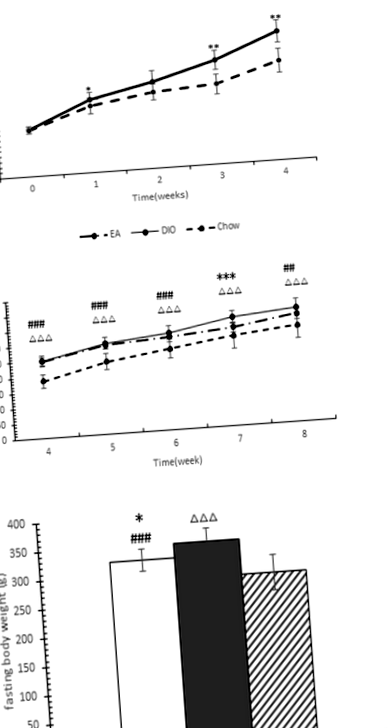
Az 1a. Ábra azt mutatja, hogy a HF-vel táplált csoportban a patkányok 4 hét alatt nagyobb testtömeget nyertek, mint a chow-vel etetett állatok. A testsúly különbségei 1 héttől kezdve észrevehetőek voltak, de 4 hét után jelentősek voltak. 24 HF-táplálékkal táplált patkány elhízott (20% -kal vagy annál nagyobb tömeggel nőtt a patkányok átlagos súlya felett a chow-táplált csoportban), és 4 hét végén két csoportra osztották őket. A DIO csoportban 12 és az EA csoportban 12 patkány volt.
Az 1b. Ábra azt mutatja, hogy az EA-kezelés gátolja a testtömeg-növekedést a HF-táplálékkal etetett patkányokban. A legjelentősebb különbségeket az EA és a DIO csoportok között a hetedik héten figyeltük meg (P = 0,001), bár a testtömeg a két csoport között nem volt szignifikáns különbség (5,49% -kal alacsonyabb az EA csoportban, P = 0,129) a végén a kísérlet. Az 1c. Ábra azt mutatja, hogy az EA csoport patkányainak testtömege szignifikánsan alacsonyabb volt, mint a DIO csoportban, 10 órás éhezés után (P = 0,027).
Az EA hatása a hipotalamusz AMPK jelzésére
A 2a. Ábra azt mutatja, hogy a HF-táplálékkal etetett patkányok alacsonyabb LKB1 (P = 0,000), AMPKα1 (P = 0,020) és AMPKα2 (P = 0,000) expresszióval rendelkeznek, és az ACC transzkripciója szignifikánsan magasabb volt (P = 0,024), mint a patkányoknál. chow-táplált csoport. Az EA csoportban körülbelül 48,03% -kal több AMPKα2 (P = 0,000) és 13,59% -kal kevesebb AMPKα1 mRNS (P = 0,000) transzkriptum volt, mint a DIO csoportban.
A 2b. Ábra mutatja, hogy a HF-diéta elnyomhatja az LKB1 (P = 0,000), az AMPKα1 (P = 0,019), a pAMPKα1 (P = 0,000) és a pAMPKα2 (P = 0,000) fehérjetartalmat, és növelheti az ACC (P = 0,000) 0,005). Az EA csoportban 182,89% -kal magasabb LKB1 (P = 0,000), 135,42% -kal magasabb pAMPKα1 (P = 0,002) és 84,27% -kal alacsonyabb ACC (P = 0,003), 19,72% -kal alacsonyabb AMPKα2 (P = 0,007) fehérje szint volt, mint a DIO csoport.
Vita
Megfigyeltük, hogy 4 hét HF diéta után a patkányok közel 50% -a elhízott. A 4 hetes EA-kezelés alatt az EA-csoport patkányai a harmadik héttől kezdve lassabban híztak, mint a DIO-csoporté. Az RT-PCR és a Western blotting kimutatta, hogy a hipotalamuszban az LKB1-AMPK jelátvitelt gátolja a HF diéta, és az ACC jelentősen felülszabályozott. Az EA szabályozhatja az AMPKα2 transzkripcióját, elősegítheti az LKB1 és az AMPKα1 fehérje expresszióját, és gátolhatja az ACC fehérje expresszióját a súlygyarapodás szabályozásában.
Az AMPK széles körben expresszálódik a hipotalamusz és a hátsó agy idegsejtjeiben és asztrocitáiban, amelyek mind az élelmiszer-bevitel területén részt vesznek [21]. Normál fiziológiai körülmények között a hipotalamusz AMPK aktiválható az 5-aminoimidazol-4-karboxamid 1-β-D-ribofuranozid (AICAR) infúzióval a harmadik kamrába, ami jelentősen megnöveli a táplálékfelvételt [22]. A domináns negatív AMPK expressziója a hipotalamuszban csökkentheti a táplálékfelvételt és a testsúlyt [23].
Az egerek HF-táplálékkal történő etetése az AMPK jelátviteli útjának diszregulációját idézi elő, ami az AMPK foszforilációjának károsodásával és a vázizomzatban, a májban és a hipotalamuszban csökkent fehérje-expresszióval jár együtt [24–27].
Kóros körülmények között a rágcsálók különböző modelljeiben szoros összefüggést állapítottak meg az AMPK alacsony aktivációs állapota és az anyagcsere-rendellenességek, mint például az elhízás, az inzulinrezisztencia és a mozgásszegény tevékenységek között [28, 29]. Ezért az AMPK hiányos egerek érzékenyebbek lehetnek a túlzott táplálkozás káros hatásaira [30]. Ezzel a hipotézissel összhangban az AMPKα2 aktivitás teljes testének ablációja súlyosbítja a HF diéta által kiváltott elhízást, míg a glükóz ártalmatlanítási aránya hasonló a vad típusú egerekénél [31].
Az energiamérleg egyik legfontosabb szabályozójaként az AMPK szoros kapcsolatban áll számos anyagcserével kapcsolatos hormonral, különösen az adipocitokinekkel, mint például a leptin, az adiponektin és az apelin. Fiziológiai körülmények között a leptin [32] gátló hatást gyakorol az AMPK-ra a hipotalamuszban az ACC stimulálásával és azután az elfogyasztott táplálék elnyomásával, miközben a hipotalamusz AMPK konstitutív aktiválása megzavarja a leptin anorexigén hatását. Ezenkívül a hipotalamusz ACC gátlása gyengíti a leptin által közvetített gátlást az étkezés és a testtömeg-növekedés terén [33]. Később kimutatták, hogy az mTOR/S6K az AMPK leptin által közvetített gátlásával szabályozza az étkezést a hipotalamuszban [34]. Az AMPK [35] szignalizáció az adiponektin termelését is szabályozta azáltal, hogy modulálta receptorainak és önmagának expresszióját. Az Apelin [36] egy elhízás és antidiabetikus tulajdonságairól ismert adipocitokin, az Apelin elősegíti az antioxidáns enzimek expresszióját és elnyomja a prooxidáns enzim expresszióját az AMPK útvonalon keresztül.
Ezért az AMPK ígéretes új célként jelent meg az anyagcsere-rendellenességek kezelésében, beleértve az elhízást, a 2-es típusú cukorbetegséget és a szív- és érrendszeri betegségeket. Az AMPK aktiválása az AICAR segítségével növelheti az elhízott cukorbeteg rágcsálók [37, 38] és az emberek [39–43] glükózfelvételét és zsírsav oxidációját, ami igazolja az AMPK aktivátor terápiás potenciálját.
A pAMPK az AMPK aktivált állapota, amelyet az a-alegység 172-es treonin-maradékán (Thr-172) foszforileznek az upstream kinázok, például az LKB1 [44]. Az alloszterikus és a foszforilációs hatások kombinációja a kináz aktivitás több mint 1000-szeres növekedését okozza (szemben az egyedüli alloszterikus aktivációval kevesebb mint ötszörösével). Ez a válasz lehetővé teszi a sejtek energiaállapotának apró változásaira adott válaszok nagy érzékenységét [45]. Az aktivált AMPK katalizálja az ACC defoszforilezését, majd növeli a hipotalamusz-malonil-CoA szintjét, ami táplálékfelvétel elnyomását és végül az energiafelhasználás növekedését eredményezi [46].
Eredményeink azt mutatják, hogy az EA patkányoknak szignifikánsan magasabb volt az LKB1 és a pAMPKα1 fehérje szintje a DIO patkányokhoz képest. Ezért az EA elősegítheti a hipotalamusz AMPK aktivitását azáltal, hogy növeli annak foszforilációs szintjét, és ezt a hatást az upstream kináz, az LKB1 növekedése indukálhatja. Eközben az ACC fehérje szintjének csökkenése az AMPK aktivációjának eredménye lehet. A hipotalamusz LKB1-AMPK-ACC jelátviteli útjának változásai hozzájárulhatnak az EA hatásához a HF-étrendet kapó patkányok súlygyarapodásának lelassulására. Ezt a hipotézist azonban tovább kell vizsgálni, esetleg hipotalamusz LKB1 és AMPK leütési patkány modellekkel.
Ebben a vizsgálatban az ST36-ot és az ST25-öt választottuk akupontként néhány okból. Először is, egy korábbi tanulmány kimutatta, hogy ezeken az akupunktumokon végzett EA-kezelés jelentősen csökkentette a táplálékfelvételt és a testsúlyt [60, 61]. Másodszor, ezt a két akupont használják mások az elhízás kezelésére állatkísérletek vagy klinikai vizsgálatok során [62]. Harmadszor, ezeknek az akupunktumoknak a stimulálása arról számolt be, hogy egyes szövetekben fokozza az AMPK expressziót [18, 19]. Néhány jelentés azonban kimutatta, hogy az EA ST36 bizonyos mértékben fokozhatja az étvágyat [63], de több tanulmány szerint az EA ST36 jelentősen gátolta az etetést és a testtömeg-növekedést [64–69]. A lehetséges mechanizmusok a lefelé szabályozott orexigén peptidek, például az Y neuropeptid (NPY) [64], az anorexigén hormonok, köztük a proopiomelanokortin (POMC) [65], a-melanocita-stimuláló hormon (a-MSH) [66], upregulálása, és kolecisztokinin (CCK) [67–69]. Mindazonáltal vannak más akupunktumok is az elhízás kezelésére, további vizsgálatoknak meg kell vizsgálniuk, hogy más akupunktumok stimulálása hasonló mechanizmuson keresztül működik-e, mint például az ST36 és az ST25 stimulációja.
Következtetések
A hipotalamusz LKB1-AMPK-ACC jelátvitelének szabályozását detektáltuk DIO patkányokban. Az EA kezelés gátolhatja a súlygyarapodást a DF patkányokban, akiket HF diétával tápláltak. Az RT-PCR és a Western-blottolás azt mutatta, hogy az EA az energiaegyensúly szabályozása érdekében az AMPKα2 transzkripció szabályozásával, az LKB1 és az AMPKα1 fehérje expressziójának elősegítésével és az ACC fehérje expresszió gátlásával járhat. Ez a tanulmány azt sugallja, hogy a hipotalamusz LKB1-AMPK-ACC jelátvitele fontos szerepet játszik az elhízás EA kezelésében.
- Depo-medroxiprogeszteron-acetát, súlygyarapodás és amenorrhoea elhízott serdülő és felnőtt nők körében
- Az emberi zsírszövet gén expressziójának változásai az étrend okozta fogyás során - FullText -
- A táplálkozási szokások jellemzői metabolikusan elhízott, normál testsúlyú felnőtteknél (Koreai Nemzeti Bajnokság)
- Diéta, táplálkozás, valamint a túlsúly növekedés és az elhízás megelőzése - PubMed
- Az anorexiától az elhízáson át az egészségesig Hihetetlen fotók ábrázolják a nők rendkívüli súlyingadozásait