Az elhízás, a krónikus vesebetegség és a zsírmáj betegség összekapcsolásának mechanizmusai: A Fetuin-A, az Adiponectin és az AMPK szerepe
Joachim H. Ix
* Nefrológiai és magas vérnyomás osztály, Kaliforniai Egyetem Orvostudományi Tanszék - San Diego/Veterans Affairs San Diego Healthcare System;
† Preventív Orvostudományi Osztály, Kaliforniai Egyetem Család- és Preventív Orvostudományi Tanszék – San Diego; és
Kumar Sharma
* Nefrológiai és magas vérnyomás osztály, Kaliforniai Egyetem Orvostudományi Tanszék - San Diego/Veterans Affairs San Diego Healthcare System;
‡ Kaliforniai Egyetem Vese-transzlációs orvostudományi központ - San Diego/Veterans Affairs San Diego Healthcare System, San Diego, Kalifornia
Absztrakt
Az elhízás a krónikus vesebetegség (CKD) és az alkoholmentes zsírmájbetegség (NAFLD) kockázati tényezője. A legújabb tanulmányok mindkét betegségben közös mechanizmusokat azonosítanak a fetuin-A és az adiponectin által szervezett interorganikus kommunikáció révén. A májban és a vesében az energiaérzékelő 5′-AMP-aktivált protein-kináz (AMPK) kulcsfontosságú a podocyták és a hepatocyták kompenzációs és potenciálisan káros utakba történő irányításához, ami gyulladásos és profibrotikus kaszkádokhoz vezet, amelyek végszervi károsodásokhoz vezetnek. Ezeknek a korai upstream utaknak a szabályozása új terápiás célpontokat jelenthet az elhízás ezen egyre gyakoribb következményei számára.
Az elhízás gyakorisága az Egyesült Államokban drámai módon megnőtt: az 1991-es 12% -ról egy évtizeddel később 20% -ra. 1, 2 A 60 évesnél idősebb személyeknél a leggyakoribb a prevalencia növekedése 3; baljóslatú tendencia, mert ebben a korcsoportban a krónikus vesebetegség (CKD), a szív- és érrendszeri megbetegedések, valamint a rosszindulatú daganatok pusztán életkoruk alapján terhelik a legnagyobb terhet, amelyek mindegyikét súlyosbíthatja az elhízás. Az elhízást és a CKD-t összekapcsoló mechanizmusok megértése nemcsak a mindkét állapot társadalmi egészségügyi terhe miatt fontos, hanem azért is, mert az alapul szolgáló mechanizmusok új ismeretei új stratégiákhoz vezethetnek a CKD és a kapcsolódó társbetegségek kezelésére vagy megelőzésére.
Az elhízás szinte biztosan közvetett módon járul hozzá a CKD kialakulásához, mivel az elhízás számos domináns CKD kockázati tényezővel társul, mint például a cukorbetegség, a magas vérnyomás és az érelmeszesedés. Az elhízás azonban közvetlenül vezethet CKD-hez is. Kórtani vizsgálatok azt mutatják, hogy a súlyos elhízásban szenvedő alanyok proteinuria alakul ki a podocita hipertrófia, a mesangiális expanzió, a glomeruláris megnagyobbodás és a fokális szegmentális glomeruláris szklerózis patológiás megállapításával cukorbetegség és magas vérnyomás hiányában. 4, 5 Az epidemiológiai vizsgálatok szintén közvetlen hatást támasztanak alá. Hsu és munkatársai több mint 300 000 Kaiser Permanente egészségügyi tagot értékeltek, akik közül közel 1500-an alakultak ki ESRD-k körülbelül 26 év alatt. 6, 7 Az ESRD kockázata fokozatosan növekedett azoknál, akik túlsúlyosak vagy elhízottak a demográfiai adatok, a dohányzás és a szív- és érrendszeri betegségek kiigazítása ellenére. Még akkor is, ha a vérnyomást és a cukorbetegséget figyelembe vették a kiinduláskor, az összefüggés csak részben gyengült, és az elhízással küzdő egyéneknél az ESRD kockázata körülbelül háromszor nagyobb volt. A rendkívül elhízott emberek még nagyobb kockázatnak vannak kitéve. 6.
A májban gyakran elhízással kapcsolatos szövődmények is kialakulnak. A nem alkoholos zsírmájbetegség (NAFLD) a nyugati országokban a leggyakoribb májbetegség 8, és szorosan összefügg az inzulinrezisztenciával és az elhízással. 9 - 11 Mivel ezek a CKD és a NAFLD közös kockázati tényezői, nem meglepő, hogy a két feltétel összefügg egymással. 12., 13. Érdekes módon a két betegséghez vezető mechanizmusok összekapcsolódhatnak a zsír, a vese és a máj közötti áthallás révén legalább két szérumfehérjében - a fetuin-A és az adiponektin. Válaszként mindkét szövet hasonló lokális hatásokat mutat az 5'-AMP aktivált protein kináz (AMPK) energiaszenzor közvetítésével. Itt áttekintjük ezen utak jelenlegi megértését, kiemelve azokat a területeket, amelyek közösek az elhízással kapcsolatos CKD és az elhízással kapcsolatos NAFLD vonatkozásában, és amelyek potenciális célpontok lehetnek a beavatkozáshoz.
A Fetuin-A inzulinrezisztenciát vált ki és szabályozza az adiponektint
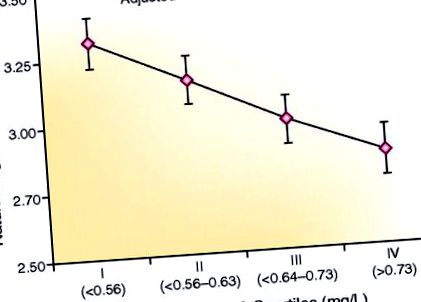
Stabil kardiovaszkuláris betegségben szenvedő betegeknél fordított összefüggés van a szérum fetuin-A szintje és az adiponektin között. Az asszociációt az életkor, a nem, a faj, a testtömeg-index és a becsült GFR alapján korrigálták 963 járóbeteg-populációban (n = 242 vagy 243/kvartilis). Átlagos becsült GFR = 71 ml/perc/1,73 m 2 (29% becsült GFR 40 adiponektinnel javítja az inzulinérzékenységet és csökkenti a vaszkuláris sejtekben a gyulladásos mediátorok káros hatásait, és a nagy molekulatömegű multimerek erősebbek lehetnek. A zsírszövetből származó forrás ellenére az elhízott egyéneknek folyamatosan alacsonyabb a szérum adiponektin szintje.35, 36, 42 Ennek a paradoxonnak a mechanizmusai bizonytalanok, de tükrözhetik a génexpresszió és a szekréció gátlását.43 Az Adiponectin null egerek fokozott érzékenységet mutatnak az inzulinrezisztenciára magas zsírtartalmú táplálás esetén 44 és az adiponektinnel történő kezelés fordítva javítja az inzulinérzékenységet.
Az adiponektin legjellemzőbb receptorai az AdipoR1 és AdipoR2 receptorok; az előbbi mindenütt kifejeződik, míg az utóbbi elsősorban a hepatocitákban található meg. 45 Mindkettő hét transzmembrán domént tartalmaz, de szerkezetileg és funkcionálisan különbözik a G-fehérjéhez kapcsolt receptoroktól. A G-fehérjéhez kapcsolt receptorokkal ellentétben mindkét receptor amino (N) -termini intracelluláris, a C-terminális vége extracelluláris és megköti az adiponektint. Bár az intracelluláris jelátviteli kaszkád nem ismert, 47 ezeknek a receptoroknak a funkcióját nemrégiben egereken végzett genetikai manipulációk segítségével tisztázták. A db/db egér mindkét májának túlzott expressziója javítja az inzulinérzékenységet. Az AdipoR1 overexpresszió csökkenti a glükoneogenezisben részt vevő májenzimeket, 46 míg az AdipoR2 overexpresszió a glükokináz és a peroxisome proliferátor által aktivált receptor-α (PPARα) stimulálásával növeli a glükózfelvételt. A PPARa mögött levő géneket, például az acil-CoA-oxidázt 1 és a szétkapcsoló fehérjét 2 szintén stimulálja az AdipoR2 túlzott expressziója. 46 AdipoR1 vagy AdipoR2 specifikus deléciók vizsgálata azt mutatja, hogy az AdipoR1 túlnyomórészt az AMPK, míg az AdipoR2 a PPARα stimulációját közvetíti.
Az adiponektin és az albuminuria közötti potenciális kapcsolatot kezdetben egy esszenciális hipertóniában szenvedő férfiak klinikai vizsgálatában vetették fel, amelyben a szérum adiponectin és az albuminuria szintje fordítottan korrelált. 48 Mivel az adiponektin szint kiválasztódik az adipocitákból, és fordítva függ össze az adipozitás mértékével, ezek az adatok az adiponektint a zsír és a vese áthallás jelölt közvetítőjeként azonosítják. Mások hasonló inverz összefüggéseket figyeltek meg a 49, 50 keresztmetszeti vizsgálatokban; az adiponektin szint és a vesebetegség közötti kapcsolat azonban összetett. Közvetlen összefüggés van az adiponektin szintje és a nyilvánvaló proteinuria között, 51–53, és a tanulmányok ellentmondó adatokat közölnek az adiponektin szintje és a mortalitás között CKD-ben vagy koszorúér-betegségben. 36, 54 - 56 Mindazonáltal az adiponectin és az alacsony fokú albuminuria közötti inverz korreláció arra késztetett bennünket, hogy vizsgáljuk meg, van-e okozó oka a relatív adiponectin-hiánynak a kóros glomeruláris működésben. 49
A NAFLD szorosan társul az inzulinrezisztenciával és az elhízással 9 - 11, és a máj patológiájának spektrumát képviseli, a máj steatosisától kezdve a gyulladásig és a nem alkoholos steatohepatitisre és a cirrhosisra jellemző fibrózisig. Bár a máj steatosis jóindulatú lehet, a fibrózist és a steatohepatitist kiváltó tényezők szintén a reaktív oxigénfajok következményei lehetnek a máj lipidjeinek peroxidációját előidézve és mitokondriális károsodásokat kiváltva. 58 - 60 A podocytákra gyakorolt hatásához hasonlóan a legújabb tanulmányok szerint az adiponektin gátolja ezt a kritikus átmenetet.
Az AMPK gátlása kiváltja az elhízással kapcsolatos végszervi betegség kialakulását
Teleológiai szempontból nem világos, hogy a zsírfelesleg miért vezet albuminuriához és a NAFLD-hez. Az AMPK-n keresztül egy magyarázat adható meg. Ez a fehérje egy szerin/treonin kináz, amely kritikus szerepet játszik az energia rendelkezésre állásának érzékelésében sejtszinten. Alacsony glükózszintnek vagy csökkent energiatárolóknak való kitettség esetén az AMPK gátolja az mRNS transzlációt és a rövid távon nem lényeges utak fehérjeszintézisét. Viszont azokban az idõszakokban, amikor a táplálék bõséges, az AMPK aktivitása gátolt, az mRNS transzlációja felfelé szabályozott, és a sejtek és az organizmus növekedhet. Mivel az állatok többségének nincs folyamatos hozzáférése a kalóriákhoz, ez a funkció kritikus lehet az evolúciós siker szempontjából. Mi lenne azonban a válasz a modern helyzetben, ahol állandó és bőséges hozzáférés van a kalóriákhoz? Ez a forgatókönyv az AMPK krónikus deaktiválását eredményezheti, és elősegítheti a sejtfehérje szintézist. Az mRNS transzlációjában és a fehérjeszintézisben a vesebetegséghez vezető utakat nemrég elegánsan áttekintették. 68, 69
Az AMPK vesefunkcióban betöltött szerepének megismerése gyerekcipőben jár. A legújabb tanulmányok szerint azonban az AMPK szuppresszió sejtek hipertrófiájához, a mátrix molekulák felhalmozódásához és mesangiális terjeszkedéshez vezet, amelyek az elhízással kapcsolatos CKD jellemzői. Vad típusú egerekben bazális körülmények között az aktivált AMPK dominál a podocytákban. Adiponektin-kimerüléssel az AMPK inaktiválódik a podocytákban, és a lábfej folyamatának kiürülésével jár. Feltételesen differenciált podociták alkalmazásával az AMPK gátlása drámai módon megváltoztatja a podocita morfológiáját. 49 Az AMPK aktiválása analóg amino-imidazol-karboxamid-ribonukleotidjával helyreállítja a podocita morfológiáját in vitro és normalizálja az albuminuria in vivo az adiponectin null egérben.
A vesebetegségben kialakuló szerepével ellentétben az AMPK szerepe a NAFLD-ben jobban tanulmányozott. Az AMPK aktivációja fontos szerepet játszik az adiponektin hatásainak közvetítésében a májzsír felhalmozódásának gátlásában. 70, 71 Magas szacharózt tartalmazó patkányok a NAFLD-t a csökkent AMPK-val társítva fejlesztik ki. Az AMPK májban történő aktiválása zsírsav oxidációhoz, a glükóztermelés gátlásához, valamint a lipogenezis és a fehérjeszintézis gátlásához vezet. A géntechnológiával módosított krónikus májbetegségben és az AMPK-aktivációban szenvedő egerek ellenállnak a súlygyarapodásnak és a májzsír felhalmozódásának, ha magas zsírtartalmú étrendet fogyasztanak. 73.
Érdekes módon az elhízásra, a vesére és a májra gyakorolt potenciális jótékony hatású terápiás manőverek összefüggenek a fetuin-A szint csökkenésével, az adiponektin növekedésével és az AMPK stimulációval. A kalória-korlátozás, a 74, 75 testmozgás, a 75 és az inzulin-szenzibilizáló gyógyszerek, például a pioglitazone 76, 77, mind a szérum fetuin-A szintjének csökkenésével, az adiponektin szint emelkedésével és az AMPK stimulációjával járnak. Az angiotenzin II infúzió csökkenti az adiponektin szintet, az angiotenzin konvertáló enzim gátlók és az angiotenzin receptor blokkolók pedig a zsigeri zsírszövet befolyásolásával emelik az adiponektin szintjét (78, 79). A szirtuin aktivátor resveratrol a magas zsírtartalmú táplálás ellenére is javítja a szív, a vese és a máj szervi működését 80-82, ami részben az AMPK stimulációjának köszönhető. A jövőbeni vizsgálatoknak ki kell értékelniük, hogy az adiponektin vagy új szerek, például a sirtuin aktivátorok közvetlen beadása terápiás potenciállal rendelkezik-e elhízott betegeknél, valamint vese- és májbetegségben.
Összegzésképpen elmondható, hogy a túlzott kalóriabevitel hozzájárul az adipozitáshoz és olyan kaszkádot indít el, amely végül végszerv-diszfunkcióhoz vezet, beleértve az elhízással kapcsolatos CKD-t és a NAFLD-t is. A legújabb tanulmányok azt mutatják, hogy a fetuin-A és az adiponektin kulcsfontosságú fehérje, amely a máj és a zsírsejtek, illetve a zsírsejtek, illetve a vese és a máj között szervi áthallást szervez. Az adiponektin befolyásolja a végszervi célok változását, legalábbis részben az AMPK révén a betegség korai szakaszában. Ezek a felfedezések azt mutatják, hogy az elhízással kapcsolatos CKD és NAFLD számos hasonló biológiai mechanizmust mutat (2. ábra); ezen átfedő utak megértése azonban jelenleg hiányos. További vizsgálatokra van szükség a fetuin-A, az adiponectin és az AMPK szabályozási mechanizmusainak tisztázására. Valószínű, hogy a leptin, 83 - 86 rezisztin, 87 szabad zsírsav, 88, 89 glükóz, 90 endotheliális diszfunkció, 91, 92 és egyéb tényezők 90 is fontos szerepet játszik mindkét betegség kialakulásában. Bár nehéz lehet ennek a komplex biológiának a megértése, a multiorganikus integratív vizsgálatok elemzései betekintést nyújtanak az elhízás egyre gyakoribb és pusztítóbb hatásainak ellensúlyozásához.
Kalóriafelesleg esetén zsírsavfelesleg és inzulinrezisztencia táplálja a máj triacil-glicerin szintézisét és steatosisát. A kalóriafelesleg és/vagy a zsírmáj magasabb szérum fetuin-A szinthez vezethet. A magasabb fetuin-A szint az adiponectin transzkripciójának elnyomásához vezet az adipocitákban közvetlen mechanizmusok révén és potenciálisan közvetett módon a zsírszövet tágulása révén. A túlzott kalóriabevitel és az alacsonyabb adiponektin csökkenti az AMPK aktiválódását, elősegítve a máj stellátsejtjeinek proliferációját és reaktív oxigénfajták képződését a májban, ami a máj steatosisából steatohepatitiszé és végső soron cirrhosussá alakul. Hasonló utak révén az alacsonyabb adiponektinszint csökkenti az AMPK-t a podocytákban, hogy elősegítse a podocyta lábfejének kiürülését és albuminuria-t.
Közzétételek
A szerzők köszönetet mondanak Dr. Mary Whooley-nak, valamint a Heart and Soul Study-nak azért, hogy a kézirat klinikai adiponektin-adatait megadták. Ezeket a vizsgálatokat az American Diabetes Association (1-08-IG-01), az American Heart Association (0575021N) és a National Institute of Health (R01 HL096851) Dr. Ix támogatásával, valamint a National Health Institute of Health támogatásával végezték. (R01 DK 053867 és U01 DK 060995) Dr. Sharmának.
- Máj részvétel az autoszomális-domináns policisztás vesebetegségben Amerikai Nefrológiai Társaság
- Élet krónikus májbetegségben Cirrhosis okai és kezelési lehetőségei Insight Medical Campus
- A zöld tea kivonat és a testmozgás mérsékelheti az elhízással kapcsolatos zsírmáj betegségeket, tanulmányi műsorok
- A kefir segít az alkoholmentes zsírmájbetegségekben
- A karbamid transzporter gátlása javítja az urémiás kardiomiopátiát krónikus vesebetegségben - Kuma