Az elhízás és a hasnyálmirigyrák összekapcsolása
Kelly McCall, Anthony L Schwartz és Frank L Schwartz
Beküldve: 2013. szeptember 19. Felülvizsgálat: 2014. március 28. Megjelenés: 2014. május 14
fejezet és a szerző információi
Szerzői
Kelly McCall
- Ohio University Heritage College of Osteopathic Medicine, Ohio, USA
Anthony L Schwartz
- Ohio University Heritage College of Osteopathic Medicine, Ohio, USA
Frank L Schwartz *
- Ohio University Heritage College of Osteopathic Medicine, Ohio, USA
* Az összes levelezést címezze: [email protected]
A szerkesztett kötetből
Szerkesztette: Kelly McCall
1. Bemutatkozás
2. Genetikai kapcsolat a hasnyálmirigyrákkal
A hasnyálmirigyrákok családi aggregációja genetikai kapcsolatra utal, és számos fontos hasnyálmirigyrák-fogékonysággént azonosítottak, köztük nagy penetrációjú géneket: BRCA2, PALB2, PRSS1, SPINK1, STK11 a közelmúltban felülvizsgálták [5], és a DNS hibásan javító géneket tartalmaz. A genom egészére kiterjedő társulási vizsgálatok (GWAS) egygénes polimorfizmusokat (snps) is találnak, amelyek a hasnyálmirigyrák megnövekedett kockázatával is társulnak, beleértve: ABO, 1q32.1, 13q22.1, CLPTM1/TERT, CFTR [18, 19].
3. A krónikus hasnyálmirigy-gyulladás környezeti okai
4. Az elhízás, a T2DM és a hasnyálmirigyrák epidemiológiája
Ezzel szemben kölcsönös összefüggés van a testmozgás mennyisége és az elhízás, a T2DM és a hasnyálmirigyrák kockázata között. A testmozgás önmagában kalóriát éget és csökkenti az elhízás kockázatát és/vagy súlyosságát, csökkenti az inzulinrezisztenciát és elősegíti a gyulladáscsökkentő citokinek termelését, amelyek ellensúlyozzák az alábbiakban tárgyalt összes gyulladásos és onkogén folyamatot [10].
5. Az elhízást, a gyulladást, a cukorbetegséget és a hasnyálmirigyrákot összekötő molekuláris utak
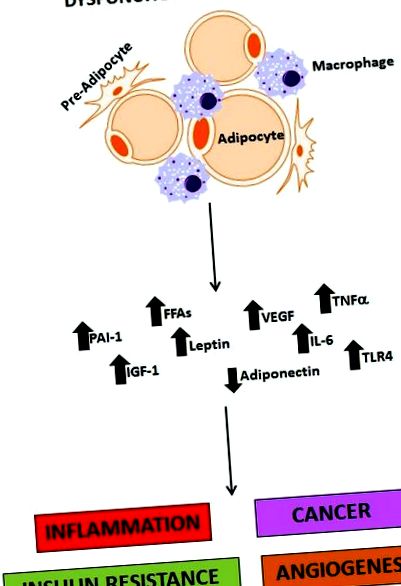
Ha a kalóriabevitel meghaladja a normális metabolikus igényt, szükség van a felesleges energia tárolására, és ez az adipocita alapvető funkciója. A zsírszövet azonban nem csak raktárhelyiség. Zsírszövet (különösen zsigeri zsír) több sejttípusból áll (adipociták, pre-adipociták, makrofágok, fibroblasztok és erek), és ma már jelentős endokrin szervként ismerik fel, amely több hormont (leptin, adiponektin, rezisztin), gyulladásos citokinek (TNF) expresszál és szekretál -α, IL-6 és IFN-β), a komplement, a plazminogén aktivátor inhibitor-1 (PAI-1), a vaszkuláris endoteliális növekedési faktor (VEGF) és más fehérjék, például a monocita kemoattraktáns fehérje (MCP-1) komponensei. Ezekről a zsírszövetből származó tényezőkről (1. ábra) most úgy gondolják, hogy drámai módon hozzájárulnak a krónikus gyulladás kiváltásához, amelyet inzulinrezisztencia [29], hiperinsulinémia, T2DM, hiperlipidémia, magas vérnyomás és ateroszklerózis [30] fejeznek ki, és hozzájárulnak a számos szilárd daganat onkogenezise [11, 16]. A zsigeri elhízás a zsírraktár, amely a legszorosabban kapcsolódik ezen anyagok termeléséhez, valamint az ezt követő inzulinrezisztencia, a T2DM és a hasnyálmirigyrák onkogenezisének kialakulásához.
5.1. Étrendi hozzájárulások
Magas zsírtartalmú étrend (HFD) és a felesleges szabad zsírsavak (FFA):
Magukban a zsigeri zsírsejtekben az FFA-k (palmitát stb.) Közvetlenül indukálják a gyulladásos citokinek felszabadulását [16], és kiválthatják az autópálya-szerű receptorok (TLR) kóros jelzését is; A TLR4 aktiválása különösen növeli a további gyulladásos citokintermelést, hozzájárulva az inzulinrezisztencia [34] és az adipogenezis elindulásához, tovább növelve az adipocita tömegét, valamint az elhízással, a T2DM-mel és az onkogenezissel társuló krónikus gyulladásos állapotot.
Magas fruktóztartalmú kukoricaszirup (HFCS):
1.ábra.
A diszfunkcionális zsírszövet szerepe az elhízásban. A diszfunkcionális zsírszövet a gyulladást, rákot, inzulinrezisztenciát és angiogenezist közvetítő molekulák kritikus forrása. PAI-1 (plazminogén aktivátor inhibitor-1); FFA-k (szabad zsírsavak); IGF-1 (inzulinszerű növekedési faktor 1); VEGF (vaszkuláris endoteliális növekedési faktor); IL-6 (interleukin 6); TNF-a (tumor nekrózis faktor alfa); TLR4 (autópálya-szerű receptor 4).
A hasnyálmirigyrák tekintetében egyre több bizonyíték van a HFCS bevitel és annak előfordulása közötti specifikus dózisfüggő kapcsolatra, és ez a kockázat független az elhízástól vagy a BMI-től [15]. Ezenkívül a fruktóz közvetlenül stimulálja a fokozott nukleinsavszintézist a transzplantoláz által katalizált pentóz-foszfát útvonalon keresztül, amely a rosszindulatú sejtek szaporodásához szükséges, és a HFCS fogyasztása ma már mind az onkogenezishez, mind a tumor terjedéséhez és metasztázisához kapcsolódik [15].
Karcinogének az élelmiszerekben:
A heterociklusos aminokat és benzo (a) pirint tartalmazó, vagy magas hőmérsékleten készített (sült vagy grillezett) feldolgozott húsok magas bevitele hasnyálmirigyrákhoz [42], valamint más aflatoxinokat [43] és más mutagéneket tartalmazó ételekhez kapcsolódik, azonban ezek a hasnyálmirigyrákhoz való kapcsolat jelenleg meglehetősen gyenge.
5.2. Az étrendi alkotóelemek által kiváltott molekuláris utak
Adipocita eredetű gyulladásos fehérjék:
Gyulladásos citokinek (adipokinek), mint pl TNF-a, IL-6, IL8, VEGF és IFN-p kimutatták, hogy a zsigeri elhízás [16], valamint az akut és krónikus hasnyálmirigy-gyulladás és a hasnyálmirigy-rák [11] állapotában magasak. A zsigeri adipociták/makrofágok az elhízással összefüggő citokinek fő forrásai, amelyekről úgy gondolják, hogy elősegítik az inzulinrezisztenciát [29] (lásd alább), valamint közvetlenül hozzájárulnak az onkogenezishez számos útvonalon keresztül [16], beleértve más növekedési faktor receptorokat, citokin receptorokat vagy nem receptor tirozin kinázok. Ezen utak mindegyike növelheti a Janus kináz (JAK)/szignál transzdukciót és a transzkripció aktivátorát Szignál átalakító és a transzkripció aktivátora (STAT) STAT3 [44, 45] közvetlenül kapcsolódik a hasnyálmirigy rákjához. Mindkét út stimulálhatja a sejtproliferációt - transzformációt (1) a sejtciklus-szabályozókat kódoló gének (D1/D2, c-Myc ciklinok) felfelé történő szabályozásával, (2) növelve a mutáció valószínűségét (pl. Celluláris proto-onkogének), DNS és sejtjavító mechanizmusok), (3) az apoptózis gátlása (Bcl-xL, Mcl-1), (4) csökkent sejttapadás és/vagy (5) az angiogenezis stimulálása (VEGF) [46].
Leptin adipociták is kiválasztják, és kulcsszerepet játszik az anyagcsere és az étvágy szabályozásában. A leptin jóllakottsági hormonként ismert, azonban a szérum leptin szintje elhízásban megemelkedik a központi leptin receptor rezisztencia miatt (az alábbiakban tárgyalt inzulinhoz hasonló mechanizmusokkal). A leptinnek számos rákos sejtvonalban van mitogén hatása, amelyek a mitogén által aktivált fehérje-kináz (TÉRKÉP) közvetített utak; bizonyos hasnyálmirigyrákos sejtvonalakban azonban gátolja a növekedést [47], ezért szerepe ebben a rákban jelenleg nem világos [48, 49].
Adiponektin kizárólag adipociták választják ki, és gyulladáscsökkentő és inzulinérzékenyítő hatású is. A „jó adipokin” néven ismert leptin szérumszint fordított összefüggésben van a BMI-vel, és az elhízott betegek szintje csökkent és sok rákos megbetegedésben. Az adiponektin magas szintje fordítottan összefügg a hasnyálmirigyrák előfordulásával [49].
PAI-1 szerin proteáz inhibitor, amelyet adipociták és sztrómasejtek termelnek a zsigeri zsírban, a tumorsejtek inváziójához, metasztázisához és számos rosszindulatú daganat angiogeneziséhez kapcsolódik, és a PAI-1 túlzott expresszióját számos elhízással összefüggő daganatban kimutatták, ami arra utal, hogy ez hozzájárul a rosszindulatú daganatok terjedésére [50]. Érdekes módon a plazminogén aktivátor inhibitor-2 (PAI-2) magas expressziója jósolta a túlélést a hasnyálmirigy-adenokarcinómában szenvedő betegeknél [51].
VEGF egy másik adipocita eredetű polipeptid, amely szerepet játszik a rák növekedésében, és kimutatták, hogy sok hasnyálmirigyrákban túlzottan expresszálódik, és ezekben a tumorokban való expressziója a gyengébb túléléshez kapcsolódik [52, 53].
Inzulinrezisztencia, hiperinsulinémia és megnövekedett inzulin/IGF-1 receptor jelátviteli utak
A hiperglikémia hasnyálmirigyrák epidermális növekedési faktor expressziót vált ki
Amint ebben a fejezetben korábban tárgyaltuk, a cukorbetegség a hasnyálmirigyrák megnövekedett kockázatával jár együtt a különféle citokin- és hormonreceptor-jelátviteli utak révén, és hogy a hasnyálmirigyrákban szenvedő betegek nagy számában alakul ki cukorbetegség és emelkedett glükóz. Érdekes a hiperglikémia közvetlen hatása az onkogenezisre, a hasnyálmirigyrák növekedésére és terjedésére is. Epidemiológiai vizsgálatok kimutatták, hogy a hasnyálmirigyrákos betegek glükózkontrollja javítja a túlélést, ami arra utal, hogy a magas glükózszint közvetlenül elősegítheti a tumor növekedését és progresszióját [59]. A legújabb in vitro sejttenyésztési vizsgálatok kimutatták, hogy a glükóz dózisfüggő módon elősegíti a hasnyálmirigy-rák különböző sejtvonalainak növekedését és perineurális invázióját a gliasejtből származó neurotrop faktor (GDNF) és az epidermális növekedési faktor (EGF) expressziójának szabályozásán keresztül. fokozott epidermális növekedési faktor receptor (EGFR) transzaktiváció [60]. Ezek a megfigyelések támogatják az intenzív glükózkontrollt, mint potenciális célpontot a betegek túlélésének javítására hasnyálmirigyrákban.
6. Elhízás, fizetésszerű receptorok és hasnyálmirigy-onkogenezis
Kimutatták, hogy a krónikus gyulladás fontos rizikófaktor a többszörös daganatok, köztük a hasnyálmirigyrák kialakulásában és előrehaladásában [67-72] [72-75]. Úgy gondolják, hogy a krónikus gyulladás rosszindulatú transzformációt indukál az onkogének aktiválása, az immunszuppresszió kiváltása, valamint a tumor szuppresszor gének és limfociták gátlása révén. A TLR-k patológiás aktiválása kritikus szerepet játszik a magas zsírtartalmú étrend és a HFCS által kiváltott gyulladásos válaszban, többszörös gyulladáscsökkentő citokinek termelésének indukálásával, és bebizonyosodott, hogy ezek fontosak az indukció, a proliferáció, a túlélés, az áttétek és az ebből való menekülés szempontjából. ezen rákok közül sok immunellenőrzése is [70, 76]. A rákban szerepet játszó legfontosabb TLR-indukált citokinek egy része a TNF-a, IL-1, IL-6, IL-8, IL-10 és IL-23. A gyulladásos citokintermelés számos tumor elősegítő transzkripciós faktor és anti-apoptotikus gén aktiválásához vezet. Nukleáris faktor kappa béta (NF-κB) és jel transzkripció átalakítója és aktivátora (STAT3) a két legjobban tanulmányozott onkogén transzkripciós faktor.
7. Kóros fizetésszerű receptor jelátvitel, hasnyálmirigyrák növekedése és a terápiával szembeni rezisztencia
8. A TLR mint potenciális terápiás célpont
Ezzel szemben azt is kimutatták, hogy a TLR agonisták elősegíthetik a rákos sejtek túlélését és migrációját, valamint a tumor progresszióját. Például a TLR agonistákról kimutatták, hogy növelik a tumor életképességét és az emberi tüdőrák metasztázisát (TLR7/8) [103]; a humán mielóma (TLR3) proliferációja [104]; az emberi kolorektális rák (TLR4) adhéziója és áttétjei [105]; és a humán glioblastoma (TLR4) vagy az emberi emlőrák (TLR2) vándorlása [106]. A hasnyálmirigyrák tekintetében a közelmúltban beszámoltak arról, hogy a TLR7 nemcsak magasan expresszálódik egér és humán hasnyálmirigyrákban, hanem a TLR7 ligálása gyorsított tumor előrehaladáshoz vezetett a korábban tárgyalt STAT3 növekedési utakon keresztül. Tehát úgy tűnik, hogy kétélű kard van a tumor növekedésének csökkentése vagy elősegítése között agonistákon alapuló terápiákkal különböző TLR-ekhez.
Másrészt a TLR antagonisták alkalmazása előnyösnek bizonyult a tumor növekedésének gátlásában olyan állatmodellekben, amelyekben a tumor mikrokörnyezet a TLR szignálozással elősegíti a túlélést és az áttéteket. A TLR-antagonisták csökkenthetik a sztrómasejtek, például a tumorral társult makrofágok aktivációjának szintjét is. A makrofágok TLR-tömböt fejeznek ki, és több növekedési tényezőt képesek előállítani a TLR-jelzéssel [107]. Sőt, a TLR-4 jelátvitel törlése tumorral társult makrofágokban csökkenti a tumor növekedését in vivo [108].
9. Az elhízással járó hasnyálmirigyrák megelőzése
Most meggyőző bizonyíték van arra, hogy az elhízás, a krónikus gyulladás, valamint az itt leírt számos gyulladásos citokin, hormon és növekedési faktor kapcsolódó szekréciója közvetlenül és közvetve hozzájárul a hasnyálmirigyrák megnövekedett kockázatához, az agresszívebb daganatnövekedéshez, valamint a terápiás beavatkozás. Így a dohányzás abbahagyása és az alkoholfogyasztás mérséklése mellett az életmód módosítása testmozgással, a normál BMI fenntartása, nagyobb mennyiségű friss gyümölcs és zöldség, kevesebb állati zsír és feldolgozott ételek fogyasztása; különösen a HFCS-szel dúsítottak nyilvánvaló ajánlások. Ezenkívül egyre több bizonyíték áll rendelkezésre arról, hogy más gyulladáscsökkentők, mint például a nem szteroid gyulladáscsökkentők (NSAIDS) [110], a Statin lipidcsökkentő gyógyszerek és a T2DM gyógyszerek, például a tiazolidinedionok (TZD) [111]. és a metforminnak [112, 113] specifikus védőhatása van az onkogenezissel, valamint a tumor növekedésével és a kezelésre adott válaszsal szemben.
10. Következtetés
Az elhízás hozzájárul a többszörös szilárd daganatok, köztük a hasnyálmirigyrák megnövekedett kockázatához. Különösen a hasnyálmirigyrák esetében az elhízás elősegíti a gyulladáscsökkentő környezetet, amely elősegíti az onkogenezist, a tumor növekedését, az áttétes terjedést, valamint a terápiával szembeni ellenállást számos molekuláris útvonalon keresztül. Az elhízáshoz kapcsolt fő útvonalak magukban foglalják a TNF-α, IL-1, IL-6, IL-8, IL-10 és IL-23 növekedését, valamint az NF-κB és STAT3 aktiválódását. Az iparosodott nemzetek jelenlegi étrendjei, amelyek túl sok alacsony glikémiás indexű szénhidrátot, telített zsírokat és HFCS-t tartalmaznak, a patológiás TLR3 és TLR4 jelátviteli utak fő környezeti tényezői az adipocitákban, amelyek ezután hozzájárulnak az inzulinrezisztencia kialakulásához, a méhen kívüli zsírlerakódáshoz több szövetben beleértve a hasnyálmirigyet, amelyek viszont felerősítik az itt leírt növekedési és jelátviteli utakat, amelyek onkogenezishez és tumor terjedéshez vezetnek.
- A gyermekkori elhízás kapcsolódik a hasnyálmirigyrák Columbia Egyetem Sebészeti Tanszékéhez
- Hogyan befolyásolja az elhízás a hasnyálmirigyrák kialakulását és kezelését Onkológiai nővér tanácsadó
- Ebédreceptek hasnyálmirigyrákos betegeknél - Hasnyálmirigyrák-akcióhálózat
- Hosszú távú túlélő IV. Stádiumú hasnyálmirigyrák - Kezelésem - Let; s Nyerj
- Alultápláltság, gyengeség és szarkopénia hasnyálmirigyrákos betegek értékelésében és beavatkozásaiban