Az elhízott vagy cukorbeteg anyáktól a mikrobák átadása csecsemőkig: innovatív lehetőség az ördögi kör megszakítására
Absztrakt
Bevezetés: a terhességi cukorbetegség és az elhízás egyaránt befolyásolja az anya és a csecsemő egészségét
Az egészség és a betegség (DoHAD) hipotézisének fejlődési eredete, amelyet most állatok és emberek átfogó kutatásai támasztanak alá, azt sugallja, hogy mind az anyai tápanyaghiány, mind a méhen belüli tápanyagfelesleg, valamint a korai csecsemőkori programokban hajlamosak a metabolikus betegségekre az élet későbbi szakaszaiban [1–3 ]. Az anya elhízásával és/vagy cukorbetegségével kapcsolatos kockázatok minimalizálásának fontossága már nem korlátozódik az anya és a csecsemő azonnali terhességi eredményeinek javítására, de ami még nagyobb kihívást jelent, magában foglalja az érintett utódok hosszú távú anyagcsere-egészségének javítását [4].
| Szójegyzék |
| Keresztnevelés Az állatkísérletek technikája, amelynek során az utódokat a születéskor eltávolítják a biológiai anyától és helyettesítő anya szoptatja |
| Diszbiózis A mikrobák normális összetételének egyensúlyhiánya vagy egészségtelen változása egy adott mikrobiomban |
| Endotoxin A gram-negatív baktériumok külső membránjának összetevője, amelyről ismert, hogy erős immunválaszt vált ki szisztémás keringésben (endotoxaemia), más néven lipopoliszacharid |
| Enterohepatikus keringés Olyan anyagok keringése, mint az epesavak, a májból az epébe, szekréció a vékonybélbe, az enterociták által történő felszívódás és a májba történő visszaszállítás |
| Epigenome A DNS (genom) kémiai módosítása (például egy metilcsoport kötődése) a génexpresszió megváltoztatása érdekében |
| Glikánok Azok a vegyületek, amelyek nagyszámú, glikozidszerűen összekapcsolt monoszacharidból állnak, más néven poliszacharid-glikánok, utalhatnak a glikokonjugátum (más néven glikoprotein-glikolipid, proteoglikán vagy oligoszacharid) szénhidráttartalmára. |
| Gnotobiotikus egerek Egerek ismert bélbaktériumok által telepített vagy bélbaktériumok nélkül (csíramentes) aszeptikus környezetben nevelkedve |
| Lángoló Multiprotein komplex, amely aktiválja a kaszpázokat, és proinflammatorikus citokinek képződéséhez és szekréciójához vezet, mint a veleszületett immunrendszer alkotóeleme. |
| Lamina propria A bél kötőszöveti rétege, amely a hámmal együtt képezi a bél nyálkahártyáját |
| Lipopoliszacharid Lát Endotoxin |
| Mikrobiom Egy adott környezetben, például a test egy részén található mikroorganizmusok közössége |
| Oligoszacharid Kis számú monoszacharidot tartalmazó szacharidpolimer |
| Prebiotikumok A mikroorganizmusok szaporodásának elősegítésére használt anyagok gyakran emészthetetlen szénhidrátok, amelyeket a bélmikrobák energiaszubsztrátjaként használnak |
| Probiotikumok Élő baktériumok és élesztők, amelyek hasznosak a gazdaszervezet számára |
| Rövid láncú zsírsav Telített alifás szerves savak, egy-hat szénatomos anaerob mikrobiotával történő étrendi fermentáció végterméke |
| Díj-szerű receptor A veleszületett immunrendszer olyan összetevője, amely felismeri a strukturálisan konzervált motívumokat, amelyek kizárólag mikrobiális kórokozókon expresszálódnak a gyulladásos válasz kiváltására |
A csecsemő mikrobiomjának kialakulása és a gyermekkori elhízás kockázata
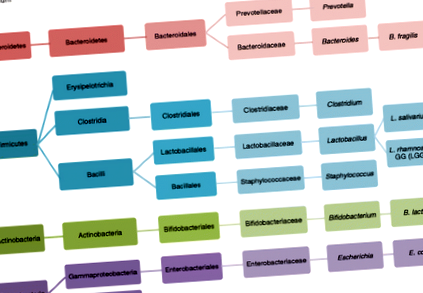
A jelen cikkben említett mikroorganizmusok taxonómiája
Terhesség és az anyai mikrobiom
Minden egyén bélmikrobiomja a mikrobák egyedi mintázatából áll, amelyet mind a sokféleség (különböző baktériumtörzsek), mind a bőség (az egyes törzsek mennyisége) határoz meg. Az anyák megosztják mikrobáikat és mikrobiom-metabolitjaikat a magzattal a méhben, a szülés alatt és a szoptatás alatt; a mikrobiom összetételét a környezet alakítja, beleértve az étrendet, az anyák egészségi állapotát és anyagcseréjét, a szülés módját, a terhességi súlygyarapodást (GWG), a genetikát és az antibiotikumok használatát.
A szülés módja befolyásolja a csecsemő mikrobiomját és az elhízás kockázatát
Bár a csecsemőknél az alapító mikrobiota-összetétel nagymértékben tükrözi az anya transzferjét a születés során, a szülés módja befolyásolja a mikrobiota posztnatális összeszerelését, és ezáltal megváltoztatja a kórokozók inváziójával, az immunstimulációval és más fontos fejlődési jelekkel szembeni ellenállást az élet elején. [26] A hüvelyi úton született csecsemőket a születési csatornában és az anya gyomor-bél traktusában élő mikrobák gyarmatosítják, míg a császármetszéssel született csecsemőket a bőrflóra kezdetben gyarmatosítja [26, 27]. A szoptatott csecsemőknél, akik teljes időtartamban születtek orvosi beavatkozások nélkül, a bél mikrobiotáját 4 napon belül a Gammaproteobacteriumok és néhány Staphylococcus faj, majd ezt követi Bifidobacterium gyarmatosítás [18]. A császármetszéssel született csecsemőknél a csecsemők székletében a Bacteroidetes törzs csökkenése mutatkozott, Bifidobacterium és Lactobacillus fajok és az Clostridium fajok, valamint a mikrobiom sokféleség általános csökkenése; ezek a különbségek fennmaradtak, bizonyos esetekben még 2 éves korban is [26, 28].
A korai mikrobiómában mutatkozó különbségeknek metabolikus következményei lehetnek, mivel a császármetszés az elhízás kockázatának 46% -os növekedésével jár 7 éves korban [29], és az 1-es típusú cukorbetegség kialakulásának 20% -kal nagyobb kockázatával jár, mint a hüvelyi úton született gyermekeknél [30]. ]. Egy tanulmány kimutatta, hogy míg a legtöbb csecsemő a nemzetség magas szintjét szerezte meg Bifidobacterium 6 hónapos koráig ez a megszerzés késleltetett a császármetszéssel született csecsemőknél [27]. Ezen túlmenően ezen mikrobák bősége fordítottan korrelált a csecsemő adipozitásával 18 hónapos korban, bizonyítva, hogy a bejuttatási mód és a csecsemő adipozitásának összefüggését a mikrobiom összetétele vezérelheti [27]. A császármetszés kockázatával összefüggő egyéb zavaró változók, például a peripartum antibiotikumok, az anyai elhízás, a glükóz intolerancia és az inzulinrezisztencia függetlenül befolyásolhatják a csecsemő mikrobiomját és az elhízás kockázatát. A császármetszés utáni megnövekedett gyermekkori BMI kifejezettebb az elhízott anyák utódainál [29], ami arra utal, hogy a terhességi kockázati tényezők, a szülés módja és a posztnatális környezet hozzájárulhatnak a jövőbeli elhízás kockázatának kialakulásához ebben a rendkívül fogékony életszakaszban.
Míg az anyai hüvelyi és bélmikrobák fontosak, mivel a hüvelyi szülés során az újszülöttnél a mikrobák vertikális továbbterjedésének helyei, a közelmúltbeli paradigmaváltás azt sugallja, hogy az anyaméh nem steril, és a mikrobiális expozíció megkezdődhet a méhben. Beszámoltak arról, hogy a placenta és a magzatvíz az intrauterin mikrobiális transzmisszió lehetséges forrása lehet az anyától a fejlődő magzatig [31, 32]. Azonban a szennyeződés lehetősége és a mikrobák alacsony biomassza ezekben a forrásokban azt sugallják, hogy további kutatásokra van szükség annak megértéséhez, hogy ezek hogyan befolyásolják a csecsemők immunitását és a bélfejlődést.
Az anyai étrend és a csecsemő szoptatása alakítja a mikrobiális közösséget: hatással van az immunitásra és az anyagcserére
Emberben az anyatej összetétele befolyásolja a bélpermeabilitás, az energia-visszatartó képesség és az autoimmunitás kialakulását, és az anyák elhízási állapota és az anyai étrend szerint változhat. A felhalmozódó bizonyítékok arra utalnak, hogy a kizárólagos szoptatás a gyermekkori elhízás kockázatának alacsonyabb mértékével jár [34, 35], és hogy ez a védelem még nagyobb lehet az elhízásban szenvedő nőknél, akik csecsemőjüket legalább 6 hónapig szoptatják [36]. A szoptatás által kiváltott elhízás elleni védelem az utódokban azonban nem univerzális az összes szoptató anyánál, és továbbra is gyengén jellemezhető [36].
Embereknél az anyatej a kezdeti mikrobiális kolonizációhoz szükséges fontos immun- és növekedési faktorok fő forrása. Az emberi tejglikánok a poliszacharidok nagy és változatos csoportja, amely szabad emberi tej oligoszacharidokat (HMO), glikoproteineket, glikopeptideket és glikolipideket tartalmaz, amelyek képesek gazdagítani a Bifidobaktériumok [39]. A HMO-k olyan komplex cukrok, amelyek ellenállnak a csecsemő gyomor általi emésztésnek, és szelektív bélmikrobiotában metabolizálódnak. A HMO-k metabolizmusa rövid szénláncú zsírsavak (SCFA) termeléséhez vezethet, amelyek metabolikus hatással lehetnek (az alábbiakban tárgyaljuk). Általánosan elfogadott, hogy a HMO-k jelentős prebiotikus hatással bírnak, energia- és tápanyagforrásként szolgálnak, amelyek lehetővé teszik a kívánt baktériumok számára a csecsemő bélrendszerének megtelepedését [40]. Az oligoszacharidok típusa, amelyet a csecsemők édesanyjuktól kapnak, az anya genotípusától és fenotípusától függ [33, 41], de a mennyiség változó lehet, különös tekintettel arra, hogy az elhízásban és cukorbetegségben szenvedő anyáknak nehézségei vannak a szoptatással. A tejglikánok és a csecsemőbél mikrobiomjának mélyebb lefedése meghaladja a felülvizsgálat kereteit, de ezt a témát Bode alaposan lefedi [40].
Az emberi anyatejben található, de viszonylag alacsony bőségű mikrobák a nemzetségekből származnak Bifidobacterium és Lactobacillus [42], hasonlóan a csecsemő bélében található mikrobákhoz. Ez arra utal, hogy az anyatej mikrobiota, bár nagyon alacsony koncentrációban, átkerülhet a csecsemő béljébe, bár ez a megállapítás nem univerzális [43]. A bélmikrobiómához hasonlóan az elhízott vagy túlzott GWG-s anyák anyatej mikrobiális közösségei kevésbé változatosak voltak, és nagyobb volt a csoportok relatív bősége Lactobacillus és Staphylococcus és csökkentik Bifidobacterium a szállítás után 6 hónappal [44]. Sőt, az elhízott nők anyateje magas metabolikus és gyulladásos markert tartalmaz, például leptint, inzulint, glükózt, IL-6 és TNFα-t, összehasonlítva a normál testsúlyú nők tejével [45]. Ezek a változások az antioxidáns és mikrobiális állapot változásain túl fontos tényezők lehetnek a korai csecsemő bél mikrobiomjának kialakításában [46].
A korai antibiotikum-expozíció növeli az elhízás kockázatát
A mikrobiom és a GDM
A mikrobiómák által kiváltott anyagcserezavarok mechanizmusai
SCFA-k
Epigenetika
A legújabb tanulmányok kimutatták, hogy a mikrobák az epigenetikus faktorok sokféleségét befolyásolják, ideértve a DNS-metilációt, a hiszton-módosítást, a kromatinnal társított komplexeket és a nem kódoló RNS-eket, hogy megváltoztassák a kromatin szerkezetét és a génexpressziót [76]. Beszámoltak arról, hogy az SCFA-k befolyásolják az epigenomot; a butirátot erős hiszton-deacetiláz inhibitorként ismerik el [66, 77]. A butirát gyulladáscsökkentő hatást fejt ki az egerekben azáltal, hogy elősegíti a Treg sejtek differenciálódását a hiszton H3 acetiláció növekedésével, ami megfelel a megnövekedett Foxp3 mRNS expresszió [78, 79]. Az egerek mikrobiotájára szintén szükség van, hogy epigenetikus mechanizmusok révén modulálják a vastagbélben a Toll-szerű 2 és 4 receptorok expresszióját [80]. Érdekes módon egy nemrégiben végzett kísérleti vizsgálat összefüggésbe hozta a terhes nőket Firmicutes vagy Bacteroidetes mint domináns csoportokkal a lipid anyagcserében, elhízásban és teljes vér gyulladásában szerepet játszó gének promotereinek differenciális DNS-metilációs profiljaival, amelyek ugyanazon nőktől gyűltek össze a szülés után 6 hónappal kapcsolatra utal a mikrobák vagy termékeik és a gazda epigenetikus szabályozása között.
Epesavak
Anyák és csecsemők pre- és probiotikumok megelőzése és beavatkozása
Egy újabb RCT-ben 175 olyan terhes nőt jelöltek ki, akiknél a korai terhességi BMI 30,0–39,9 kg/m 2 volt, vagy napi Lactobacillus salivarius probiotikum vagy placebo kapszula a terhesség 24. és 28. hete között, a rutinellenes terhesgondozás mellett [95]. A beavatkozást megelőzőtől a poszt-intervencióig a csoportok összehasonlításában nem voltak változások az éhomi glükózban, a GDM előfordulási gyakoriságában vagy az újszülött antropometriai mérésében [95]. Lehetséges azonban, hogy a vizsgálatok közötti különbségek oka lehet a probiotikus kiegészítés időzítésének, időtartamának és típusának különbsége, valamint a probiotikus hatásokra gyakorolt lehetséges étrendi hatás elemzésének hiánya, nem pedig a probiotikus kapacitás hiánya. az anya elhízása és a GDM.
Perspektívák
Az elhízás transzgenerációs ciklusának javasolt útjai. A GWG, a terhesség előtti BMI, a GDM és/vagy HFD/WSD kialakulása az anya bél dysbiosisát eredményezheti. Ez a diszbiózis közvetlenül átterjedhet a csecsemőre, és diszbiózist okozhat a csecsemő bélében azáltal, hogy megváltoztatja az SCFA metabolit termelését, az előgyulladásos állapotot, az epigenetikai változásokat és fokozza az elfogyasztott tápanyagok energiatermelését. Az olyan külső hatások, mint a korai életkori táplálkozás (szoptatás vs tápszeres táplálás), a szülés módja és az antibiotikum-kezelés emellett befolyásolhatják a csecsemő bél mikrobiomjának összetételét. A bél mikrobioma funkciójának ezen változásai olyan terhességi korhoz képest nagy csecsemőket eredményezhetnek, akiknél túlzott zsírosság van, és mindkettő fokozottan veszélyezteti a gyermeket az elhízással, az immunrendszer diszfunkciójával és a NAFLD későbbi életében. A szülési évek alatt a felnőttkori elhízás folytatja az elhízás körforgását. DM, 1. vagy 2. típusú cukorbetegség
- Minimálisan invazív, innovatív terápia a 2-es típusú cukorbetegség és az elhízás kezelésére
- A szív védelme az elhízásban Az ACE2 és partnerei cukorbetegségének szerepe
- A tanulmány szerint a shisha dohányzása cukorbetegséghez és elhízáshoz kapcsolódik
- Mitokondriumok az elhízásban és a 2. típusú cukorbetegségben ScienceDirect
- Nátrium-glükóz társtranszporter 2 Inhibitor The Magic Bullet for Obesity in Diabetes