Az emberi vastagbélrák fluoreszcenciával vezérelt műtéte növeli a teljes reszekciót, ami gyógyulást eredményez egy ortotóp meztelen egérmodellben
Cristina A. Metildi
1 Kaliforniai Egyetem, San Diego, San Diego, Kalifornia
Sharmeela Kaushal
1 Kaliforniai Egyetem, San Diego, San Diego, Kalifornia
Cynthia S. Snyder
1 Kaliforniai Egyetem, San Diego, San Diego, Kalifornia
Robert M. Hoffman
1 University of California San Diego, San Diego, Kalifornia
2 AntiCancer, Inc., San Diego, Kalifornia
Michael Bouvet
1 Kaliforniai Egyetem, San Diego, San Diego, Kalifornia
Absztrakt
Háttér
Megkérdeztük, hogy a fluoreszcenciával vezérelt műtét (FGS) javíthatja-e a műtéti eredményeket az emberi vastagbélrák fluoreszcens ortotópos meztelen egérmodelljeiben.
Mód
Megállapítottuk fluoreszcens fehérjét expresszáló humán vastagbélrák fluoreszcens ortotópos egérmodelljeit. A daganatokat erős fényű műtéten (BLS) vagy FGS-en reszekálták. Az operáció előtti és utáni képeket az OV-100 kisállat-képalkotó rendszerrel készítettük a műtéti reszekció mértékének felmérésére.
Eredmények
Az összes primer daganattal rendelkező, FGS-en átesett egér teljes reszekcióval rendelkezett, összehasonlítva a BLS csoportba tartozó egerek 58% -ával (p = 0,001). Az FGS csökkent recidívát eredményezett a BLS-hez képest (33% vs 62%, p = 0,049), és a betegségtől mentes medián túlélést 9 héttől> 36 hétig hosszabbította meg. Az átlagos túlélés mediánja a BLS-csoport 16 hetéről 31 hétre nőtt az FGS-csoportban. Az FGS az egerek 67% -ánál gyógyult meg (a műtétet követő> 6 hónapos daganat jele nélkül élt), míg a BLS-n átesett egereknek csak 37% -a (p = 0,049).
Következtetések
Az emberi vastagbélrák ortotóp meztelen egérmodelljeinek műtéti eredményeit jelentősen javították FGS-sel. A mostani tanulmány a daganatok fluoreszcens jelölésének különféle hatékony módszereivel lefordítható a klinikára.
Bevezetés
A kolorektális rákban (CRC) szenvedő betegek teljes túlélésének legfontosabb legfontosabb prognosztikai tényezője nemcsak a reszektált perem mikroszkópos állapota, hanem a daganat teljes reszekciója az összes helyen (R0) (1, 2). Az R0 reszekció elérése jelentősen javíthatja a vastagbél-végbélrákban szenvedő betegek 5 éves túlélési arányát (3). A CRC reszekciója után a hosszú távú túlélés a műtéti eljárás radikalitásától függ (4). A primer és metasztatikus elváltozások teljes felderítése a műtét idején ezért létfontosságú a műtéti reszekció optimalizálásában. Egyértelmű túlélési előnye van a primer és metasztatikus CRC teljes reszekciójának, ha klinikailag megfelelő (5).
Korábban már bemutattuk a primer és metasztatikus elváltozások fokozott megjelenítését és detektálását fluoreszcens szondák alkalmazásával (6-9). Ebben a tanulmányban beszámolunk a fluoreszcenciával vezérelt műtéti reszekció eredményességének javításáról az eredmények javítása érdekében, a műtéti reszekció optimalizálásával az emberi vastagbélrák egérmodelljeiben. A jobb eredmények közé tartozik a kiújulási arány csökkentése és ezáltal az általános túlélés javítása.
Anyagok és metódusok
Sejtkultúra
Humán vastagbélrákos sejtvonalakat A zöld fluoreszcens fehérjét (GFP) és a vörös fluoreszcens fehérjét (RFP) expresszáló HT-29-Ds Red expresszáló HCT-116-GFP sejtvonalakat DMEM-ben (Gibco-BRL, Grand Island, NY) fenntartjuk. 10% -os szarvasmarha-magzati szérum (Hyclone, Logan, UT). A sejttenyésztő táptalajt penicillinnel/sztreptomicinnel (Gibco-BRL), nátrium-piruváttal (Gibco-BRL), nátrium-hidrogén-karbonáttal (Cellgro, Manassas, VA), L-glutaminnal (Gibco-BRL) és minimális esszenciális táptalaj nem esszenciális aminosavakkal egészítettük ki. (Gibco-BRL). A sejteket 37 ° C-on inkubáltuk 5% szén-dioxiddal.
Állatgondozás
A nőstény atymikus nu/nu meztelen egereket nagy hatékonyságú, részecske-levegővel szűrt állványokon lévő gáton tartották fenn. Az állatokat autoklávozott laboratóriumi rágcsáló-táplálékkal etettük (Teckland LM-485; Western Research Products, Orange, CA). Az összes műtéti beavatkozást altatásban végeztük 100 μl 100 mg/kg ketamin és 10 mg/kg xilazin keverékének 100 μl intramuszkuláris injekciójával. Mindegyik eljáráshoz 20 μl 1 mg/kg buprenorfint adtak a fájdalom csökkentésére. Az eutanáziát 100% -os szén-dioxid inhalációval, majd méhnyak diszlokációval értük el. Valamennyi állatkísérletet az UCSD Intézményi Állattenyésztési és Felhasználási Bizottság (IACUC) hagyta jóvá, és az Országos Egészségügyi Intézet (NTH) Állatok gondozására és felhasználására vonatkozó útmutatójában ismertetett elvekkel és eljárásokkal összhangban végezte el.
Szubkután tumorsejt beültetés
A humán HCT-116-GFP vastagbélrák sejteket tripszinezéssel gyűjtöttük be, és kétszer szérummentes tápközeggel mostuk. A sejteket (2 × l06 100 μl szérummentes táptalajban) szubkután injekcióval injektáltuk a betakarítástól számított 30 percen belül 4 és 6 hetes nőstény nu/nu egerekben a jobb és bal oldali száron. Hagytuk, hogy a szubkután daganatok 2-4 hétig növekedjenek, amíg elég nagyok ahhoz, hogy megfelelő daganatot biztosítsanak az ortotóp beültetéshez.
Ortotópos tumor beültetés
Sejtes ortotóp beültetéshez (COI) humán vastagbélrák HT-29-Ds-Vörös sejteket tripszinezéssel gyűjtöttünk be, és kétszer mossunk szérummentes táptalajjal. Az életképességet a Vi-Cell XR automatizált sejt-életképesség-analizátorral (Beckman Coulter, Brea, CA) 95% -nál nagyobbnak ellenőrizték. A HT-29-Ds-vörös sejteket 2 millió sejt/10 μl szérummentes táptalaj koncentrációjában reszuszpendáltuk. Középvonalú hasi bemetszést hajtottak végre, és a vakbemenetet a bemetszésen keresztül szállították. Ortotóp humán vastagbélrák modelleket hoztak létre meztelen egerekben, fluoreszcens HT-29-Ds vörös daganatos sejtek közvetlen injektálásával a vakbél falába Hamilton fecskendő (Hamilton Co, Reno NV) segítségével. A műtéti ortotópos beültetéshez (SOI) a HCT-116-GFP szubkután daganatok egyetlen 1 mm 3 -es tumorfragmensét 8-0 nylon műtéti varratokkal varrtuk a cecalis fal mesenterialis határáig. A befejezés után a vakbél visszatért a hasba, és a bemetszést két rétegben lezártuk 6,0 Ethibond nem felszívódó varrat segítségével (Ethicon Inc., Somerville, NJ).
Tumor reszekció
Állati képalkotás
A kiújulás felmérése és a daganat progressziójának követése érdekében az egerek heti teljes képi felvételét MT-20 fényforrást (Olympus Biosystems, Planegg) tartalmazó Olympus OV-100 kisállat képalkotó rendszerrel (Olympus Corp, Tokió, Japán) végeztük. Németország) és a DP70 CCD kamera (Olympus Corp.). Az összes képet az Image J v.440-vel elemeztük (National Institute of Health, Bethesda, MD).
Szövet szövettana
A műtéti eredmények és a szövettan közötti összefüggés érdekében a daganatmintákat eltávolítottuk a környező normál szövetekkel a reszekció idején. A friss szövetmintákat rögzítettük Bouins-oldatban és paraffinba ágyazott érdeklődésre számot tartó régiókat a metszet előtt, majd H&E-vel festettük a szokásos fénymikroszkópia céljából. A H & E-vel festett állandó szakaszokat Olympus BX41 mikroszkóppal vizsgáltuk, amely Micropublisher 3.3 RTV kamerával volt felszerelve (QImaging, Surrey, B.C., Kanada). Az összes képet a QCapture szoftver (QImaging) segítségével szereztük be, utólagos feldolgozás nélkül.
Adatfeldolgozás és statisztikai elemzés
Az összes statisztikai elemzéshez a PASWStatistics 18.0-t (SPSS, Inc.) használtuk. A daganat terheit vagy mediánban (tartományban) vagy átlag ± SEM-ben fejezzük ki. Két csoport közötti folytonos változók összehasonlításához Student t-tesztet alkalmaztunk; ANOVA modelleket használtunk több csoport összehasonlítására. A kategorikus változók összehasonlítását Fisher pontos tesztjeivel elemeztük. A túlélési eredményeket log rangs tesztek segítségével hasonlítottuk össze, a 95% -os konfidencia intervallummal járó kockázati arányokat pedig Cox arányos veszélyességi modellekkel becsültük meg. A ≤0,05 p-értéket statisztikailag szignifikánsnak tekintették az összes összehasonlításban.
Eredmények
A CRC fluoreszcenciával vezérelt műtéte ortotóp egér módban
Első célunk az FGS-sel végzett műtéti eredmények javítása volt az emberi vastagbélrák ortotóp egérmodelljeiben. Ennek elérése érdekében ortotóp egérmodelleket hoztak létre fényesen fluoreszkáló HT-29-ds vörös daganatos sejtek vagy HCT-116-GFP tumor fragmensek beültetésével a nu/nu nőstény egerek vakbélfalaiba. A randomizált csoportok között nem volt szignifikáns különbség a preoperatív tumor terhelésében (p = 0,728). Az Olympus MVX-10 hosszú munkatávolságú fluoreszcenciát boncoló mikroszkóppal műtéteket hajtottak végre minden egérben. A BLS csoport reszekcióit erős fény megvilágításával hajtották végre. A fluoreszkáló megvilágítást egy GFP vagy RFP szűrőn keresztül értük el, amelyet az FGS elvégzésére használtunk.
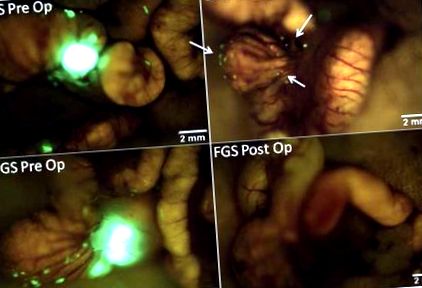
Jelentős javulást tapasztaltunk a primer vastagbélrák megjelenítésében, valamint a tumor különálló, milliméter alatti metasztatikus lerakódásai a vakbélen, lehetővé téve a tumor fokozott megkülönböztetését a környező normál bél- és mesenterialis szövetektől az FGS csoportban (1. ábra). A tumor margók azonosításának ez a fokozott képessége lehetővé tette a rák teljesebb reszekcióját, ami jelentős különbséget eredményezett az R0 reszekciók arányában a műtéti csoportok között (1. táblázat). A postoperatív képalkotás alapján minden FGS-ben részesülő egérben R0 reszekciót értek el. A BLS azonban csak 58% -os R0 reszekciós arányt nyújtott, ezáltal az FGS-hez képest lényegesen több maradvány betegségben szenvedő egér maradt posztoperatív módon (p = 0,001).
Pre- és postoperatív képek FGS és BLS alatt ortotóp egér modellben. Ezek reprezentatív pre- és posztoperatív képek egy egérről a BLS csoportból (felső panel) és az FGS csoportból (alsó panel). A tumor margók fluoreszcencia-irányítás alatt történő megjelenítésének és azonosításának fokozott képessége teljesebb reszekciót tett lehetővé. Az FGS csoport összes egere R0 reszekción esett át, míg a BLS csoportban csak az egerek 58% -ánál nem volt bizonyíték a maradék fluoreszcens daganatra a posztoperatív képeken (nyilak a jobb felső panelen) (p = 0,001).
- Vastagbél reszekciós műtét polipok vagy vastagbélrák oregoni sebészeti szakemberek számára
- A kemoterápiás mellékhatások gyógyítják a zsályarák ellátását Természetes rákkezelő méregtelenítő központ
- Étrendi ajánlások a vastagbélpolipok és a vastagbélrák kezelésére - Irvine, Kalifornia; Newport Beach, Kalifornia
- Divertikuláris betegség - vastagbél; Végbélsebészeti munkatársak
- A szója mítoszának megcáfolása növeli a méhnyakrák kockázatát - a rák egészsége