Az intelligens implantátumszintézis felé: Különböző felszívódóképességű biokerámiák kötése a csontnövekedési arányokhoz
Tárgyak
Absztrakt
A kraniofacialis rekonstrukciós műtéthez olyan bioaktív csontimplantátumra van szükség, amely képes fokozatos felszívódást biztosítani és a gyógyulás során alkalmazkodni az új csontképződés kinetikájához. Jelenleg rendelkezésre állnak kalcium-foszfátból vagy bioaktív üvegből készült bioanyagok, főként csonthiány-töltőanyagként, de még mindig sokoldalú feldolgozási technikára van szükség az összetétel-gradiens biokerámia gyártásához kontrollált reszorpciós implantátumokként. Itt beszámoltak a lézeres burkoláson alapuló gyors prototípus alkalmazásáról olyan háromdimenziós biokerámiás implantátumok előállítására, amelyek közepes mértékben kalcium-foszfát belső magot tartalmaznak in vitro lebomlás fiziológiás pH-n, bioaktív üveg külső réteggel, nagyobb lebonthatósággal körülvéve. Az implantátum minden egyes alkotóeleme kémiai és fizikai tulajdonságai, valamint a toxicitás hiánya szempontjából validált. Az oszteoblaszt előtti sejtadhéziós és szaporodási vizsgálatok feltárják az új csontsejtek tapadását és növekedését az anyagon. Ez a technika fokozatosan felszívódó implantátumokat biztosít az alacsony teherbírású csont helyreállításához.
Bevezetés
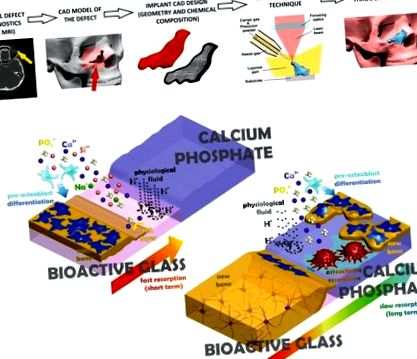
A hibadiagnosztikából az implantátumra szabott gyártás és az ebben a munkában alkalmazott módszer szemléletes ábrázolása a fokozatosan felszívódó anyag elérése érdekében. (a) A számítógépes képalkotási technikák háromdimenziós adatokat szolgáltatnak a csonthibáról, amelyeket a szükséges implantátum számítógépes modelljének megtervezésére használnak, majd gyors prototípus-készítéssel állítják elő. (b) Az implantátum külső bioaktív üveg (BG) rétegét (bal felső sarokban) egy kezdeti szakaszban felszívja a fiziológiás folyadék, elősegítve az oszteokonduktív HA réteg kicsapódását és az intenzív csontképződéshez szükséges oszteoblaszt prekurzorok differenciálódását. Ezt követően a belső sokfázisú CaP az oszteoklasztok és a fiziológiás folyadék közvetítésével lassan felszívódik, felszabadítva azokat a vegyi anyagokat, amelyek elősegítik a csontok növekedését és hosszú távon stabilitást biztosítanak.
Ebben a tanulmányban egy új, lézerrel segített gyártási módszert mutatunk be testre szabott csontimplantátumok számára, amelyet rekonstrukciós műtéten áteső betegek számára terveztek. Az egyedi implantátum egy CaP-val módosított, közepes lebomlási sebességű belső magból és egy nagyobb lebonthatóságú BG külső rétegből áll, amint azt az 1b. Ábra bemutatja. Ez a technika olyan eljárást biztosít fokozatos felszívódó implantátumok előállítására alacsony terhelést igénylő csontok helyreállítására, amely képes antibakteriális, angiogén vagy antiresorptív aktivitást kiváltó specifikus szerek integrálására. A lézeres burkolatot kétdimenziós változatában már alkalmazták 41,42,43,44,45,46 kalcium-foszfát bevonatok és 47 orvosilag aktív titánötvözetek bioaktív üvegbevonatok gyártására orvosbiológiai célokra.
Eredmények
A köztes folyadékfázis előállítása ennek a lézerrel támogatott technikának kulcsfontosságú jellemzője, amely szükséges a finom homogén rétegek előállításához. Kerüli a további olyan kötőanyagok szükségességét (amelyek mérgezőek vagy csökkentik a bioaktivitást) a CaP megszilárdításához a preoperatív értékelésben és a műtéti tervezésben meghatározott geometria szerint. Ezenkívül az alacsony felületi feszültségű folyékony fázis jelenléte oxyapatittól mentes felületekhez vezet, ami kihat az implantátum felszívódására és a bioaktív viselkedésre, és különösen a kémiai reakciók lehetőségére a további feldolgozás során különböző biokerámiai anyagokkal, például szilikát BG-kkel. A makroszkopikus CaP mintákat változó számú réteg egymásra rakásával állítják elő: jellemzően a mintákat 20-320 halmozott rétegből dolgozzák fel, 100-300 mikrométer közötti rétegvastagsággal és 100 ° C/perc hűtési sebességgel, hogy megőrizzék az anyag integritását (lásd. (2a).
Külső héj: Lézeres burkolat erősen felszívódó bioaktív üvegből
Belső mag-külső héj csatolása fokozatosan felszívódó anyaggá
Az erősen felszívódó BG felület és a CaP többfázisú mag közötti átmenet létrehozása érdekében BG rétegeket raktunk le a korábban feldolgozott CaP implantátumokra. Miután a belső mag az utolsó CaP réteg hozzáadásával elkészült, és az anyag hőmérséklete a hűtési folyamat során 500 ° C-ra csökkent, a BG részecskéket egy másodlagos fúvóka segítségével a felületére permetezik, és lézeres besugárzást alkalmaznak. Lényegében a konszolidált CaP belső mag a külső BG rétegek szubsztrátumává válik. 200 μm és 500 μm közötti üvegvastagság egyetlen rétegben rakódhat le (4a. Ábra), de nagyobb vastagság érhető el, ha egymást követő rétegeket egymásra merőleges irányban rakunk egymásra.
A Raman-eltolódási spektrumok elemi összetétele és lineáris letapogatása a CaP mag és az S520 BG külső réteg közötti határfelületen. (a) A külső S520 BG burkolat keresztmetszeti SEM áttekintése. (b) Elemösszetétel, amelyet energia-diszperzív röntgenspektroszkópia (EDS) mikroanalízissel nyernek az interfész zónáján keresztül. (c) és (d) Raman-spektrumok az interfész zónáján.
A CaP belső mag és a külső BG réteg közötti határfelület TEM elemzése. (Felső középső) SEM mikrográf, amely a FIB-technikával eltávolított területet és az interfész és a lerakott üveg között fennmaradó lamellát mutatja. (Alsó középpont) A lamellaközpont transzmissziós elektronmikroszkópos felvétele a kristályos-amorf határt mutatja. (Bal alsó sarokban) Az interfész SAED-je, amely megmutatja a β-rhenanit (β-NaCaPO4) jellegzetes diffrakciós mintázatát. (Jobbra lent) Az interfészhez nagyon közel álló BG SAED-je megerősíti az amorf állapotot.
A páciensre szabott biokerámiás implantátum szerkezeti elrendezésének sematikus ábrázolása, valamint a felület és a belső mag kalcium felszabadulási profilja. (a) A beültetett csontszél közvetlen szomszédságában lévő implantátumfelület rendezetlen szilikát-tetraéderes hálózatot tartalmaz, amelyet a módosító kationok magas koncentrációja nyit meg. Az erősen reaktív BG szerkezet simán kapcsolódik a foszfát-tetraéderek és a Ca 2+ kationok kevésbé reaktív többfázisú monoklinikus elrendezéséhez egy ortorombos kristályrácson keresztül, csökkenő Na + -kation jelenlét mellett. (b) Ca 2+ felszabadulási profil Tris-HCl pufferben HA prekurzorhoz, csupasz többfázisú CaP, mielőtt lézeres burkolatot kapnának BG-vel, és minták S520 BG külső rétegekkel.
A BG külső héj szerkezeti változásait a folyamat után mértük egymás utáni mikro-Raman spektrumok felvételével az interfésztől különböző távolságokra. A hálózati kapcsolat erősen kapcsolódik az üveg bioaktivitásához 57, a magas hálózati kapcsolattal rendelkező (2,4-nél nagyobb) szemüvegeket alacsony lebonthatóság és inert biológiai válasz jellemzi, míg az erősen megszakadt hálózatok gyorsabb oldódást eredményeznek. Megfigyeltük, hogy az üvegszerkezet figyelemre méltóan nyitottabb az interfész zónához közeli régiókban, ami azt jelenti, hogy ezen a ponton nem keletkezik passzivációs réteg. Az üvegszerkezet az interfészről kifelé záródik, néhány mikrométerrel eléri az előfutár üvegszerkezetének csatlakozását. Az S520 BG alacsony kristályosodási hajlandósága miatt a felületi határfelület közelében lévő ponttól kezdve a Raman-spektrumok megegyeznek a prekurzor anyagéval, ezért az üvegszerkezet és reakciókészsége összhangban áll az alkalmazott prekurzorüveggel.
Ezeknek a lézerrel tervezett implantátumoknak a mechanikai tulajdonságai lehetővé teszik alacsony terhelésű alkalmazásokban történő alkalmazását. A nyomószilárdság, 359 ± 51 MPa, jóval meghaladja a kérgi csont nyomószilárdságát 35. A bioaktív üveg külső rétegének és a CaP-magnak a keménysége, 454 ± 30 és 443 ± 19 HV és a törésállóság KAz IC 0,91 ± 0,13 és 1,29 ± 0,17 MPa · m 1/2 megfelel a bioaktív üvegek és a CaP hangkerámiák jelentett értékeinek 35,58 .
A CaP- és BG-rétegek szekvenciális feldolgozása révén, lézeres burkoláson alapuló gyors prototípus-készítéssel, egyedülálló implantátum-anyagokat kaptunk, amelyek egy többfázisú CaP-magot tartalmaznak, amelyet BG-burkolat vesz körül. A fiziológiai közegben végzett lebonthatósági tesztek alapján a BG külső rétegei várhatóan magasak lesznek in vivo reaktivitás, amely megfelel a csont növekedési sebességének a korai beültetési időpontokban, míg a többfázisú CaP mag alacsonyabb lebonthatóságot biztosít és hosszú távon garantálja az implantátum működését (lásd 6b. ábra). Az implantátumban lévő egyes anyagok mennyisége testreszabható, ezáltal lehetővé téve a reszorpciós és az osteoconduction szintek adaptálását az implantátum minden egyes helyén, és javítva annak fokozatos helyettesítését az újonnan képződött csonttal. Ezenkívül a részecskeinjekciós jellemzők lehetővé teszik a felület emelését biológiai jelentőségű sajátosságokkal, például antibakteriális vagy angiogén aktivitással további részecskék, például Ag2O, ZnO, Co3O4 vagy SrO beépítésével.
Következtetés
A CaP és BG részecskéket használó lézeres burkoláson alapuló gyors prototípus alkalmazásával bebizonyítottuk, hogy egyedi implantátumokat lehet előállítani az alacsony terhelést igénylő csontok helyreállításához. A feldolgozási módszert nagy teljesítményű lézersugár jellemzi önfenntartó olvadt anyag előállítására, anélkül, hogy formákat, adalékanyagokat vagy utófeldolgozási követelményeket támasztana. Az implantátumokat az alacsony reszorbálhatóságú többfázisú CaP testreszabott eloszlása jellemzi a magban és a rendkívül reaktív BG a felszínen, amelyek összekapcsolódnak egy bioaktív nátrium-kalcium-foszfát interfész kialakításán keresztül. A BG prekurzor részecskék bioaktivitása és lebomlási sebessége megmarad a külső rétegek lerakódása után. Az ilyen típusú implantátum sokoldalúsága számos alkalmazás előtt megnyitja a kaput, például az in vivo vizsgálatok a CaP és a BG optimális szakaszának és arányának meghatározásához, amelyek szükségesek az új csontnövekedési sebesség minden egyes esethez.
Kísérleti szakasz
Bioaktív üvegrészecskék szintézise
Nagy tisztaságú reagenseket (Sigma-Aldrich) alkalmaztunk bioaktív üvegek szintetizálására a 45S5 bioaktív üveg (46,1 SiO2, 26,9 CaO, 24,4 Na2O, 2,6 P2O5; moláris%) és az S520 bioaktív üveg (52,0 SiO2, 18,0 CaO) összetételével megegyező összetételű szintézishez. (20,9 Na2O, 2,0 P2O5, 7,1 K2O; mol%). A prekurzor keverékeket megolvasztjuk (1,5 óra 1400 ° C-on) és ezt követően 1 órán át finomítjuk Pt-tégelyben. Az olvadékot ionmentesített vízben gyorsan leállítottuk, majd szárítottuk. A kapott üvegfritteket ledaráltuk, és 100–250 μm között szitáltuk a gáz-szilárd fázisú injektoron keresztüli folyékonyság javítása érdekében.
A többfázisú kalcium-foszfátmag szintézise
Bevonás bioaktív üveggel
Az utolsó egymásra helyezett szalag lerakása után a kalcium-foszfát magot a bioaktív üveggel történő bevonáshoz szükséges helyzetbe forgatjuk. A bioaktív üvegszemcséket egy második injektor segítségével injektálják az interakciós zónába. A folyamat ezen lépésében az egymást követő lerakódott bioaktív üvegcsíkokat nem helyezzük egymásra, hanem átfedjük, hogy kétdimenziós bevonatot kapjunk. A lézersugarat és a poráramot ebben a második elrendezésben defokuszáljuk, hogy nagyobb felületet fedjenek le; a bioaktív üveg tömegáramát állandóan 20 mg/s értéken tartottuk. A közeli infravörös lézersugár (hullámhossz λ = 1064 nm) feldolgozási energiasűrűségére 45 J/mm2 értéket választottak 500 μm alatti bioaktív üvegvastagságok esetén. 500 μm feletti vastagság esetén hosszabb λ = 10600 nm hullámhosszat (nagy teljesítményű CO2 lézer, Rofin) alkalmaztunk a szilikát üveghálózathoz való energiacsatlakozás növelésére; ezt a lézerforrást 25 J/mm 2 energiasűrűséggel működtették. A szállítógáz térfogatárama 1,0 l/perc volt, és csökkentett 2,0 l/perc védőgáz-áramot alkalmaztunk.
Merülési teszt Tris-pufferben
A feldolgozott mintákat külön műanyag tartályokba helyeztük, 150 ml 0,05 M Tris-HCl pufferrel (Tris (hidroxil) metil-amino-metán-HCl), pH = 7,4, 36,5 ° C-on (ISO 10993-14 szabvány). 0,155 cm2/ml mintafelület/pufferoldat arányt alkalmaztunk. A bemerített mintákat és az oldatot keverés közben 36,5 ° C-on tartottuk. A következő időszakok mindegyikében egy 6 ml-es alikvot oldatot vettünk: 0,5, 1, 3, 6, 10, 24, 48, 72, 168, 336 és 504 óra. Mindössze 0,05 M Tris-HCl puffer kontrollmintákat használtunk a vizsgálati folyamat bármilyen hatásának elvetésére a végeredményben. Ezen túlmenően összehasonlítás céljából teszteltük a lézerrel feldolgozott mintákkal megegyező méretű prekurzor 45S5 bioaktív üveg mintákat. Minden más anyagból tíz másolatot teszteltünk. Mindegyik oldatot steril szűrőn szűrjük, hogy eltávolítsuk a szilárd anyagokat a folyadékból, és centrifugáljuk, hogy biztosítsuk a maradék szilárd anyag elválasztását. A spektroszkópiai elemzéseket induktívan kapcsolt plazma – optikai emissziós spektroszkópiával (ICP-OES, Perkin Elmer Optima 4300 DV) végeztük. A kalibrálást a Ca, Si, P, Na és K elemzésekhez 10 mg/l standardokkal végeztük, RSD értéke 2,0% alatt volt.
Sejtkultúra
Az anyag biológiai teljesítményét az oszteoblaszt előtti MC3T3-E1 sejtvonal alkalmazásával értékeltük. Ezt a sejtvonalat C57BL/6 egér kalvariából hozták létre, és az Európai Sejtkultúrák Gyűjteményéből (ECACC, Egyesült Királyság) szerezték be. A sejteket MEM-alfa-ban (Sigma, USA) tenyésztettük, 10% fetalis marha-szérummal kiegészítve (FBS; Invitrogen, USA), és 37 ° C-on, nedvesített atmoszférában, 5% CO2 mellett tartottuk. A 10 × 10 mm 2 területű lézeres burkolattal feldolgozott mintákat ultrahangos fürdőben etanollal és acetonnal tisztítottuk, majd levegőn szárítottuk egy lamináris áramlási kamrában. Ezt követően a mintákat 15 percig autoklávban tartottuk 121 ° C-on.
In vitro citotoxicitás
Mechanikai tulajdonságok
A nyomószilárdságot úgy határoztuk meg, hogy nyolc CaP-BG hengeres mintát (8 mm átmérőjű) száraz körülmények között aprítottunk, 50 kN terhelő cellával felszerelt axiális tesztgéppel, 0,1 mm/perc rámpa sebességgel. A Vickers mikrokeménység HV0.5 értékét mikrokeménység-tesztelő géppel mértük, 15 másodperc alatt 4,903 N terhelést alkalmazva a bioaktív üvegfelületre, illetve a CaP mag keresztmetszetére. A törésállóság KAz IC-t közvetlenül a behúzás után értékeltük a jól fejlett radiális repedésekből 58. A CaP belső mag Young moduljának 95 GPa értékét, a bioaktív üveg külső rétegének pedig 78 GPa értéket alkalmaztuk.
további információ
Hogyan lehet idézni ezt a cikket: Comesaña, R. és mtsai. Az intelligens implantátumszintézis felé: Különböző felszívódóképességű biokerámiák kötése a csontnövekedési arányokhoz. Sci. ismétlés. 5., 10677; doi: 10.1038/srep10677 (2015).
- Miért nem működik az éheztetés a fogyás MD-tényezőjéhez - szempilla kondicionáló, hajnövekedés
- Mennyi az átlagos percenkénti lépés a különféle gyakorlatokhoz
- Fogyás - szakállnövekedés Formula Choice kiegészítők
- Súly irányelvek a belépéshez a meccshez
- Fogyás A 26. nő karcsú a 8. méretre - és annyira másképp néz ki, még anyukája sem ismeri fel