Az Interleukin-15 kezelés a limfocitáktól független súlycsökkenést vált ki
Nicole G. Barra
Patológiai és Molekuláris Orvostudományi Tanszék, McMaster Immunológiai Kutatóközpont és Fertőző Betegségkutató Intézet, McMaster Egyetem, Hamilton, Ontario, Kanada,
Marianne V. Rág
Patológiai és Molekuláris Orvostudományi Tanszék, McMaster Immunológiai Kutatóközpont és Fertőző Betegségkutató Intézet, McMaster Egyetem, Hamilton, Ontario, Kanada,
Sarah Reid
Patológiai és Molekuláris Orvostudományi Tanszék, McMaster Immunológiai Kutatóközpont és Fertőző Betegségkutató Intézet, McMaster Egyetem, Hamilton, Ontario, Kanada,
Ali A. Ashkar
Patológiai és Molekuláris Orvostudományi Tanszék, McMaster Immunológiai Kutatóközpont és Fertőző Betegségkutató Intézet, McMaster Egyetem, Hamilton, Ontario, Kanada,
A kísérletek megtervezése és megtervezése: AAA. Végezte a kísérleteket: NB MC SR. Elemezte az adatokat: NB. Írta az írást: NB AAA.
Absztrakt
Bevezetés
Az elhízást a zsírszövet felhalmozódásaként definiálják, és szisztémás krónikus gyulladással társul [1]. Az elhízott egyének megváltozott immunválaszai a közelmúltban társbetegségek, például inzulinrezisztencia és diszlipidémia kialakulásához kapcsolódnak [1] - [3]. Gyulladásos állapotként az elhízást a különböző immunsejtek fokozott beszivárgása jellemzi a zsírszövetben, például az M1 polarizált makrofágokban, valamint a gyulladáscsökkentő immunsejtek, például az M2 polarizált makrofágok csökkenése [2], [4]. Mivel a prevalencia aránya és az azzal járó krónikus állapotok folyamatosan emelkednek, az elhízás és az ahhoz kapcsolódó társbetegségek kezelésére vonatkozó új terápiás stratégiák megfogalmazása során elengedhetetlen az elhízással kapcsolatos patofiziológia és az anyagcsere-betegség kialakulásához való immun hozzájárulás áttekintése.
Noha számos jelentés megvizsgálta a megváltozott zsírszöveti makrofág fenotípusok szerepét elhízott egyéneknél [2], [4], [5], a legújabb tanulmányok összefüggéseket is kimutattak az elhízás és a limfocita populációk változásai között. Az elhízott zsírszövetben megnövekedett CD8 + T-sejteket, csökkent CD4 + és gyulladáscsökkentő szabályozó T-sejteket találtak [6], [7]. Az elhízott zsírszövetről kimutatták, hogy aktiválja a CD8 + T sejteket, ami makrofágok toborzásához és aktivációjához vezet [7]. Valamint kimutatták, hogy a természetes gyilkos T (NKT) sejtek szerepet játszanak az elhízással járó metabolikus rendellenességekben [8], [9]. Végül a veleszületett immun-természetes gyilkos (NK) sejtek csökkenték a citotoxicitást az elhízott állatokban a sovány kontrollokhoz képest [10]. Ezekben a limfocita populációkban bekövetkezett változások elhízott egyénekben azt sugallják, hogy ezeknek a sejttípusoknak a jelenléte vagy hiánya szerepet játszhat a súlyszabályozásban. Mivel a proinflammatorikus citokinek termelésének diszregulációja is hozzájárul ehhez a gyulladásos állapothoz olyan tényezők révén, mint az interleukin-6 (IL-6) és a tumor nekrózis faktor –α (TNF-α) [11], meghatározva e citokinek szerepét a szabályozásban Az elhízás esetén bekövetkező immun limfocita válaszok szintén elengedhetetlenek az elhízott egyének kezelésének megfogalmazásában.
Ebben a tanulmányban arra kerestük a választ, hogy az NK-sejtek közvetítik-e a fogyást az IL-15-vel kezelt állatokban. Először meghatároztuk, hogy az NK-sejtek más limfocitákkal, például NKT és T-sejtekkel együtt felhalmozódnak-e a zsírszövetben akut IL-15 kezeléssel a kontroll B6 egerekben. Annak megállapítására, hogy az IL-15 indukál-e súlyvesztést közvetetten az NK-sejtek aktiválásával, kimerítettük az NK-sejtek egereit egy NK1.1-sejtréteget lebontó antitest segítségével, amelyet IL-15-vel kezeltünk, és követtük nyomon a súlycsökkenést. A limfociták IL-15 kezelés útján történő aktiválásának fontosságának meghatározásához a RAG2 -/- γc -/- egér modelljét is alkalmaztuk, amely nem tartalmaz limfocitákat és hiányzik a γ-receptor alegység. Ezek a kísérletek összességében meghatározzák a limfociták, elsősorban az NK-sejtek szerepét a zsírszövet IL-15-szabályozásában.
Mód
Etika
Minden állatkísérletet a McMaster Egyetem Állatkutatási Etikai Testülete (AREB) hagyott jóvá. Az AREB jóváhagyási száma: 10-02-12.
Állatok
Tizenhat hetes C57BL/6 (B6) nőstény egereket vásároltunk a Charles River Laboratory-ból (Quebec, Kanada). A nőstény limfocita-hiányos Balb/c RAG-2 -/- γc -/- egereket M. Ito (Központi Kísérleti Állatok Intézete, Kawasaki, Japán) által ajándékba adott tenyészpárokból tenyésztették, és a McMaster Egyetem Központi Állat-létesítményében tartották fenn. A RAG2 gén nullmutációja megakadályozza a B és T limfociták fejlődését ezekben az egerekben, míg a γ-lánc alegység hiánya megakadályozza az NK sejtek érését. Az egereket öt fős csoportokban tartottuk ketrecben, és ellenőrzött megvilágításban (12-12 liter: D) és hőmérsékleten (22 ° C) tartottuk, ad libitum hozzáféréssel egy alacsony zsírtartalmú, besugárzott chow-étrendhez, amely 18,6% fehérjét, 6,2% zsírt és 3,5% rost (2918, Tekland Global Diets, Indianapolis, IN) és a víz.
Az IL-15 és az NK1.1 + sejtkimerülési kísérlet leadása és detektálása
A testsúlyt és az élelmiszer-fogyasztást naponta ellenőriztük a kezelés kezdetétől az egerek feláldozásáig. Az élelmiszer-fogyasztást öt egymást követő napon keresztül mértük. Az előmelegített ételt ételtartókba helyezték, és naponta mérték ketrecenként. A táplálékfelvételt az egér gramm/nap elfogyasztott grammjaként rögzítették. A súlycsökkenés százalékos arányát akkor regisztráltuk, amikor az egereket vagy Ad-expresszáló humán IL-15 vektorral, Opt.hIL-15-vel („AdIL-15”) vagy üres adenovírus-vektorral („AdControl”) szállítottuk, amint azt korábban leírtuk [28]. . Röviden, egy 18-aa-ra optimalizált szignálpeptidet illesztettünk be az érett hIL-15 gén elé többlépéses polimeráz láncreakciókkal (PCR) a Molecular Biology Institute (McMaster University) által biztosított primerek alkalmazásával. Miután a 402 bp-os PCR-terméket izoláltuk (Opt.hIL-15), expressziós vektorokba klónoztuk KpmI és XhoI helyek felhasználásával, az Opt-hIL-15-t inszertáltuk a pDC316 adenovírus shuttle vektorba, majd ezt követően előállítottuk Ad-Op-hIL-15 pDC316 a Robert E. Fitzhenry Vektor Laboratóriumban (McMaster Immunológiai Kutatóközpont, McMaster Egyetem) [28].
A B6 egereket és a RAG-2 -/- γc -/- egereket 5x108 pfu AdIL-15, AdControl vagy 200 µl PBS-sel adtuk be IV farokinjekcióval a 0., 2. és 4. napon (n = 5 csoportonként) ). Az NK1.1 + sejt depléciós kísérlethez a B6 egereket intraperitoneálisan injektáltuk 200 µg anti-egér NK1.1 antitesttel (PK136 egér immunglobulin G2a hibridóma HB191; ATCC) naponta két napig az AdIL-15 kezelés előtt, majd ezt követően háromhavonta. nappal a kezelés után (n = 7 csoportonként). Az egereket a 8. napon elaltattuk és feláldoztuk. Az áldozatot megelőzően a vért a hasi aortán keresztül gyűjtöttük, és 5000 fordulat/perc sebességgel 10 percig centrifugáltuk a szérum összegyűjtése érdekében. A humán IL-15 szinteket a szérumból hIL-15 DuoSet ELISA kit segítségével (R&D Systems, Minneapolis, MN, USA) határoztuk meg.
A zsírszövet gyűjtése, szövettan és sejtszám
A RAG-2 -/- γc -/- egerek zsigeri nemi nemi zsírpárnáit lemértük és paraformaldehidbe rögzítettük. Ezután a szöveteket paraffinba ágyazottuk, és egérenként két keresztmetszetet festettünk hematoxilinnal és eozinnal (H&E). Minden keresztmetszethez 8 látómezőt számszerűsítettünk a sejtterületekre az AxioVision szoftver segítségével (készítette: Carl Zeiss MicroImaging).
Sejtek izolálása zsírszövetből a FACS elemzéshez
A B6 egerekből lemért zsigeri mirigy zsírpárnákat izoláltunk, PBS-ben mostunk, daráltunk és emésztettük a kollagenáz A-ban (Roche Applied Science, Laval, Quebec, Kanada) és 0,025 mg/ml DNase-ben (Roche Applied Science, Laval, Quebec, Kanada). 30 percig 37 ° C-on. A sejtszuszpenziót 100 µm-n, majd 70 µm és 40 µm sejtszűrőn átszűrtük, hogy eltávolítsuk a szövetrészecskéket. Ezt az oldatot 10 percig 1200 fordulat/perc sebességgel 4 ° C-on centrifugáljuk. A felülúszót, amely tartalmazta a maradék adipocitákat, eldobtuk, és a sztrómás vaszkuláris frakciót ACK lízispufferben újraszuszpendáltuk a vörösvérsejtek eltávolítása céljából, és PBS-ben mostuk. A sejteket hemocitométer alkalmazásával megszámoltuk, és FACS-analízishez 0,2% -os szarvasmarha-szérumalbumin PBS-oldatban szuszpendáltuk. Üregenként ötszázezer sejtet terítettünk egy 96 lyukú lemezre. Miután a sejteket CD16/CD32 antitest (eBioscience, San Diego, CA) alkalmazásával megmostuk és blokkoltuk, fluoreszcein-izotiocianát-, alexa fluor 700- és phikoeritrinnel konjugált anti-egér CD45.2-vel (104-es klón, eBioscience) festettük fel őket., CD3 (17A2 klón, eBioscience) és NK1.1 (PK136 klón, BD Pharmingen) antitestek. A festett sejteket LSRII áramlási citométeren elemeztük, összegyűjtve 50 000 kapuzott eseményt, és FlowJo áramlási citometriás elemző szoftverrel.
Statisztika
Az összes statisztikai elemzést Graph Pad Prism 4 alkalmazásával hajtottuk végre. Az eredményeket átlag ± SEM-ben fejezzük ki. Az adatokat egyirányú ANOVA alkalmazásával elemeztük, amelyet Tukey post hoc többszörös összehasonlító tesztje követett 3 csoport összehasonlításra, míg Student t-tesztet használtunk 2 csoport összehasonlítására. A jelentőséget akkor jelezzük, amikor p 1. táblázat). Az AdIL-15-vel kezelt egerek lényegesen nagyobb súlyt vesztettek, fenntartották a szérum hIL-15 expresszióját, és az emésztett zsigeri zsír sztrómás vaszkuláris frakciójában magasabb volt a sejtszám grammonként, összehasonlítva az AdControlt vagy a PBS-t kapott egerekkel (1A ábra - C). Az áramlási citometriás elemzés azt mutatta, hogy az IL-15-tel kezelt állatokban megnőtt a leukociták (CD45 +), T (CD3 +), NK (CD3 - NK1.1 +) és NKT (CD3 + NK1.1 +) sejtek százalékos aránya. zsigeri zsírszövet a kontrollokhoz képest (2. ábra). Hasonlóképpen, a perifériás leukociták, a T, az NK és az NKT sejtek is szignifikánsan megemelkedtek az IL-15 kezelt egerek lépében a kontrollokhoz képest (az adatokat nem mutatjuk be).
Asztal 1
| Kezelési csoportok | |||
| Intézkedés | PBS | AdControl | AdIL-15 |
| Kezelés előtt (B6 egerek) | 25,80 ± 1,55 | 26,34 ± 0,78 | 25,32 ± 0,82 |
| Kezelés után (B6 egerek) | 25,82 ± 1,55 | 26,40 ± 0,78 | 22,35 ± 0,84 *** |
| Kezelés előtt (Rag2 -/- γc -/- egerek) | 40,62 ± 2,76 | 37,72 ± 1,47 | 39,36 ± 3,61 |
| Kezelés után (Rag2 -/- γc -/- egerek) | 41,31 ± 2,71 | 37,77 ± 1,58 | 30,91 ± 2,76 ** |
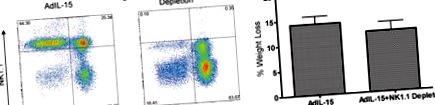
A CD45.2 + populációból kapuzott CD3 és NK1.1 sejtek elemzése (A) AdIL-15 kezelt B6 egerek és (B) NK1.1 + kimerítette az AdIL-15-gyel kezelt egereket a zsigeri gonád zsírszövetében. (C) Az oszlopdiagram a nőstény kezelt egerek súlycsökkenését mutatja (n = 7 csoportonként).
2. táblázat
| Kezelési csoportok | ||
| Intézkedés | AdIL-15 | AdIL-15 + NK1.1 kimerülés |
| Kezelés előtt (B6 egerek) | 29,18 ± 2,65 | 29,34 ± 1,84 |
| Kezelés után (B6 egerek) | 25,09 ± 2,49 ** | 25,91 ± 1,93 *** |
(A) A súlycsökkenés oszlopdiagramon ábrázolt százaléka (B) A képen kivágott zsigeri mirigy zsír látható reprezentatív női naiv, Ad-Control és AdIL-15 kezelt RAG2 -/- γc -/- egerekből származik. (C) A zsigeri nemi mirigy zsírpárnája grammban, oszlopdiagramként (n = 5 csoportonként). (D) Egér grammjára elfogyasztott étel 5 egymást követő napon keresztül figyelve (n = 5 csoportonként). * P 4. ábra), majd megvizsgáltuk a hasi zsírpárnák keresztmetszeteit annak felmérése érdekében, hogy az IL-15 kezelés tulajdonítható-e a csökkent sejtméretnek és zsírtartalomnak. Ezek a szakaszok zsugorodott adipocitákat tárnak fel, amelyek alacsonyabb sejtterületet eredményeznek az AdIL-15-vel kezelt RAG2 -/- γc -/- egerekben, mind az Ad-Control, mind a PBS csoporthoz képest (5. ábra). Ez arra utal, hogy az IL-15 adipozitásra gyakorolt hatását a limfociták nem közvetítik, és a közös γ-láncon keresztüli szignalizációtól függetlenül jelentkeznek.
In vitro vizsgálatok kimutatták, hogy az IL-15 tenyésztett adipociták alkalmazásával közvetlenül befolyásolja a zsírszövetet. Rekombináns IL-15 kezelésről kimutatták, hogy az egér adipogén 3T3-L1 sejtvonal segítségével gátolja a preadipocita differenciálódást és a lipid lerakódást [37]. Hasonló eredményeket mutattunk lipoaspirátból származó humán adipocitákban is, amelyeket differenciálódáskor IL-15-vel kezeltek [14]. A preadipocita differenciálódás gátlása a kalcineurin [38] megnövekedett mRNS-expressziójával és/vagy a jelátalakítókban és az 5-ös transzkripció aktivátorának (STAT5) expressziójának változásával jár [39]. Nemrégiben kimutatták, hogy az IL-15 beadása in vitro befolyásolja az érett differenciált adipociták lipidtartalmát, ami arra utal, hogy az IL-15 közvetlenül befolyásolja a limfocitáktól független adipocitákat [39].
Korábban ribonukleáz-védelmi vizsgálatok segítségével kimutatták, hogy a fehér zsírszövetben mindhárom IL-15 receptor szignál alegység (α, β, γ) mRNS-je van, ami arra utal, hogy a keringő IL-15 képes közvetlenül jelezni az adipocytákban [ 18]. Az IL-15 egy heterotrimer receptor komplexen keresztül szignálozik, beleértve az IL-2-vel megosztott β-alegységet és más interleukinekkel megosztott y-lánc-alegységet (IL-2, -4, -7, -9 és -21). A harmadik egyedi α alegység az IL-15 specifitását és nagy affinitású kötését biztosítja ehhez a komplexhez [40], [41]. Tanulmányok kimutatták, hogy az IL-15 az immun limfocitákban eltérően jelez a myódió populációkhoz képest [42,43, Recenzió 41-ben]. Az IL-15 jelátvitel mechanizmusa az adipocitákban jelenleg ismeretlen.
A limfocita-hiányos RAG2 -/- γc -/- egérmodellből hiányoznak az érett NK-sejtek, mivel hiányzik a receptor γ-lánc alegység, amely szükséges az NK-sejtek éréséhez. A receptor γ-láncon keresztüli szignalizáció fontosságát korábban már vizsgálták más állatmodellekben. Alvarez és mtsai. IL-15 kezelés csökkentette a fehér zsírszövet tömegét anélkül, hogy megváltoztatta volna a táplálékfogyasztást a leptinhiányos ob/ob egerekben, de a leptin receptor negatív fa/fa Zucker patkányokban nem. Ezek a szerzők megállapították, hogy az IL-15 nem befolyásolta a zsírszövetet ezekben az elhízott patkányokban a receptor γ-lánc expressziójának csökkent szabályozása miatt [18]. Az RAG2 -/- γc -/- egereken végzett adataink viszont azt mutatják, hogy az IL-15-hez nem szükséges a receptor γ-lánc súlycsökkenéshez és az adipocita sejtméret csökkentéséhez. Ez arra utal, hogy a γ-lánc receptor alegység diszpergálható IL-15 jelátvitelhez adipocitákban, vagy kompenzációs mechanizmusok fordulhatnak elő annak hiányában. Bár kimutatták, hogy a receptor γ-lánc nélkülözhetetlen az NK és az NKT sejtek fejlődéséhez [32], [44], korábban kimutattuk, hogy az IL-15 közvetítheti hatásait e receptor alegység hiányában, ami tumorellenes eredményt eredményez. és vírusellenes aktivitás [28], [45], valamint a myeloid immunsejtek aktiválásában [46].
Összegzésként elmondható, hogy adataink arra utalnak, hogy az IL-15 kezelés NK, NKT és CD3 T limfociták felhalmozódását eredményezi a zsírszövetben. Az IL-15 azonban közvetíti a súlycsökkenést, függetlenül a limfociták aktiválódásától és a közös γ-láncon keresztüli szignalizációtól. Jelenleg nincsenek ismeretek az IL-15 anyagcsere szövetekre gyakorolt hatásairól. Eredményeinknek egyértelmű következményei vannak az immun-anyagcsere terén, megmutatva az immunfaktorok, például az IL-15 fontosságát a zsírszövet tömegének szabályozásában. A jövőbeni tanulmányoknak továbbra is azon mechanizmus (ok) meghatározására kell összpontosítaniuk, amelyben az IL-15 befolyásolja az adipocitákat.
Köszönetnyilvánítás
Köszönjük Aatif Qureshi technikai segítségét.
- Az Interleukin-15 kezelés a limfocitáktól független súlycsökkenést vált ki
- Orvosi fogyás program kezelése Ocala The Villages FL
- Orvosi fogyás klinika és kezelési program (KY & IN) Baptista egészség
- A fogyás orvosilag biztonságos aránya az elhízás kezelésére iránymutatás az
- Fogyjon le az Aranypart súlycsökkentő kezeléséről Aranypart