Az oktadecil-oxi-etil-9- [2- (foszfonometoxi) -etil] -guanin antiproliferatív hatásai a Me-180 emberi méhnyakráksejtekkel szemben in vitro és in vivo
Absztrakt
Háttér/Célok
A 9- [2- (foszfonometoxi) etil] guanin (PMEG) az aciklikus nukleozid foszfonátok sorozatának egyik legaktívabb antiproliferatív vegyülete, és egerekben intraperitoneális P388 daganatokban aktív.
Mód
Szintetizáltuk a PMEG oktadecil-oxi-etil (ODE) és hexadecil-oxi-propil-észtereit, és in vitro összehasonlítottuk antiproliferatív aktivitását a módosítatlan PMEG-vel primer emberi fibroblasztokban, valamint a CaSki, Me-180 és HeLa humán méhnyakrákos sejtvonalakban.
Eredmények
Az ODE-PMEG in vitro kiváló antiproliferatív aktivitással rendelkezett ebben a humán méhnyakrákos panelben. Összehasonlítottuk az ODE-PMEG és az ODE-cidofovir (ODE-CDV) hatásait szilárd tumor modellben, Me-180 humán méhnyakrákos sejtvonalakat alkalmazva atmikus meztelen egerekben. 25 μg ODE-PMEG vagy 100 μg ODE-CDV intratumorális injekciója napi 21 napon át, majd 20-35 napos megfigyelés, majd a mérhető méhnyakrák szinte teljes eltűnésével járt.
Következtetés
Az ODE-PMEG alkalmas lehet a nyaki dysplasia helyi vagy helyi kezelésére.
Bevezetés
Beszámoltak arról, hogy az aciklusos nukleozid-foszfonát (S) -1- [3-hidroxi-2- (foszfonil-metoxi) -propil] -citozin (cidofovir, CDV) in vitro szelektíven gátolja az emberi papillomavírus DNS + ráksejtek szaporodását [1,2, 3,4,5], állatokban [2] és férfiakban [6]. A jelentések szerint a CDV csökkenti az E6 onkoprotein szintjét, ami a p53 és a pRb növekedését eredményezi, lehetővé téve a sejt számára, hogy visszanyerje a sejtciklus irányítását, lassítsa a proliferációt és apoptózishoz vezetjen [2,3,4].
A CDV antivírusellenes aktivitása számos kétszálú DNS vírus (humán citomegalovírus, vaccinia, tehénhimlő) ellen számos logaritmust növelhet alkoxi-alkilcsoportokkal, például hexadeciloxipropil (HDP) vagy oktadeciloxietil (ODE) észterezésével [7,8,9,10] . Kimutatták, hogy ennek oka a lipiddel módosított gyógyszer nagymértékben megnövekedett sejtbe jutása és a CDV-difoszfát, a vírus-DNS-polimerázok aktív inhibitorának magasabb intracelluláris szintje [11]. Hasonló eredményeket figyeltünk meg az (S) -HPMPA HDP-észtereivel HIV-1-fertőzött sejtekben [12,13,14]. Amint azt fentebb megjegyeztük, a CDV-ről beszámoltak, hogy erősen antiproliferatív a méhnyakrák sejtjeivel szemben [1,2,3,4,5]. In vitro tanulmányoztuk az ODE-CDV és számos más CDV analóg hatását a primer fibroblaszt és az emberi méhnyakrák sejtvonalainak szaporodására. Az ODE-CDV több naplóval volt aktívabb a méhnyakrák sejtjeinek szaporodásának gátlásában, mint a CDV, és a méhnyakrák sejtjeivel szemben 2,5–140-szeres szelektivitást mutatott a normális humán fityma fibroblaszt (HFF) sejtekhez képest [1].
Nemrégiben egy másik aciklusos nukleozid-foszfonát, köztük a 9- [2- (foszfonometoxi) -etil] -guanin (PMEG) - HDP- és ODE-észtereit szintetizáltuk, és humán T limfoblasztos leukémia sejtvonalakban teszteltük HIV-1 elleni vírusellenes aktivitását, CEM és MT-2. Az antivirális értékelés részeként in vitro citotoxicitási vizsgálatokat végeztünk, és megfigyeltük, hogy az ODE-PMEG erősen antiproliferatív volt MT-2 sejtekben, 50% -os gátló koncentrációval (IC50) 1 × 10 −7 μM. A CEM-SS sejtekben az IC50 értéke 6x10-5 μM volt [15]. Noha az ODE-PMEG a HIV-1-fertőzött sejtekben nagyon aktívnak tűnt, a szelektivitási index nagyon alacsony volt, és arra a következtetésre jutottak, hogy a látszólagos vírusellenes hatás az ODE-PMEG markáns antiproliferatív hatásával magyarázható [15]. Annak megállapítására, hogy ezek a megállapítások kiterjednek-e gyorsan osztódó humán méhnyakrákos sejtekre, a nem módosított PMEG, HDP-PMEG és ODE-PMEG antiproliferatív aktivitását értékeltük három humán méhnyakrákos sejtvonalban (CaSki, Me-180 és HeLa, valamint normál HFF-ben). sejtek. Végül Me-180 méhnyakrákos sejteket ültettünk az atlikus meztelen egerek oldalába, hagytuk, hogy szilárd daganatok képződjenek, és értékeltük az ODE-CDV és az ODE-PMEG helyi injekcióinak tumorellenes hatásait in vivo.
Anyagok és metódusok
A PMEG alkoxi-alkil-észtereinek szintézise
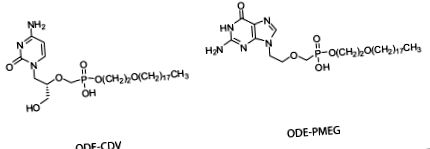
A HDP-PMEG-t és az ODE-PMEG-et szintetizáltuk, tisztítottuk és jellemeztük a korábban leírtak szerint [15]. A HDP-CDV és az ODE-CDV szintéziséről és értékeléséről korábban beszámoltunk [7,14]. Az ebben a vizsgálatban alkalmazott vegyületek tisztaságát> 98% -ban értékelték. Ezeknek a vegyületeknek a protonmagmágneses rezonancia és tömegspektroszkópia adatairól korábban beszámoltunk [7,10,15]. Az ODE-CDV és az ODE-PMEG szerkezete az 1. ábrán látható .
Az ODE-CDV és az ODE-PMEG szerkezete.
Sejtvonalak és sejttenyészet
A normál HFF-sejteket (CRL-1634, Hs27) az American Type Culture Collection-től (Manassas, Va., USA) szereztük be, és 10% magzati szarvasmarha-szérumot tartalmazó minimális esszenciális tápközegben tartottuk (Gibco, Grand Island, N.Y., USA). A HPV 16., 68. és 18. altípushoz, a CaSki (CRL-1550), a Me-180 (HTB-33) és a HeLa (CCL-2) társított méhnyakrákos sejtvonalakat szintén az American Type Culture Collection-ből szereztük be, és McCoy's-ban tartottuk fenn. 5A közepes vagy minimum esszenciális táptalaj, amely 10% szarvasmarha-magzat szérumot tartalmaz [1].
Sejtproliferációs vizsgálatok
A sejtvonalakat lyukanként 5 × 103 arányban 96 lyukú lemezekre szélesztettük, 10% fetális marha-magzati szérum hozzáadásával és kb. 24 órán át inkubáltuk a korábbiakban leírtak szerint [1]. 10 mM PMEG törzsoldatot készítettünk vízben; 10 mM HDP-PMEG és ODE-PMEG törzseket készítettünk 10% DMSO-ban desztillált vízben. A gyógyszeres sorozatos hígításokat 2% szarvasmarha-magzati szérumot tartalmazó táptalajban végeztük, így 6% -os marha-magzati szérum végkoncentrációt kaptunk, hozzáadtuk a mélyedésekhez, és 37 ° C-on inkubáltuk 5 napig. A sejtproliferáció meghatározását XTT sejtproliferációs készlet II segítségével végeztük a gyártó utasításai szerint (Roche Molecular Biochemicals, Mannheim, Németország). Röviden, a reagenseket összekevertük és hozzáadtuk a mélyedésekhez, majd rázógépre helyeztük 15 percig, majd 37 ° C-on inkubáltuk körülbelül 30 percig. Az OD450-et ELISA lemezolvasóval (Biotek Instruments, Winooski, Vt., USA) határoztuk meg. Az adatokat ábrázoltuk, és az IC50 értéket grafikus szoftverrel értékeltük (Prizm, GraphPad Software, San Diego, Kalifornia, USA).
Me-180 daganatok Athymic meztelen egerekben
A nőstény atlétikai meztelen Balb/c egereket (Charles River) szubkután 5 x 106 Me-180 méhnyakrákos sejtekkel injektáltuk. A daganatoknak 14 napig hagyták létrejöttüket. Ezután féknyergekkel daganatméréseket végeztek a tumor két dimenziójának milliméterben történő mérésére. Ezeket a dimenziókat megsokszoroztuk a daganat teljes térfogatának értékelése céljából. A kiindulási daganatmennyiség kb. 30–35 mm volt. Ezután az egereket három, egyenként 8 egérből álló csoportba randomizáltuk, és 0,9% -os fiziológiás sóoldat vagy az ODE-CDV vagy az ODE-PMEG dózisainak intratumor injekciójával kezeltük. Az intratumor injekció térfogata 50 μl volt. A daganat méretét és a testtömegét hetente háromszor végeztük a megadott időpontokban. Az ODE-CDV kísérletek során a daganatot hordozó egereket intratumorális injekcióval adagolták 50 μg (2 mg/kg) vagy 100 μg (4 mg/kg) adagolással 21 napig. A testtömeget és a tumor méretét hetente háromszor, a 21. napig értékeltük. A kezelés leállítása után az állatokat az 56. napig tartottuk, amikor a tumor méretét újraértékeltük (2. ábra. 2. ábra). Az ODE-PMEG-vel végzett kísérletek során az állatokat 25 μg (1 mg/kg) vagy 12,5 μg (0,5 mg/kg) ODE-PMEG intratumorális injekcióval adagolták, amint azt 21 napig jelezték, míg a kontroll egerek 0,9% -os sóoldatot kaptak . A daganat méretét hetente háromszor mértük 40 napig (3. ábra (3. ábra).
Az ODE-CDV napi 21 napos intratumorális injekcióinak hatása a Me-180 tumorokra in vivo.
Az ODE-PMEG 21 napos napi vagy minden másnapi intratumorális injekciójának hatása Me-180 szilárd tumorokra inaktív meztelen egerekben in vivo.
Eredmények
A PMEG antiproliferatív aktivitását 5 napos expozíció után értékeltük primer HFF sejtekben és 3 humán méhnyakrákos sejtvonalban az XTT sejtproliferációs teszt és az IC50 felhasználásával, és összehasonlítottuk a HDP-PMEG és az ODE-PMEG-vel (1. táblázat (1. táblázat) 1. A legtöbb méhnyakrákos sejtvonalban a HDP-PMEG és az ODE-PMEG 600–400 000-szer nagyobb mértékben volt gátló, mint a módosítatlan PMEG. Kivételt láttak a HDP-PMEG esetében a Me-180 sejtekben. Normál HFF sejtekben az antiproliferatív aktivitás kisebb, 3-9-szeres növekedését figyelték meg a HDP-PMEG és az ODE-PMEG esetében, szemben a méhnyakrákos sejtvonalakban tapasztalt nagyon alacsony IC50 értékekkel.
Asztal 1
A PMEG, HDP-PMEG és ODE-PMEG antiproliferatív aktivitása primer HFF sejtekben, valamint CaSKi, Me-180 és HeLa méhnyakrákos sejtekben in vitro
| Elsődleges HFF sejtek | |||
| PMEG | 45 ± 42 (2) | - | - |
| HDP-PMEG | 18 ± 21 (3) | 2.5 | - |
| ODE-PMEG | 5,0 ± 1,7 (3) | 9.0 | - |
| CaSki sejtek (HPV 16) | |||
| PMEG | 18 ± 3,2 (3) | - | 2.5 |
| HDP-PMEG | 0,027 ± 0,01 (3) | 667 | 667 |
| ODE-PMEG | 0,002 ± 0,003 (6) | 9000 | 2500 |
| Me-180 sejtek (HPV 68) | |||
| PMEG | 9,3 ± 2,5 (3) | - | 4.8 |
| HDP-PMEG | 11,4 ± 6,9 (3) | 0.8 | 1.6 |
| ODE-PMEG | 0,002 ± 0,003 (3) | 4,650 | 2500 |
| HeLa sejtek (HPV 18) | |||
| PMEG | 14,4 ± 11,5 (4) | - | 3.1 |
| HDP-PMEG | 5 × 10 −4 ± 5 × 10 −4 (4) | 28,800 | 36 000 |
| ODE-PMEG | 3,5 × 10 −5 ± 1 × 10 −4 (3) | 411 000 | 143 000 |
Az IC50 50% -kal csökkenti az életképes sejtek számát az XTT sejtproliferációs vizsgálatban. Az IC50 adatok átlag ± SD. A zárójelben lévő számok az ismétlések számát jelentik. A különféle gyógyszerek szelektivitása a rákos sejtekkel szemben az elsődleges HFF sejtekkel szemben (szelektivitás = IC50 HFF/IC50 rákos sejt). A hajtáskülönbség az antiproliferatív aktivitás többszörös növekedése a módosítatlan nukleotid gyógyszerrel szemben.
Összehasonlítottuk az ODE-PMEG antiproliferatív aktivitását a HFF sejtekben és a méhnyakrákos sejtvonalakban korábban ODE-CDV esetében jelentettekkel [1]. Az elsődleges HFF sejtekben az ODE-CDV és az ODE-PMEG összehasonlítható IC50-értéke 4,2 és 5,0 μM volt (táblázat (2. táblázat) .2). Humán méhnyakrákos sejtekben azonban in vitro az ODE-PMEG lényegesen gátlóbb volt, mint az ODE-CDV: 850-szer nagyobb a CaSki-sejtekben, 195-szer nagyobb a Me-180-ban és 857-szer nagyobb a HeLa-sejtekben (táblázat ( táblázat2). 2). Az ODE-PMEG volt a legaktívabb vegyület, amelynek IC50 értéke a méhnyakrákos sejtekben 0,035 és 2 nM között változott (2. táblázat). Ez az emberi méhnyakrákos sejtek ODE-PMEG általi preferenciális proliferációs gátlását jelenti> 2500-nál nagyobb mértékben, szemben az elsődleges HFF sejtek IC50-értékeivel.
2. táblázat
Az ODE-CDV és az ODE-PMEG antiproliferatív hatásainak összehasonlítása az elsődleges HFF sejtekben és az emberi méhnyakrákos sejtvonalak CaSki, Me-180 és HeLa
| CDV | 853 | 910 | 627 | 516 |
| ODE-CDV | 4.2 | 1.7 | 0,39 | 0,03 |
| PMEG | 45,0 | 18.0 | 9.3 | 14.4 |
| ODE-PMEG | 5.0 | 0,002 | 0,002 | 3,5 × 10 −5 |
A CDV és az ODE-CDV adatok a Hostetler et al. [1]. A PMEG és az ODE-PMEG adatok az 1 1 táblázattól származnak .
Vita
Az olyan ciklikus nukleozid-foszfonátok, mint a CDV, (S) -HPMPA és a PMEG korlátozott sejtfelvételt tartalmaznak, és a HDP és ODE csoportokkal végzett észterezés korlátozottan kimutatták, hogy az in vitro több mint százszorosára növeli a sejtfelvételt [11,13,14]. Először 2006-ban számoltunk be az ODE-PMEG szintéziséről, annak a felmérésnek a részeként, hogy az aciklusos nukleozid-foszfonátok alkoxi-alkil-észterei képesek gátolni a HIV-1 replikációt a fertőzött sejtekben [15]. Az ODE-PMEG erősen citotoxikus volt az MT-2 limfoblasztos T-sejtekben, IC50 értéke −7 μM, míg a módosítatlan PMEG legalább 1000-szer kevesebb citotoxikus volt [15]. Az ODE-PMEG IC50 értéke a CEM-SS sejtekben, egy humán T-sejt leukémia vonalban, 6x10-5 μM volt; Korábban a PMEG IC50 értéke 0,7 μM volt a CEM-SS sejtekben [16]. Így az ODE-PMEG in vitro in vitro CEM-SS sejtekben több mint 1000-szer antiproliferatívabb, mint a PMEG.
Korábban beszámoltunk arról, hogy az emberi méhnyakrák sejtvonalainak paneljén az ODE-CDV sokszor antiproliferatívabb volt, mint a módosítatlan CDV [1]. Ebben a jelentésben összehasonlítottuk az ODE-CDV-t és az ODE-PMEG-et számos emberi méhnyakrákos sejtvonallal (1. táblázat (1. táblázat) 1), és megállapítottuk, hogy ezek nagymértékben gátolják a méhnyakrák sejtjeinek szaporodását. Az ODE-PMEG szignifikánsan aktívabb volt, mint az ODE-CDV, 195-szeresére a Me-180 méhnyakrákos sejtekben (2. táblázat). Az athéni meztelen egerekben az ODE-PMEG aktivitása Me-180 szilárd daganatokban is nagyobb volt, mint az ODE-CDV.
A tumorellenes aktivitás mechanizmusát tekintve a PMEG bizonyult a legaktívabbnak az aciklusos nukleozid-foszfonátok közül, amelyek in vitro szaporodásgátló hatást váltanak ki a CEM-SS humán limfocita leukémia sejtekben [16], és bebizonyosodott, hogy hatékony az intraperitoneális P338 leukémia ellen. egerek [17]. A PMEG anabolikus foszforilezéssel metabolizálódik PMEG-difoszfáttá (PMEGpp), amely az α és δ [18] és a polimeráz ∊ [19] humán polimerázok hatékony inhibitora. A PMEG beépülhet a DNS-be és kötelező láncterminátorként funkcionál; csak a polymer polimeráz képes megjavítani a PMEG-végű láncot [19].
A GS-9219 egy prodrug, amely intracellulárisan előidézi a PMEGpp-t. Krónikus limfocita leukémia sejtekben a PMEGpp beépül a DNS-be az ultraibolya aktivációra reagálva, gátolja a DNS-helyreállítást, és szálszakadáshoz és apoptózishoz vezet [20]. A PMEGpp ezen hatásait feltételezzük a tumorellenes aktivitás alapjaként [18,19,20]. Wolfgang és mtsai. [21] nemrégiben beszámoltak méhnyakrákos sejteken végzett vizsgálatokról a GS-9191-gyel, egy olyan prodrugmal, amely intracellulárisan PMEG-t eredményez az izopropil-fenil-alanil-védőcsoportok hidrolízise után a foszfonáton, majd ezt követően PMEG-gyé dezaminálják. A PMEG anabolikus foszforilezéssel PMEGpp-vé alakul át, aktív metabolittá. A GS-9191 gátolta a különböző emberi méhnyakrákos sejtvonalak szaporodását, IC50-értékei 0,03 és 284 nM között mozogtak [21].
3. táblázat
Az ODE-PMEG és a GS-9191 antiproliferatív aktivitásának összehasonlítása méhnyakrákos sejtvonalakban in vitro
- 6 Accutane mellékhatás, ami velem történt
- 6 gyakori zsírégető mellékhatás, amelyről tisztában kell lennie! Valós
- 6 gyakori Paxil mellékhatás, amelyekről tudnia kell
- Béta-karotin felhasználás, mellékhatások, kölcsönhatások, adagolás és figyelmeztetés
- A béta-karotin előnyei, mellékhatásai, adagolása és kölcsönhatásai