Az orálisan beadott nátrium-benzoát és nátrium-fenil-butirát hatékonysága veleszületett portoszisztémás söntű kutyáknál
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Levelezés
Giora van Straten, Kísérő állatok klinikai tudományok tanszéke, Utrechti Egyetem Állatorvostudományi Kar, Yalelaan 8, 3508 TD Utrecht 80154, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Gyógyszerészeti tanszék, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Gyógyszerészeti tanszék, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Levelezés
Giora van Straten, Kísérő állatok klinikai tudományok tanszéke, Utrechti Egyetem Állatorvostudományi Kar, Yalelaan 8, 3508 TD Utrecht 80154, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Gyógyszerészeti tanszék, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Kísérő állatok klinikai tudományok tanszéke, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Gyógyszerészeti tanszék, Állatorvostudományi Kar, Utrechti Egyetem, Utrecht, Hollandia
Absztrakt
Háttér
A hiperammonémia máj encephalopathiát eredményezhet, amely súlyos esetekben végül kómához és halálhoz vezethet. Kutyáknál a veleszületett portoszisztémás shuntok (CPSS) a hyperammonemia leggyakoribb okai. A konzervatív kezelés fehérjével módosított étrendből, nem felszívódó diszacharidokból, antibiotikumokból vagy ezek egyes kombinációiból áll. A nátrium-benzoátot (SB) és a nátrium-fenil-butirátot (SPB) mind az emberek karbamid-ciklus enzimhiányai által okozott hiperammonémiában szenvedő emberek akut és hosszú távú kezelésében használják. Úgy gondolják, hogy mindkét kezelés csökkenti a vér ammónia-koncentrációját azáltal, hogy alternatív utakon elősegíti a felesleges nitrogén kiválasztódását.
Célkitűzések
Az SB-vel és SPB-vel végzett PO-kezelés hatékonyságának és biztonságosságának értékelése a hyperammonemia és a CPSS kutyák klinikai tünetei tekintetében.
Mód
Véletlenszerű, kettős-vak, placebo-kontrollos crossover vizsgálat. A vér ammóniájának és az epesavak koncentrációját CPSS kutyákban mértük SB, SPB és placebo ötnapos kezelés előtt és után. A kezelések között 3 napos mosási időszakot alkalmaztunk. Standard kérdőívet dolgoztak ki és osztottak ki a tulajdonosoknak a klinikai tünetek értékelésére minden kezelés előtt és után.
Eredmények
A vér ammónia koncentrációját egyik kezelés sem befolyásolta, és összehasonlítható volt a placebo kezelés során megfigyeltekkel. Ezenkívül az SB és SPB kezelés nem eredményezte a klinikai tünetek javulását. A kezelés során jelentkező káros hatások közé tartoztak az étvágytalanság, hányás és letargia.
Következtetések és klinikai jelentőség
Eredményeink alapján arra a következtetésre jutunk, hogy az SB vagy az SPB nem alkalmazható a hyperamponemia konzervatív kezelésében CPSS-ben szenvedő kutyáknál.
Rövidítések
1. BEMUTATKOZÁS
Az ammónia kulcsfontosságú tényező a hepatikus encephalopathia (HE), 1-4 szindróma patogenezisében, amely neurodegeneratív szövődmények széles spektrumát öleli fel, és súlyos esetekben akár kómához és halálhoz is vezethet. Az ammónia-méregtelenítés tehát elengedhetetlen a homeosztázis fenntartásához, és főleg az ammónia karbamidokká történő átalakításával megy végbe a máj karbamid-ciklusa és a glutamin szintézise révén. 6.
A kutyáknál a hyperammonemia többnyire másodlagos a veleszületett portoszisztémás shuntok (CPSS) miatt. 7-9 Ezek a CPSS vaszkuláris rendellenességek, amelyek összekapcsolják a portális vénát a szisztémás keringéssel, megkerülve ezzel a máj szinuszoidjait. Ennek eredményeként a kapu vénájából a máj parenchymáján keresztüli véráramlás> 95% -kal csökkenhet, 11 bélfelszívódási termékeket (pl. NH3) közvetlenül a szisztémás keringésbe visz. Ez az ureagenesis csökkenését eredményezi és hyperammonemiát okoz. 11 A karbamidciklus enzimek csökkent expressziója, amelyről bebizonyosodott, hogy a CPSS kutyáknál fordul elő, 12 szerepet játszhat az érintett kutyák hyperammonemia patogenezisében is.
A sönt műtéti lezárását a CPSS ideális kezelésének tekintik, és kimutatták, hogy jelentősen hosszabb túlélési időt eredményez, mint a konzervatívan kezelt CPSS-ben szenvedő kutyáknál. 13 Konzervatív irányításra van szükség, ha a műtéti beavatkozás után nem érhető el a teljes sönt bezárása, amikor a műtét orvosilag ellenjavallt, és pénzügyi korlátok esetén. Az ajánlott konzervatív kezelés célja az ammóniatermelés és a gyomor-bél traktus felszívódásának csökkentése. A javasolt kezelések növényi fehérjéből vagy fehérje-korlátozott étrendből állnak, orvosi beavatkozásokkal kombinálva, például nem felszívódó diszacharidok (pl. Laktulóz), antibiotikumok (pl. Neomicin és metronidazol) vagy mindkettő kombinációjával. 14
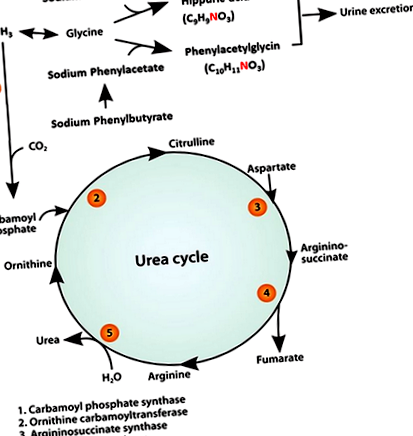
Hosszú évek óta IV-nátrium-benzoátot (SB) és nátrium-fenil-acetátot (SPA) ajánlanak a hiperammonémia és a HE akut kezelésére karbamid ciklus enzimhiányos (UCED) humán betegeknél. Mind az SB, mind az SPA csökkentette a vér ammónia koncentrációját azáltal, hogy alternatív utakat biztosított a nitrogén kiválasztására 15-17 (1. ábra). Kutyáknál a benzoát és a fenilacetát konjugálódik a glicinnel, hogy hippursavat (HA) és fenilacetil-glicint (PAG) képezzen. 18-20 Mind a HA, mind a PAG a vesén keresztül ürül, ezáltal mindegyik 1 mól nitrogén eltávolítja minden beadott SB és SPA minden mólját. 21, 22
Egy nemrégiben készült tanulmányban 18 értékelték az IV SB és SPA hatékonyságát és biztonságosságát egészséges és CPSS kutyáknál. Az SB és az SPA eliminációs felezési ideje 2,7, illetve 2,4 óra volt. 18 Ezek az értékek hasonlóak az embereknél jelentett értékekhez. Mindkét kezelésnek csak enyhe káros hatása volt. A kezelések azonban csak olyan hatékonyak voltak, mint a placebo-kezelés (azaz 0,9% NaCl) az ammónium koncentrációjának csökkenésében, ha intramuszkuláris bolusként alkalmazzák a hyperammonemia kezelésében.
Lehetséges, hogy hosszantartó kezelésre lehet szükség az ammónia koncentrációjának csökkentésében mutatott hatékonyság bizonyításához. PO kezelésre (azaz krónikus hyperammonemia kezelésére) a pro-drug nátrium-fenil-butirátot (SPB) alkalmazták. A nátrium-fenil-butirát gyorsan fenil-acetáttá oxidálódik (1. ábra), és annak az előnye, hogy hiányzik a SPA kellemetlen szaga, miközben fenntartja a nitrogén eltávolító hatékonyságát. 24 Célunk volt az SB-vel és SPB-vel végzett monoterápia hatékonyságának és biztonságosságának értékelése a hyperammonemia és a klinikai tünetek kezelésében CPSS kutyáknál.
2 ÁLLATOK ÉS MÓDSZEREK
2.1 Állatok
A vizsgált populáció az Utrechti Egyetem Kísérő Állatok Klinikai Tudományok Osztályára utalt kutyákból állt, amelyben a CPSS végleges diagnózisát felállították. A felvételi kritériumok a CPSS megerősített diagnózisa voltak a vér ammónia (referenciaintervallum, 15-45 μmol/L) és az epesav-koncentrációk (referenciaintervallum, 0-10 μmol/L) és a sönt vizualizálása ultrahanggal, kontraszt alapján. számítógépes tomográfia, vagy mindkettő. A kutyákat kizártuk a vizsgálatból, amikor a CPSS végleges diagnosztizálása nem volt lehetséges, amikor a vér ammónia koncentrációja volt
2.2 Tanulmányterv
2.3 Gyógyszerkészítés
A placebót és az SB 500 mg-ot a holland Utrechti Egyetem Állatorvos-tudományi Karának gyógyszertárában gyártották. 0 kapszula, amely csak mikrokristályos cellulózt (Bufa, Haarlem, Hollandia) tartalmaz, vagy SB-t (Bufa) és mikrokristályos cellulózt tartalmaz. Az SPB 500 mg-os kapszulák (GMP gyógyszertár Mierlo-Hout, Helmond, Hollandia) azonos méretűek, de fehérek voltak, segédanyagként trikalcium-foszfátot, magnézium-sztearátot és szilícium-dioxidot is tartalmaztak. Bár ezeknek a kapszuláknak kissé eltérõ volt a megjelenése, a tulajdonosok és a nyomozók nem tudták, hogy a kapszulák melyik anyagot tartalmazzák. Az összes kezelést hetente adták ki a gyógyszerként a megfelelő gyógyszerként az egyéni dózisban, a próba gyógyszeres kezeléssel és az adagolási utasításokkal, a beteg nevével és a tantárgy számával. A gyógyszerek kiadását a gyógyszertárban ellenőrizték, a visszaküldött palackokat a kutatók összegyűjtötték, és ellenőrizték a fel nem használt kapszulákat.
2.4 Vérminta és elemzés
Az ammónia és az epesav koncentrációjának meghatározásához vénás vérmintákat gyűjtöttünk a kezelés megkezdése előtt (azaz az előkezelés koncentrációi) és az 5 napos kezelési időszak végén minden beadott anyagra (azaz a kezelés utáni koncentrációkra). Vért vettünk a nyaki vénából az etetés után 2 és 4 órával. Az ammónia méréséhez a vért azonnal jéghűtött nátrium-etilén-diamin-tetraecetsavval (NaEDTA) bevont csövekbe helyezték. Az ammónia mérését a vérmintavételt követően 10 percen belül végeztük mikrodiffúziós módszerrel, PocketChem (Menarini Benelux BV, Valkenswaard, Hollandia) alkalmazásával. Az epesav-koncentrációkat meghatározták a máj működésének értékelésére a kezelés alatt, és annak kizárására, hogy a vér ammónia-koncentrációjának potenciális csökkenése a jobb májműködés következménye lehet. Az epesav méréséhez a vért 1,3 ml-es heparinnal bevont csövekbe helyezték. Az epesavakat UniCel DxC 600 esszével határoztuk meg (Beckman Coulter Nederland BV, Woerden, Hollandia).
2.5 Pontozási rendszer
A kezelések hatékonyságát a klinikai tünetek javulásával is értékelték. Ennek érdekében kidolgoztak egy szabványos kérdőívet, amelyet a tulajdonosok elé terjesztettek a klinikai tünetek értékelésére minden kezelés előtt és után. A kérdések célja a neurológiai tünetek (pl. Csökkent tudatszint, gyengeség, csökkent állóképesség, csökkent játékkedv, csökkent interakció más kutyákkal, görcsök, ataxia, dezorientáció, fejpréselés, körözés, látszólagos vakság, agresszió), emésztőrendszeri tünetek ( pl. anorexia, hányás, hasmenés) és urológiai tünetek (pl. polyuria, polydipsia, dysuria, hematuria). Az egyes klinikai tünetek pontozásához 0 és 4 közötti skálát használtunk. A 0 pontszám azt jelentette, hogy a jel egyáltalán nem volt látható abban az időszakban. Az 1-es pontszámot akkor kapták, amikor egyszer egy jelet láttak, a 2-es értéket, ha a jelet> 2-szer látták, de nem minden nap, a 3-as értéket, amikor a jelet naponta látták, és 4-et, amikor a jelet látták jelen van> napi 1 alkalommal. A polyuria és a polydipsia 0, 2 vagy 4 pontot kapott, ami normális, a normálistól kissé több, és a normálisnál jóval több. Az állóképességet és a játékra, valamint a más kutyákkal való kapcsolattartásra való hajlandóságot 0, 2 vagy 4 értékre osztották, 0 jelentése normális, 2 kevesebb és 4 hiánya.
2.6 Statisztikai elemzés
Miután a vérkémiai adatokat a Kolmogorov-Smirnov Z-teszttel megvizsgáltuk a normalitás szempontjából, parametrikus teszteket használtunk a csoportok közötti különbségek értékelésére. Kruskal ‐ Wallis tesztet alkalmaztak a kezelés kezdete közötti különbségek értékelésére. Az egyirányú varianciaanalízist (ANOVA) ismételt mérésekhez alkalmazták az átvitt hatások jelenlétének és a kezelések közötti különbségek teszteléséhez. Post hoc módon a különbség páronkénti összehasonlítását Tukey-teszt segítségével végeztük el. Az ismételt mérésekhez használt Wilcoxon jelölt rangú tesztet alkalmazták a pontozási rendszerek különbségeinek tesztelésére. P-Értékek
3 EREDMÉNYEK
Tíz kutyát (5 hímet és 5 nőstényt) vontak be a vizsgálatba, koruk 3 hónaptól 10 évig terjedt, súlyuk 1,5-36 kg volt. A 10 kutya között volt 1 Nova Scotia Duck Tolling Retriever, 1 Doberman, 2 Chihuahuas, 1 Cairn Terrier, 1 Miniatűr Schnauzer, 1 Weimaraner, 1 Bernese Mountain Dog, 1 Yorkshire Terrier és 1 közepes méretű keresztezett kutya. Kilenc kutya teljesítette az összes kezelést. Az egyik kutyánál paraparesis alakult ki discospondylitis miatt, és nem vett részt az SB karon. Az észlelt mellékhatások az anorexia voltak (4 kutya placebóval és 2 kutya SB kezeléssel), hányás (2 kutya placebóval, 3 kutya SPB-vel és 2 kutya SB kezeléssel) és letargia (3 kutya placebo, 1 SPB és 3 az SB kezelésére). Mellékhatásokat észleltek mind a placebo, mind az SB és SPB kezelések során. Minden káros hatás átmeneti volt, és kezelés nélkül megszűnt.
Az ismételt mérésekhez használt egyutas ANOVA-val először meghatározták, hogy van-e átviteli hatás. A teszt megállapította, hogy a kezelések sorrendje nincs hatással a rögzített változók eredményére. Nem találtunk szignifikáns különbséget a plazma epesav és a vér ammónia koncentrációja között az etetés után 2 és 4 órával. Ezért mindkét időpont (az etetés után 2 és 4 óra) átlagát alkalmazták a plazma ammónia- és epesav-koncentrációkra gyakorolt hatásának értékelésére (1. alátámasztó információs táblázat és 1. ábra). A vér ammónia-koncentrációja 60 és 286 μmol/l között mozgott. A kezelés kezdetén nem találtunk szignifikáns különbséget a vér ammónia koncentrációjában a kezelési csoportok között. Nem találtak szignifikáns különbséget a vér ammónia koncentrációjában a placebo, az SPB vagy az SB kezelés előtt és után. Az ammónia koncentrációja a placebo-kezelés előtt és után 164 ± 86 μmol/L, illetve 149 ± 78 μmol/L volt (P = .10). A kezelés előtti és utáni ammónia koncentráció SB kezeléssel 172 ± 58 μmol/L és 187 ± 66 μmol/L (P =, 21) és SPB-kezeléssel 154 ± 74,0 μmol/L és 155 ± 90 μmol/L (P = .64), ill.
Az epesav plazmakoncentrációja 39 és 630 μmol/l között mozgott. A kezelés kezdetén nem találtunk szignifikáns különbséget a plazma epesav-koncentrációiban a kezelési csoportok között. A plazma epesav-koncentrációiban nem találtunk szignifikáns különbséget a kezelések előtt vagy után. A kezelés előtti epesav-koncentráció placebóval 303 ± 152 μmol/L és 264 ± 118 μmol/L volt (P = .08). Az epesav koncentrációja SB-vel a kezelés előtt és után 344 ± 99 μmol/L és 241 ± 85 μmol/L (P =, 37) és SPB-kezeléssel 293 ± 106 μmol/L és 229 ± 86 μmol/L (P = .18), ill. A kezelés előtt kutyákon jelentkező klinikai tünetek a következők voltak: poliuria, polydipsia vagy mindkettő (n = 5), intermittáló rendellenes viselkedés (n = 5), letargia (n = 6), csökkent állóképesség (n = 8), anorexia (n = 6) hányás (n = 6) és ataxia (n = 3). Nem találtunk szignifikáns különbséget a klinikai tünetek pontszámaiban az SB, SPB és a placebo kezelés előtt és után.
4. MEGBESZÉLÉS
Egy placebo-kontrollos, randomizált keresztezett vizsgálatban, amelyben értékelték az IV SB hatékonyságát az akut hiperammonémia kezelésében CPSS kutyákban, 18 vér ammónia koncentrációja szignifikánsan csökkent (kb. 60%) az SB kezelés után. Ugyanakkor ugyanazt a hatást érték el, miután a kutyákat azonos térfogatú 0,9% -os NaCl-oldattal kezelték (azaz placebo kezeléssel), és nem találtak szignifikáns különbséget az ammónia koncentrációiban az SB és a NaCl kezelések között. Ugyanebben a tanulmányban a NaCl beadása egészséges kutyáknak lényegesen alacsonyabb ammónia-koncentrációt eredményezett az SB- és SPA-kezelésekhez képest. A nitrogén alternatív úton történő kiválasztása helyett a térfogat bővülését javasolták az ammónia koncentrációjának csökkenésének lehetséges mechanizmusaként az SB és SPA bolus kezelések után. Az a tény, hogy tanulmányunkban az SB-vel, SPB-vel és a placebóval végzett PO-kezelés után az ammónia-koncentrációkat nem befolyásolta, megerősíti ezt a feltételezést, mivel a PO-kezelésnél a térfogat-bővülés nem következik be.
Az SB és az SPB kezelések biztonságosnak és jól tolerálhatónak bizonyultak minden kutyában. A megfigyelt mellékhatások (pl. Étvágytalanság, hányás és letargia) enyheek, rövid ideig tartottak, és összehasonlíthatók a korábbi kutyákon, 18-as kutyákon, 23, 30, 31-es embereken, valamint placebo-kezelés során jelentettekkel. A hányás, az étvágytalanság és a letargia azonban a kezelés előtt is előfordult a CPSS eredményeként, és a CPSS sikertelen kezelésének következményének tekinthetők.
Összegzésképpen elmondható, hogy az SB és az SPB nem változtatta meg az ammónia koncentrációját ebben a CPSS-ben szenvedő kutyák csoportjában, és nem javította a klinikai tüneteket. Ezért nem javasoljuk ezen anyagok alkalmazását sem monoterápiaként, sem kombinált terápia részeként a hyperammonemia kezelésére CPSS-ben szenvedő kutyáknál.
ÉRDEKLŐDÉSI NYILATKOZAT
A szerzők kijelentik, hogy nincs összeférhetetlenség.
CÍMKÉNYEN KÍVÜLI ANTIMIKROBIÁLIS NYILATKOZAT
A szerzők kijelentik, hogy az antimikrobiális szereket nem engedélyesen használják.
- Orálisan, zúzott vagy egész tabletta formájában beadott vorikonazol farmakokinetikája
- A legmagasabb élelmi rosttartalmú ételek, a legalacsonyabb a nátriumtartalom a reggeli gabonapelyhekben
- Fülfertőzések és otitis externa kutyáknál - kutyatulajdonosok - Merck Veterinary Manual
- Fülfertőzések kutyáknál (Otitis Externa) VCA Állatkórház
- Könnyű, egészséges, alacsony nátriumtartalmú receptek Dr.