Bél metaplázia és gyomor karcinogenezis
Gasztroenterológiai és Hepatológiai Osztály, Orvostudományi és Terápiás Tanszék, Wales Prince Kórház, Hongkongi Kínai Egyetem, Hongkong, Kína
Gasztroenterológiai és Hepatológiai Osztály, Orvostudományi és Terápiás Tanszék, Wales Prince Kórház, Hongkongi Kínai Egyetem, Hongkong, Kína
Gasztroenterológiai és Hepatológiai Osztály, Orvostudományi és Terápiás Osztály, Wales Prince Kórház, Hongkongi Kínai Egyetem, Hong Kong, Kína
Gasztroenterológiai és Hepatológiai Osztály, Orvostudományi és Terápiás Tanszék, Wales Prince Kórház, Hongkongi Kínai Egyetem, Hongkong, Kína
Összegzés
Bevezetés
A gyomorrákról általában úgy gondolják, hogy krónikus gyomorhurutból, atrófiás gyomorhurutból, bélmetapláziából, diszpláziából és ezt követően rákos megbetegedésekből származó többlépcsős progresszióból alakul ki. A gyomor karcinogenezisének ezt a sorozatát, amelyet gyakran Correa-kaszkádnak hívnak, 1 gyakran az indítja Helicobacter pylori fertőzés. Ebben a tekintetben az atrófiás gyomorhurutot és a bélmetapláziát tekintik a gyomorrák előfutárainak, különösen a gyomor rosszindulatú daganatok béltípusa esetében. Azonban nem minden bélmetapláziában szenvedő egyén halad gyomorrákká, és a progressziót meghatározó tényezők ismeretlenek. Ez az áttekintés a gyomor-bél metaplazia etiológiáját, genetikai változásait és lehetséges kezelési lehetőségeit tárgyalja.
A bélmetaplázia szövettana
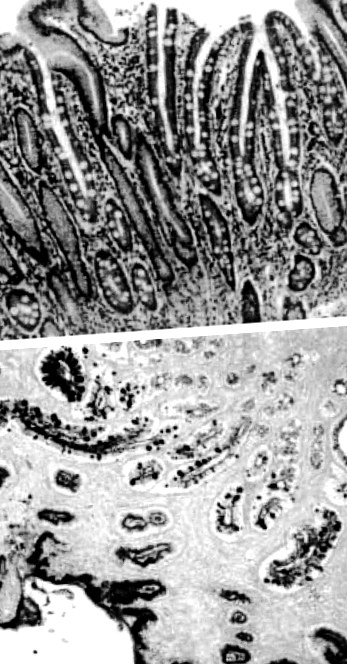
A bél metaplázia a gyomor nyálkahártyájának a vékonybél nyálkahártyájára emlékeztető hámpótlása (1. ábra). A vékonybél nyálkahártyájának felismerése a gyomorban a XIX. 2 A bél metaplázia a gyomor őssejtjeiből származik, amelyek a proliferációból a gyomor specifikus sejtjeibe terelődnek a vékonybél sejtjei felé, például abszorpciós sejtek, serlegsejtek és Paneth sejtek. Ezt általában a gyomor nyálkahártyájának tartós irritációja váltja ki H. pylori a fertőzés a legfontosabb kiváltó tényező.
Gyomor-bél metaplázia kiemelkedő serlegsejtekkel, amelyek a normál gyomor hámját helyettesítik. a) A gyomor-bél metapláziájának haematoxilin- és eozinfoltja. (b) Perjósav – Schiff – Alcian kék folt, kiemelve a serlegsejteket.
Különböző szövettani és hisztokémiai technikák alkalmazásával a bélmetaplázia különböző altípusokba sorolható. Számos osztályozási rendszert alkalmaztak, de a legelterjedtebb Jass & Filipe által javasolt. 3 Ebben a besorolásban a bélmetaplazia teljes és hiányos típusokba sorolható. A teljes típust vagy az I. típust abszorpciós sejtek, Paneth-sejtek és szialomucinokat szekretáló serlegsejtek jelenléte jellemzi, amely megfelel a vékonybél fenotípusának. A hiányos típust, amely magában foglalja a II. És III. Típust, oszlopos és serlegsejtek jelenléte jellemzi, amelyek szialomucinokat és/vagy szulfomucinokat szekretálnak. A II. Típus semleges és savas szialomucinokat választ ki, a III. Típus pedig szulfomucinokat termel. A szulfomucinok megkülönböztethetők a szialomucinoktól magas vas-diamin/Alcian-kék festéssel. A III. Típusú bélmetapláziához kapcsolódó egyéb jellemzők közé tartozik a szembetűnő mirigytorzulás és a Paneth-sejtek hiánya.
Nemrégiben azt tapasztalták, hogy a mucin magfehérjék (MUC) expressziója megváltozik a bél különböző metaplazia típusaiban. Míg a bél metapláziájának minden típusa megmutatkozik de novo a MUC2, 4 expressziója, a MUC1, MUC5AC és MUC6 expressziója a bél metaplázia teljes típusában csökken, de a hiányos típusban megmarad. 5.
A bélmetaplázia és a gyomorrák epidemiológiája
A bélmetaplázia különböző altípusokba sorolása prognosztikai jelentőséggel bír. Retrospektív adatok alapján 6, 7 teljes vagy I. típusú bélmetaplazia alacsony gyomorrák kockázatával jár, míg a III. Típusú (vastagbél) bélmetaplázia a legerősebb kapcsolatban a rákkal. Egy 10 évig tartó szlovéniai nagy kohorszos vizsgálatban a bélmetapláziában szenvedő betegeknél a gyomorrák kockázata összességében tízszeresére nőtt a bélmetaplazia nélküli betegeknél. 7 III. Típusú bélmetapláziában szenvedő betegeknél négyszeresére nőtt a rák kialakulásának kockázata az I. típusú betegekéhez képest. Egy kínai kohorszos vizsgálatban, amelyben több mint 3000 alany vett részt 4–5 éves követéssel, az esély aránya A bélmetapláziától a gyomorrákig terjedő progresszió 17 és 29 között változott. A kockázat különösen magas volt azoknál, akiknél a kezdeti szövettani elváltozások előrehaladottabbak, például diszplázia van. 8 Egy nemrégiben készült japán tanulmányban a bél metapláziából a rákba való progresszió relatív kockázata 6,4 volt (95% konfidencia intervallum, 2,6–16,1). 9.
A gyomorrák kialakulásának kockázata és a bél metaplázia altípusai közötti összefüggés azonban nem általánosan elfogadott. A felszíni endoszkópos biopsziában a bél metaplázia altípusa néha nehéz. Alternatív megoldásként azt javasolták, hogy a bélmetaplázia eloszlása, nem pedig a bélmetaplazia altípus, a rák kockázatának nagyobb prediktív értékkel bírhat. E tekintetben Cassaro et al. kimutatta, hogy a bélmetaplázia, amely a kardiától a pylorusig vagy az egész gyomorig kisebb görbületet tartalmaz, a gyomorrák nagyobb kockázatával társult, mint a fokális vagy antral-domináns bélmetaplázia. 11 Ráadásul észrevették, hogy a hiányos típusú metaplázia jelenléte korrelál a gyomor bélmetapláziájának mértékével.
A bélmetaplázia etiológiája
A bélmetaplázia megjelenése a gyomor nyálkahártyájában feltehetően egy adaptív válasz és a kedvezőtlen környezetre adott reakció eredményeként kialakuló szelekciós nyomás eredménye. 12. H. pylori a fertőzés, a dohányzás és a magas sótartalom gyakran etiológiai tényezőként szerepel. Mindazonáltal az ilyen fenotípusos változásokhoz vezető mechanizmusok továbbra is vitatottak.
Aligha kétséges, hogy krónikus H. pylori a fertőzés a legfontosabb etiológiai ágens a bélmetaplázia kialakulásában. Másrészről, H.pylori a fertőzés okozati összefüggésben van a peptikus fekélyek kialakulásával. Jól ismert, hogy a nyombélfekélyben szenvedő betegeknél kisebb a gyomorrák kialakulásának kockázata. 9, 13 Ugyanezen a vonalon keresztmetszeti vizsgálat során azt találták, hogy a nyombélfekély-betegségben szenvedőknél kisebb volt a bélmetaplázia és a mirigy atrófiája. 14 Így, H. pylori Úgy tűnik, hogy a fertőzés két eltérő klinikai kimenetet eredményez, nevezetesen a nyombélfekély vagy a gyomorfekély/rák. Ezek az eltérő fertőzésre adott klinikai eredmények összeegyeztethetők a topográfiai eloszlás megértésével H. pylori-Társított gyomorhurut. A nyombélfekélyes betegeket az antral-domináns, nem atrófiás típusú gyomorhurut jellemzi, míg a gyomorrákos betegeknél általában multifokális vagy kiterjedt corpus atrophiás gastritis alakul ki. Ennek ellenére a két fenotípusos jellemzőhöz vezető pontos ok továbbra is megfoghatatlan.
Sejtes kinetikai változások a bél metapláziájában
A sejtkinetika megzavarása fontos szerepet játszik a rák kialakulásában. Az apoptózis gátlása és/vagy a fokozott proliferáció a sejtek felhalmozódásához és a neoplazmák kialakulásához vezet. H. pylori a fertőzés celluláris apoptózist és proliferációt indukál a normál gyomorhámban. 21-23 Ezt a változást megfordítja a H. pylori fertőzés. Nemrégiben azonban bebizonyítottuk, hogy az apoptotikus index jelentősen gyengült H. pylori- társult bélmetaplázia. 24 Míg a proliferáció mind a bélmetapláziában, mind a nem bélmetapláziában megnövekedett, az előbbiben az apoptózis szintje szignifikánsan alacsonyabb volt. Így az apoptotikus index/proliferációs index aránya jelentősen csökkent a bél metapláziájában, elősegítve a sejtek felhalmozódását és esetleg a neoplazma kialakulását.
Genetikai változások a bél metapláziájában
A gyomor-bél metaplázia sejtkinetikájának egyensúlyhiánya genetikai és epigenetikai változásoknak tudható be. Mutáció p53 az egyik leggyakoribb genetikai változás az emberi rákban, beleértve a gyomorrákot is. Shiao et al. 12 gyomorrákos esetet vizsgált meg és jelentett p53 mutációk a szomszédos bélmetaplázia 50% -ában. 25 Eltekintve a p53 gén, a p53 mutáns hosszú felezési ideje miatt immunhisztokémiai úton is kimutatható. Immunhisztokémiai technikák alkalmazásával kimutatták a p53 fehérjék felhalmozódását a bél metapláziájában, különösen a III. 26.
A gyomorrákos sejtek a növekedési faktorok és a citokinek széles spektrumát fejezik ki. Ezek közül transzformáló növekedési faktor-α és epidermális növekedési faktor-I receptorokról beszámoltak pre-neoplasztikus gyomor elváltozások esetén. Filipe et al. immunhisztokémiai módszerrel és western blot módszerrel megnövekedett expressziót talált a két növekedési faktor expressziójára a gyomorrákos betegek bélmetapláziájában. 36 A ciklinek, a ciklintől függő kinázok és inhibitoraik szabályozzák a sejtek növekedését, differenciálódását, túlélését és sejthalálát. Nemrégiben kimutattuk, hogy a ciklin D2 túlzott expresszióját és a csökkent p27 expressziót észlelik H. pylori-Társított bélmetaplázia 37 (2. ábra). Nevezetesen, ezeket az aberráló kifejezéseket a H. pylori felszámolása.
A többlépcsős gyomor karcinogenezis útja. Helicobacter pylori a fertőzés vélhetően kiváltja ezt a kaszkádot. A gyomor karcinogenezisének különböző szakaszaiban kimutatott genetikai és epigenetikai változásokat mutatjuk be. COX-2, ciklo-oxigenáz-2; EGFR, epidermális növekedési faktor receptor; MSI, mikroszatellit instabilitás; TGF, átalakító növekedési faktor.
Szükség van-e felügyeletre?
A Barrett-nyelőcsőtől és a vastagbél adenomától eltérően nincsenek útmutatások a gyomor-bél metaplazia felügyeletére. A felügyeleti programok potenciális hasznát még be kell bizonyítani. Ezt tovább bonyolítja a különböző földrajzi régiókban előforduló változó gyomorrák előfordulása, ami megnehezíti az ajánlások megfogalmazását. Ezenkívül a gyomor-bél metapláziáját nehéz lehet endoszkóposan felismerni, összehasonlítva a malignus pre-malignus oesophagealis és vastagbél elváltozásokkal (3. ábra). Még a kromoendoszkópos technikával is, pl. metilénkék (metiltioninium-klorid) vagy indigokarmin alkalmazásával a bél metapláziájának azonosítása a gyomorban nehéz lehet. 38
Az extenzív bélmetaplázia endoszkópos megjelenése a szögletes incisurában.
Bár a nem rákos gyomorban a bélmetaplazia diagnosztizálása és felügyelete nehéz lehet, úgy tűnik, hogy a korai rák diagnosztizálása olyan betegeknél, akikről ismert, hogy bélmetapláziában szenvednek, más kérdés. Az Egyesült Királyság nemrégiben készített jelentésében 39 kiderült, hogy az éves endoszkópos megfigyelés a legtöbb új gyomorrákot korai stádiumban képes felismerni. A gyomorrák megfigyeléssel kimutatott 5 éves túlélése szignifikánsan magasabb volt, mint a nyílt hozzáférésű endoszkópián (50% vs. 10%). Ezek az ígéretes eredmények támogatják a strukturált szűrés végrehajtását azokban az egyénekben, akiknek bélmetapláziában vannak kockázata a rákká válás. Mindazonáltal a legtöbb fejlett országban, amely potenciálisan biztosíthatja az infrastruktúrát a gyomorrák endoszkópos megfigyeléséhez, a betegség előfordulása valószínűleg annyira csökkent, hogy bármely szűrési programot nehéz igazolni.
A bél metapláziája reverzibilis?
| Van der Hulst et al. 41 | Hollandia | 155 (122 cagA+ vs. 33 cagA-) | Ellenőrizetlen | 12. | Nincs változás (ettől függetlenül) cagA állapot) |
| Ohkusa et al. 44. | Japán | 163. (115 H. pylori- 46-os sikertelen felszámolás) | Ellenőrizetlen | 12. | Az IM 28/46-ban javult |
| Uemura et al. 40 | Japán | 132 korai gyomorrák | Nem randomizált (65 kiirtott és 67 nem felszámolt) | 6. | Jelentős javulás az antrumban (1,3-ről 0,9-re) és a korpuszban (0,7-ről 0,46-ra) |
| Énekelte et al. 43 | Kína | 587 | Véletlenszerű kontroll (felszámolás vs. placebo) | 12. | Nincs változás |
| Correa et al. 42 | Kolumbia | 976 (631 befejezett próba) | Randomizált kontroll (nyolc kezelési csoport) | 72 | RR regresszió esetén = 3,1 (1,0–9,3) |
Egy kis, randomizált vizsgálat során kiderült, hogy a betegek 6 hónap aszkorbinsavat kaptak H. pylori az eradikáció a bélmetaplázia jelentős javulását mutatta a placebóval kezeltekhez képest. 47 Eltekintve H. pylori felszámolás és vitaminpótlás, egy másik vonzó kemo-megelőző szer a nem szteroid gyulladáscsökkentők (NSAID). Az epidemiológiai adatok negatív összefüggést sugallnak az NSAID-k vagy az aszpirin és a gyomorrák között. Egy nemrégiben végzett eset-kontroll tanulmány kimutatta, hogy az NSAID-k folyamatos alkalmazása a gyomorrák kockázatának csökkenésével járt együtt (esélyhányados, 0,51; 95% -os konfidenciaintervallum, 0,33–0,79). 48 A hagyományos NSAID-okhoz kapcsolódó gyomor-toxicitás miatt ez a megközelítés klinikailag nem megvalósítható. Mivel a közelmúltban elérhetőek a ciklo-oxigenáz-2 inhibitorok, csábító tesztelni, hogy ez a szer alkalmazható-e a gyomorrák kemo-megelőzésében. Bíztató eredményeket szolgáltattak a ciklo-oxigenáz-2 inhibitorok családi adenomatous polyposisban szenvedő betegeknél történő alkalmazására vonatkozó előzetes adatok. 49 Ugyanakkor további vizsgálatra vár, hogy ez átfordulhat-e a gyomor-bél metaplázia kemo-prevenciójába.
Ha a bélmetapláziát az őssejtek szomatikus mutációjából vagy az őssejtek epigenetikai változásaiból eredő megváltozott gyomorfenotipusként észlelik, akkor várható, hogy ezek a változások egyáltalán nem fordulhatnak vissza a daganatok felszámolása ellenére. H. pylori. A jövőbeni, hosszabb nyomon követéssel és nagyobb mintamérettel rendelkező tanulmányok képesek lesznek meghozni a végső ítéletet arról, hogy a bélmetaplázia valóban átment-e a „visszatérés nélküli ponton”. Mindazonáltal a gyomorkörnyezet változásai, amelyek a H. pylori, mint például a gyulladás megszüntetése, a DNS károsodásának megszüntetése 50 és a proliferáció csökkentése, 24 fontosabb lehet a gyomorrák megelőzésében, mint a bél metaplazia tényleges visszafordítása.
Következtetések
Meggyőző epidemiológiai adatok és a gyomor-bél metapláziájában kimutatott molekuláris változások alapján nem kétséges, hogy a bél metapláziája rosszindulatú gyomor elváltozása. Azonban nem minden bélmetapláziában szenvedő beteg válik gyomorrákká. A jövőbeni kutatásoknak azoknak az azonosítására kell irányulniuk, akiket veszélyeztet a további fejlődés, hogy intenzív felügyeleti programok valósulhassanak meg. Bár az anti-Helicobacter a bélmetaplazia kezelésében a terápia ígéretesnek tűnik, hosszú távú eredmények hiányoznak. Meg kell határozni más kemo-megelőző szerek szerepét.
Köszönetnyilvánítás
Az ebben a cikkben leírt munkát a Kínai Hongkong Különleges Közigazgatási Terület Kutatási Támogatási Tanácsának támogatása támogatta (Projektszám: CUHK 4061/01M).
- Az öregedés, a gyomor nyálkahártya atrófiájának és az étkezési szokásoknak a gyomor szekréciójára gyakorolt hatása - PubMed
- Gyomorrák eltávolítása utáni lefolyó beiktatása gyomorrákra Cochrane
- Bél - száraz macskaeledel - PRO-VET Prof Pet Corporation
- Időszakos elzáródás, amely több bélhálóból ered
- A csirke bél mikrobiota és a fehérje emésztése közötti kölcsönhatás - ScienceDirect