Előrelépések a Giardia megértésében: a krónikus következmények meghatározói és mechanizmusai
Luther A. Bartelt
1 Fertőző Betegségek és Nemzetközi Egészségügyi Osztály, Virginia Egyetem, Box 801340, Charlottesville, VA 22908, USA
R. Balfour Sartor
2 Gasztroenterológiai Osztály, Gasztrointesztinális Biológiai és Betegségközpont, Észak-Karolinai Egyetem, Chapel Hill, Campus Box 7032, Chapel Hill, NC 27599-7032, USA
Absztrakt
A Giardia lamblia egy jelölt protozoon, amely az erőforrásokkal korlátozott körülmények között élő gyermekeknél a bélparazita fertőzés leggyakoribb oka. A Giardia patogenitásáról a parazita első azonosítása óta vitattak, és a klinikai eredmények tanulmányok szerint változnak. A közelmúltbeli zavaró eredmények között vannak a Giardia és az akut versus tartós hasmenés közötti, egymással ellentétes összefüggések, valamint a hosszú távú következmények, köztük a gyermek növekedésének és a kognitív fejlődésnek a rossz ismerete. Az ilyen protean klinikai eredményeket vezérlő mechanizmusok továbbra is megfoghatatlanok, de a legújabb fejlemények arra utalnak, hogy a Giardia törzsek változékonysága, a gazdaszervezet tápláltsági állapota, a mikrobiota összetétele, az egyidejűleg fertőző enteropatogének, a gazda genetikailag meghatározott nyálkahártya immunválaszai és a Giardia által végzett immunmoduláció mind releváns tényezők befolyásolja a betegség megnyilvánulásait a Giardia fertőzés után.
Bevezetés
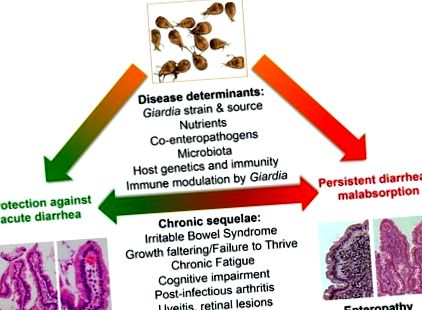
Anton van Leeuwenhoek először 1681-ben azonosította saját hasmenéses székletében Giardiát, de a parazita csak 1981-ben vált a WHO által hivatalosan elismert kórokozóvá. Még azután is, hogy Theodore Nash és munkatársai [30] teljesítették Robert Koch posztulátumait az önkéntes emberekben 1987-ben [20]., a Giardiának tulajdonítható betegségről vitattak. Ezt a klinikai egyensúlyt bonyolítja a látszólag tünetmentes gazdaszervezetek és a még megfoghatatlan mechanizmusok túlsúlya, amelyek elmagyarázzák, hogyan alakulnak ki egyes egyének a jellegzetes giardiasis szindróma: hasi görcsök és puffadás, malabszorptív hasmenés (steatorrhoea) és fogyás [18]. Ezen túlmenően, tisztázatlan okokból, krónikus következmények, beleértve a fertőzés utáni irritábilis bél szindrómát, krónikus fáradtságot [31], alultápláltságot [32], kognitív károsodást [33] és bélen kívüli megnyilvánulásokat (például ételallergia, csalánkiütés, reaktív ízületi gyulladás, és gyulladásos szemészeti megnyilvánulások), kialakulhatnak és esetleg fennmaradhatnak a kimutatható parazita leváláson túl (1. ábra).
A gyermekegészségügy korlátozott erőforrásokkal történő javítására irányuló globális erőfeszítések a gyermekkori alultápláltság, a sokféle és gyakori enterális kórokozó-expozíció tágabb összefüggéseinek közepette helyezik el a Giardia-fertőzéseket [34], valamint a környezeti enteropátia (a krónikus gyomor-bélrendszer egyik formája) szerepének új megértését. diszfunkció és gyulladás, amely magában foglalhatja az előzőleg klinikai állapotnak nevezett „trópusi sprue”) [11,35] és mikrobiota [36] gyermekkori fejlődését és növekedését. A legutóbbi, szigorúbb megfigyelési módszerekkel és érzékenyebb molekuladiagnosztikával felszerelt elemzések [37–39] nemcsak megismételték a Giardia gyermekkori fertőzés kimenetelének a korábbi vizsgálatokban tapasztalt széles variabilitását, de sokkal nagyobb terheket tártak fel. expozíció, mint a mikroszkópos technikákon alapuló becslések [39,40]. Ezek és más tanulmányok provokatív megfontolásokat vetettek fel, beleértve azt is, hogy Giardia védelmet nyújthat az akut hasmenés ellen [41–43].
A Giardia-fertőzésnek tulajdonítható, hiányosan megértett patológia fényében a parazita- és gyomor-bélbiológia közelmúltbeli fejleményei remélik, hogy tisztázzák, hogyan és mikor okoz Giardia betegséget. Ezek az előrelépések alapvető kérdéseket vetnek fel azzal kapcsolatban, hogy a Giardia miként hat kölcsönhatásba a vékonybél mikrobiális, táplálkozási és gazda tényezőinek komplex ökológiájával, a gazda fogékonyságának meghatározó tényezőivel, és hogy a gazda gyulladása hozzájárul-e a patogenezishez és hogyan (2. ábra).
Endémiás gyermekkori giardiasis egyensúly
Titkosító törzs virulencia és patogenitás
A Giardia legalább hat elismert faja közül csak a G. lamblia okoz fertőzéseket az emberekben. A G. lamblia izolátumokat további nyolc csoportra osztják, amelyek A-tól H-ig vannak jelölve. Az együttesek közül csak az A és B együttesek és azok altípusai okoznak emberi fertőzést. Az A és a B együttes fertőzés relatív aránya időben és térben egyaránt változik, előszeretettel alkalmazva a további B-fertőzéseket endémiás körülmények között [87–90].
A teljes genom szekvenálás feltárta, hogy az A és B együttes laboratóriumi izolátumok meglehetősen különböznek egymástól, és jobban külön kategóriákba sorolhatók [91]. E genetikai divergencia ellenére a klinikai variabilitás és a patogenitás hozzárendelésére tett kísérletek az összegyűjtés megnevezése alapján nem voltak meggyőzőek. Külön tanulmányokban vagy az A [92,93], vagy a B [94,95] együttes erősebben társul a hasmenéssel. A természetes eredetű fertőzésben az együttes-specifikus patogenitás értékelésének korlátja az, hogy az A és B együttesek - β-giardin (bg), glutamát-dehidrogenáz (gdh), trióz-foszfát-izomeráz (tpi) és a kicsi 18S rRNS alegység megkülönböztetésére használt célpontok. gének - nem ismert virulencia tényezők. Ezenkívül a multilokuszos genotipizálást magában foglaló vizsgálatok kimutatták, hogy a minták jelentős része vegyes eredménnyel jár [96,97], felvetve a heterológ fertőzések vagy akár az összecsapódások közötti rekombinációs események lehetőségét [98,99]. Kiterjesztett összehasonlító genomikai vizsgálatok, amelyek több A és B együttes izolátumot vizsgálnak, tovább pontosíthatják a törzs-specifikus patogenitást.
A giardiai biológia és a génszabályozás fejlődése a transzkripptikus és proteomikus megközelítések alkalmazásával új virulencia tulajdonságok azonosítását tűzte ki célul, amelyek megerősíthetők az emberi fertőzésekben. Például a gazda humorális és veleszületett védekezésének elkerülése lehetséges eszközeként Giardia 20-200 kDa-os ciszteinben gazdag fehérjék repertoárjával rendelkezik, amelyek sűrűn bevonják a trophozoiták felületét, amelyeket variáns felszíni fehérjéknek (VSP) neveznek. Bár csak egyetlen VSP expresszálódik egy egyedi trophozoitán, a potenciális VSP-k szélessége (73-270 vagy több) [91,107] egy adott törzsben fokozott virulenciával jár [108]. Hogyan történik a VSP-váltás 6-13 generációnként, és milyen események váltják ki a poszt-transzkripciós VSP-szabályozást [107, 109], és az emberkereskedelem segíthet a krónikus fertőzéssel szembeni tranziens kolonizáció parazita-meghatározóinak kibontásában. A Giardia cathepsins betegségmeghatározó szerepe szintén további megfontolást igényel [102,103].
A betegség táplálkozást meghatározó tényezői
Egyre felismerhetőbb a bonyolult kapcsolat a gazda táplálkozása és a nyálkahártya immunválaszai között. Az alultáplált gyermekek például csökkentették a szerokonverziót az orális gyermekbénulás elleni oltás egyes komponenseire [125]. Kísérleti modellekben az alultápláltság fokozott érzékenységet biztosít a Cryptosporidium [126–128] és az enteroaggregatív Escherichia coli (EAEC) iránt. A cinkhiány fokozza a Giardia iránti érzékenységet [130], és csökkenti az EAEC-re adott gyulladásos reakciókat [131]. Krónikus giardiasis modellben a fehérje alultápláltsága az IL-4 és IL-5 expressziójának csökkenéséhez vezetett, és csökkentette a B-sejtek populációját a bélszövetekben, a villusok tompulását és növekedési kudarcát a jól táplált fertőzött kontrollokhoz hasonló parazita terhelés ellenére [ 85]. Ezek az eredmények arra utalnak, hogy krónikus giardiasisban szenvedő gyermekeknél a táplálkozási állapot hasonlóan meghatározhatja a betegség súlyosságát.
Mikrobiota és ko-patogén kölcsönhatások
A gazdaszervezet válaszai és a betegség patogenezise
A Giardia patogenezisében a gazda immunválaszának kettőssége bonyolult és alaposan áttekintették [83,154]. Egyre többször azonosítják az immunológiai kontroll redundáns mechanizmusait, beleértve a hámsejtekből származó kemokineket (CCL2, CCL20, CXCL1, CXCL2 és CXCL3) [155], dendritikus sejtekből származó IL-6-t és esetleg hízósejteket [156–158], TNF -α [159], a mátrix metalloproteáz 7 által aktivált a-defenzinek (Mmp7) [159], vagy az 1. nitrogén-monoxid-szintázból (NOS1) vagy a NOS2-ből származó nitrogén-oxid [159–161]. Elszigetelt járványok és kísérleti modellek adatai vegyes immunválaszt mutatnak, amely mind antitesttermelésből [162,163], mind nyálkahártya és szisztémás Th1 típusú CD4 + T-sejt válaszokból áll [84,164,165]. Soros megbetegedésekkel rendelkező populációkon végzett vizsgálatok azt mutatják, hogy a Giardia-expozíció elősegítheti a védő immunitást [166], amelyet a Th1-memória fenotípussal rendelkező keringő T-sejtek túlsúlya jellemez (IFN-y-t termelő CD25 + CD26 fényes sejtek) [165] . A CD4 + T-sejtek hiánya a kísérleti modellekben is elhúzódó fertőzéshez vezet [84].
A T-sejtek protektív immunitásban betöltött szerepére vonatkozó bizonyítékok ellenére a klinikai megfigyelések azt sugallják, hogy a humorális válaszok kritikusak az immunitás szempontjából. Ezek a tanulmányok a Giardia-ciszták nagyobb gyakoriságát és a tünetek nagyobb gyakoriságát mutatják be hipogammaglobulinémiában (azaz x-kapcsolt agammaglobulinémiában [Bruton-kór] és gyakori változó immunhiányban) szenvedő betegeknél [167–169], mint T-sejt-hiányosaknál (előrehaladott AIDS vagy thymás aplasia) ). A szekréciós IgA csökkenése változóan összefügg a megnövekedett kockázattal [170], és az IgA-válasz romlása figyelhető meg tartós Giardia fertőzésben szenvedő gyermekeknél [171]. Állatmodellekben a kísérleti egérfertőzésekben expresszált gének többsége az antitest termeléséhez kapcsolódik [159], és az IgA-hiányos knockout egereknek nehézséget okoz a Giardia tisztítása [172]. A polimer Ig receptor, amely az IgA-t és az IgM-et szállítja az epitheliumon keresztül, elengedhetetlen a G. muris eliminálásához az egér gazdasejtjeinél, tovább támogatva a nyálkahártya szekréciós antitest-válaszainak esetleges függését a fertőzés felszámolása érdekében [173].
Az ilyen krónikus és ismételt Giardia-expozíció gyakori az alacsony jövedelmű gyermekeknél, akiknél szintén magas az alultápláltság és a krónikus bélgyulladással járó, egyre inkább elismert bélműködési zavarok, megnövekedett béláteresztő képesség és csökkent villushosszúság, amelyet környezeti enteropátiának neveznek [11]. Kevés tanulmány jellemezte a Giardia elleni immunválaszokat ezeknél a gyermekeknél. Kohli és munkatársai [87] gyulladásos hasmenést azonosítottak széklet-laktoferrin alkalmazásával a Giardia első esetében (de a későbbi eseteket nem), Long és munkatársai [176] az IL-4, IL-5, a monocita kemoattraktáns protein-1 (MCP) növekedését mutatták ki. -1) és IFN-γ, de csökkent az IL-8 értéke azoknál a gyermekeknél, akiknél a Giardia hosszabb ideig tartó epizódjai voltak. Így a bél gyulladásos reakciója és a Giardia fertőzés közötti összefüggés befolyásolhatja ezeknek a gyermekeknek a betegség kimenetelét.
Következtetések
A G. lamblia továbbra is rejtélyes parazita, amely potenciálisan befolyásolhatja a gyermekek egészségét és fejlődését endémiás erőforrásokkal korlátozott körülmények között, ahol a fertőzés szinte általános. A változó eredményeket magyarázó következtetés mind a terepi vizsgálatokban, mind a kísérleti modellekben az, hogy a Giardia nem felel meg a „kommensális” vagy „patogén” mikroba hagyományos fogalmainak, és időnként elősegítheti a nyálkahártya védelmének vagy a betegségnek az állapotát. Ezért a különféle Giardia törzsek közvetlen hatásainak felismerése a parazita komplex és dinamikus luminalális ökológiára és a gazda nyálkahártya homeosztázisára gyakorolt közvetett hatásoktól közvetett hatásoktól kritikus lépés lesz az alapvető laboratóriumi eredmények emberi betegségek kimenetelévé történő átalakítása felé. Ez a megértés a krónikus giardiasis, valamint a környezeti enteropathia és a gyermekkori alultápláltság javított beavatkozásához vezethet, ugyanakkor azonosíthatja a szervezet tulajdonságait, amelyek kihasználhatók az emberi egészség elősegítésére.
Köszönetnyilvánítás
Köszönjük Richard L. Guerrant, Cirle A. Warren, Leana Guerin, Scott Dawson és Jörg-Dieter Schulzke betekintését és segítségét az alak előkészítésében. Támogatás érkezett az Országos Egészségügyi Intézetektől/az Országos Allergia- és Fertőző Betegségek Intézetétől a K08-AI108730-01. Sz.
Rövidítések
| APO-E | apolipoprotein E |
| MACSKA | kationos transzporter |
| CI | megbízhatósági intervallum |
| Euratom | enteroaggregatív Escherichia coli |
| IFN-y | gamma-interferon |
| IL | interleukin |
| NOS | nitrogén-oxid szintáz |
| VAGY | esélyhányados |
| TLR | Díj-szerű receptor |
| TNF-a | tumor nekrózis faktor-alfa |
| VSP | variáns felszíni fehérje |
| KI | Egészségügyi Világszervezet |
Megjegyzések
A cikk elektronikus változata teljes, és a következő címen található: http://f1000.com/prime/reports/b/7/62
Megjegyzések
Közzétételek
A szerzők kijelentik, hogy nincsenek közzétételeik.
- 8. konferencia a megelőzés legújabb fejleményeiről; A gyermekkori és serdülőkori elhízás kezelése
- 4 tipp a krónikus fájdalom Arthritis Alapítvány kezeléséhez
- A méz előnyei; Gyakorlat; Krónikus erő
- 4 módszer a krónikus betegségben szenvedő betegek étrendváltoztatásának elősegítésére American Medical Association
- Az elhízás megelőzésének és kezelésének integrált kerete és az azzal összefüggő krónikus