Guarana (Paullinia cupana) serkenti a mitokondriális biogenezist az egerekben táplált magas zsírtartalmú étrendben
Absztrakt
1. Bemutatkozás
Az elhízás világszerte jelentős közegészségügyi probléma, és összefügg az epigenetikus tényezőkkel, a zsírban és cukorban gazdag feldolgozott élelmiszerek túlzott fogyasztásával és a fizikai aktivitás hiányával. Az Egészségügyi Világszervezet (WHO) a túlsúlyt és az elhízást kóros vagy túlzott zsírfelhalmozódásként határozza meg, amely hozzájárul más betegségek, például cukorbetegség, magas vérnyomás, valamint vese- vagy koszorúér-problémák kialakulásához [1,2].
Az energia-anyagcserét az energiafelhasználás és a táplálékfelvétel határozza meg, amelyeknek egyensúlyban kell lenniük a testsúly fenntartása érdekében. A vázizom a celluláris bioenergetikával összefüggésben célszerv a glükóz homeosztázisban és az inzulinérzékenységben betöltött fontos szerepe miatt [3,4]. Így gyakori, hogy az elhízott alanyok esetében, akik normál esetben növelik a testzsír-tömeget és csökkennek a zsírmentes tömeg, csökken az energiafelhasználás.
Az 1-alfa (Pgc1α) peroxiszóma-proliferátor által aktivált receptor gamma koaktivátor felelős a mitokondriális biogenezis, az oxigénfogyasztás és az oxidatív foszforiláció szabályozásáért, a mitokondriális tömeg növekedésével, az adaptív termogenezis számos kulcsfontosságú komponensének aktiválásával és az energiafelvétel stimulálásával. lehetővé teszi a sejtek és szövetek alkalmazkodását nagy energiaigényű helyzetekhez [5]. A Pgc-1α-t poszttranszlációs módosítással szabályozzuk, ideértve a foszforilezést és a deacetilezést protein-kináz, AMP-aktivált (Ampk) és sirtuin 1 (Sirt1) alkalmazásával [6]. Ez a három gén alkot egy energiaérzékelő hálózatot, amely szabályozza a vázizomzat energiafogyasztását [7].
Az elhízás visszaszorítására számos stratégiát dolgoztak ki, és széles körben alkalmazták a termogén hatású funkcionális ételeket és/vagy bioaktív vegyületeket. A zöld teát összefüggésbe hozták a fogyással, az energiafogyasztás és a zsíranyagcsere modulációjával [8]. A gyömbércsaládba tartozó kurkumin fogyasztása növeli a termogén génexpressziót (például az 1-es fehérje (Ucp1) és a Pgc1a szétkapcsolása), és növeli az inguinalis fehér zsírszövet mitokondriális tartalmát [9]. Ezenkívül a HFD-vel és luteolinnal táplált C57BL6 egerekben természetes borsban, zellerben, kakukkfűben, borsmentában és loncban gazdag flavonoidot figyeltek meg, az oxigénfogyasztás növekedését, valamint a magasabb szén-dioxid-termelést és a légzéscsere arányát figyelték meg [10]. Ezenkívül a resveratrol csökkenteni tudta az oxidatív stresszt, helyreállította a mitokondriális funkcionális aktivitásokat és stimulálta az oxidatív foszforilációt és a mitokondriális biogenezis gén expresszióját magas zsírtartalmú étrendben táplált egerekben [11,12].
A guaranát (Paullinia cupana Kunth) súlycsökkenéssel társították, amely számos védőhatást mutatott a magas vérnyomás, az elhízás és a metabolikus szindróma ellen [13], az élelmiszer-bevitel csökkentésének képességét [14] és az adipogenezissel kapcsolatos gének modulálását [15]. Emellett már bebizonyosodott, hogy a guarana kivonat és a zöld tea keveréke, amely fix dózisú koffeint (200 mg) és változó dózisú epigallokatechin-3-gallátot (EGCG) tartalmaz, növelte az energiafelhasználást (metabolikus kamrában mérve a 24 órás energiafelhasználás) egészséges felnőtteknél [16]. Így vizsgálatunk célja a guaranával végzett orális kezelés elhízásra, anyagcserére és mitokondriális biogenezisre gyakorolt hatásainak és lehetséges mechanizmusainak vizsgálata volt.
2. Anyag és módszerek
2.1. Kísérleti terv
Asztal 1
A magas zsírtartalmú étrend összetétele.
| Kukoricakeményítő | 115.5 | 462 |
| Kazein | 200 | 800 |
| Szacharóz | 100 | 400 |
| Dextrinált keményítő | 132 | 528 |
| Disznózsír | 312 | 2808 |
| Szójabab olaj | 40 | 360 |
| Cellulóz | 50 | - |
| Ásványi keverék | 35 | - |
| Vitamin keverék | 10. | - |
| l -cisztin | 3 | - |
| Kolin | 2.5 | - |
| TELJES | 1000 | 5358 |
2.2. Közvetett kalorimetria
Az állatok alapenergia-felhasználását közvetett kalorimetriával értékeltük. Az eutanázia előtt 48 órával az egereket 24 órán át akklimatizáljuk egyedi anyagcsere-ketrecekben (OXYLET System - rágcsálók esetében), és további 24 órán át figyeljük. Az elfogyasztott O2 (VO2) és a termelt CO2 (VCO2) mennyiségét 25 percenként, 24 órán át mértük. A légzéscserét (RER) a következő képlet segítségével számoltuk ki: (RER) = VCO2/VO2. Az alapenergia-ráfordítást (EE) a következő képlet segítségével határoztuk meg: kcal/nap/kg 0,75 = 1,44 × VO2 × (3815 + 1232 × RER) [17].
2.3. Állati eljárás és szöveti boncolás
A táplálékfelvételt és a testsúlyt hetente mértük. A glikémiás, triglicerid- és koleszterinszinteket az Accutrend Plus (Roche Diagnostics GmbH, Mannheim, Németország) specifikus csíkokkal határozta meg. A 8. hét végén az egereket (12 órás éhgyomorra után) 2% xilazin/10% ketamin (1 μl/testtömeg-gél) 1: 1-es oldatával altattuk, és a vérmintákat szívpunkcióval vettük fel. A zsírszövetraktárakat (szubkután, retroperitoneális, zsigeri és epididimális) feldaraboltuk és lemértük. A Gastrocnemius izom- és barna zsírszövet mintákat boncoltuk és -80 ° C-on tároltuk az elemzésig.
2.4. mRNS (Messenger robonukleinsav) expressziós elemzés
Izom mintákat használtunk a kvantitatív valós idejű PCR elemzéshez. A teljes RNS extrakciót, a komplementer DNS (cDNS) szintézist és a kvantitatív PCR-t a korábban leírtak szerint hajtottuk végre [18], specifikus primerek alkalmazásával (2. táblázat). Először az összes mintát háztartás 18S gén alkalmazásával normalizáltuk, majd a HFD-GUA csoportot HFD csoport normalizálta. A hajtásváltozás kiszámításához a 2 -ΔΔCt egyenletet használtuk.
2. táblázat
Valós idejű PCR-hez használt primerek.
| Sirt1 | Érzék | AGTGGCACATGCCAGAGTC |
| Antisense | TCCAGATCCTCCAGCACAAT | |
| Creb1 | Érzék | TTTGTCCTTGCTTTCCGAAT |
| Antisense | CACTTTGGCTGGACATCTTG | |
| Ampka1 | Érzék | TGAGAACGTCCTGCTTGAATG |
| Antisense | ATCATTGGCTGAGCCACAGC | |
| Ampka2 | Érzék | ACAGGCCATAAAGTGGCAGT |
| Antisense | GTCGGAGTGCTGATCACGTG | |
| Pgc1α | Érzék | CCGAGAATTCATGGAGCAAT |
| Antisense | TTTCTGTGGGTTTGGTGTGA | |
| Nrf1 | Érzék | CAACAGGGAAGAAACGGAAA |
| Antisense | CACTCGCGTCGTGTACTCAT | |
| Nrf2 | Érzék | AGGACATGGAGCAAGTTTGG |
| Antisense | TCTGTCAGTGTGGCTTCTGG | |
| Ucp1 | Érzék | TCAGGGCTGAGTCCTTTTGT |
| Antisense | CTGAAACTCCGGCTGAGAAG | |
| Ucp3 | Érzék | CTCACTTTTCCCCTGGACAC |
| Antisense | GTCAGGATGGTACCCAGCAC | |
| 18S | Érzék | AAACGGCTACCACATCCAAG |
| Antisense | CAATTACAGGGCCTCGAAAG |
2.5. Mitokondriális DNS mennyiségi meghatározás (Mtdna)
A mitokondriális DNS (mtDNS) mennyiségi meghatározását kvantitatív valós idejű PCR-rel végeztük. Röviden, a DNS (dezoxiribonukleinsav) extrakciót (izom- és barna zsírszövetből) fenol/kloroform módszerrel hajtottuk végre. Ezután a valós idejű PCR-t Platinum ® SYBR GREEN® qPCR Supermix Uracil-DNS-glikoziláz (UDG) (Invitrogen, CA, USA) alkalmazásával végeztük a gyártó protokollja szerint. Az mtDNS kvantifikálásához mitokondriális Cox1-et (citokróm c-oxidáz I alegységet) (FW 5′-GCCCCAGATATAGCATTCCC-3 ′ és RV 5′-GTTCATCCTGTTCCTGCTCC-3 ′) és endogén kontrollként 18S rRGGTAGTTGT ′ És RV 5′-CGCTGAGCCAGTCAGTGT-3 ′). A valós idejű PCR-t 7500 valós idejű PCR-rendszerben (Applied Biosystems Foster City, Kalifornia, USA) hajtottuk végre, és az RQ Study Software (Applied Biosystems) alkalmazásával elemeztük. Az mtDNS-kópiák relatív kvantitatív meghatározását a DNSmt/nukleáris DNS arányával kaptuk meg, és a 18S háztartási génnel végzett normalizálás után a hajtásváltozást a következő egyenlet segítségével határoztuk meg: 2 ΔΔCt módszer.
2.6. Western Blotting elemzés
2.7. Statisztikai analízis
Az adatokat átlagértékekként ± SEM adjuk meg. A GraphPad Prism 5-t használták statisztikai elemzésekhez és grafikákhoz (GraphPad Software, Inc., San Diego, Kalifornia, USA). A kísérleti adatokat Student párosítatlan t tesztjével elemeztük. A testsúly elemzéséhez kétirányú varianciaanalízist (ANOVA) alkalmaztunk.
3. Eredmények és megbeszélés
Korábban bemutatták a guarana (Paullinia cupana) kivonat testtömeg-szabályozásra, táplálékfelvételre, a magas vérnyomás elleni védelemre, valamint az adipogenezis folyamathoz kapcsolódó egyes gének és miRNS-ek modulációjára gyakorolt hatásait [13,14,15]. Ezenkívül ebben a tanulmányban bebizonyosodott, hogy a guarana a termogenezis és a mitokondriális biogenezis fokozásával szabályozhatja a testtömeget.
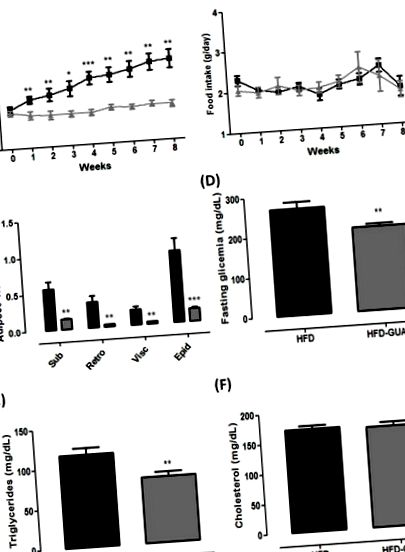
(A) Testtömeg (g) magas zsírtartalmú étrend (HFD) -csoport (n = 6) és magas zsírtartalmú étrend + guarana (HFD-GUA) csoport (n = 6) kezelés nyolc hete alatt; (B) A HFD-csoport (n = 6) és a HFD-GUA-csoport (n = 6) táplálékfelvétele (g) a kezelés nyolc hete alatt; (C) Nyolc hetes kezelés után a szubkután zsírszövet, a Retro - retroperitoneális zsírszövet, a Visc - a zsigeri zsírszövet és az Epi - epididyimális zsírszövet zsírszövetraktárai (g); (D) Glikémia (mg/dL) 12 óra éhgyomorra; (E) Trigliceridek (mg/dl) 12 órás éhezés után; (F) Koleszterin (mg/dl) 12 órás éhezés után. A fekete vonal/sávok a HFD-csoportnak felelnek meg (n = 6), a szürke vonal/sávok pedig a HFD-GUA-csoportnak (n = 6). * p 2. A ábra), valamint EE (+ 20% a fényciklusban és + 16% a sötét ciklusban, p 2.B, C ábra) a HFD csoporthoz képest. Annak ellenére, hogy az egerek éjszakai aktivitást mutatnak, lehetséges, hogy az EE növekedése a fényciklusban (+ 20%) annak köszönhető, hogy ebben a ciklusban végezzük a szondázást, és nem a sötét ciklusban. Ezenkívül kiszámolták a légzési cserearányt (RER) annak meghatározása érdekében, hogy az elsődleges üzemanyagforrás szénhidrát vagy zsír-e. Ismeretes, hogy a 0,70 RER a zsír oxidációjának túlsúlyát jelzi; A RER 0,85 a zsír és a szénhidrát keverékére utal, és az 1,00 vagy annál magasabb érték a szénhidrát oxidációjára utal [21,22]. Adataink azt mutatták, hogy a HFD-GUA csoportban a fényciklus főként szondázás után (2. D ábra) csökkent a HFD-GUA csoportban (2. E ábra), ami a guaranával kezelt állatokban megnövekedett zsírsav-felhasználást jelez. A sötét ciklusban azonban nem figyelünk meg RER különbséget (2. F ábra). Ennek megfelelően a zöld teával és az EGCG-vel együtt fogyasztott guarana-kivonat képes volt növelni az energiafogyasztást (metabolikus kamrában mérve a 24 órás energiafelhasználást) egészséges felnőtteknél [16]. Ismert, hogy a guaranában magas a koffeinkoncentráció [15,23], és néhány tanulmány már kimutatta, hogy a koffein képes módosítani az anyagcserét és az energiafelhasználást [24,25,26].
- Teljes cikk A rapamicin ütemtervének összehasonlítása magas zsírtartalmú étrendben
- Négy Bifidobacterium hatása az elhízásra magas zsírtartalmú étrendben indukált patkányokban
- A kitozán-kiegészítés nem befolyásolja a zsír felszívódását egészséges zsírtartalmú étrendben táplált férfiaknál, a
- A piperin hatása az elhízás okozta diszlipidémia szabályozásában magas zsírtartalmú étrendi patkányokban
- Fogyókúrás tabletták online - fogyás források