Helmintás fertőzések, 2-es típusú immunválasz és metabolikus szindróma
Aprilianto E. Wiria
1 Parazitológiai Tanszék, Orvostudományi Kar, Indonéz Egyetem, Jakarta, Indonézia,
2 Parazitológiai Tanszék, Leideni Egyetem Orvosi Központ, Leiden, Hollandia,
Erliyani Sartono
2 Parazitológiai Tanszék, Leideni Egyetem Orvosi Központ, Leiden, Hollandia,
Taniawati Supali
1 Parazitológiai Tanszék, Orvostudományi Kar, Indonéz Egyetem, Jakarta, Indonézia,
Maria Yazdanbakhsh
2 Parazitológiai Tanszék, Leideni Egyetem Orvosi Központ, Leiden, Hollandia,
A metabolikus szindróma és a gyulladás közötti összefüggés
A metabolikus szindróma (MetS), az energiafelhasználás és -tárolás rendellenessége olyan állapotok csoportjaként jelentkezik, mint a magas vérnyomás, diszlipidémia, hasi elhízás és megváltozott glükóz-anyagcsere, ami növeli a 2-es típusú cukorbetegség (T2D) és a szív- és érrendszeri betegségek kockázatát ( CVD). A túlfogyasztásból, a magas kalóriatartalmú ételek beviteléből és a fizikai aktivitás hiányából vagy rendszertelenségéből álló életmód kockázati tényező a MetS kialakulásában. Ezért a MetS kezelése magában foglalja a rendszeres fizikai aktivitást, az étrend módosítását a súly és/vagy a vércukorszint csökkentése érdekében, valamint a lipidcsökkentő gyógyszerek alkalmazását.
A helmint-fertőzések összefüggenek-e a metabolikus szindrómával?
A magas jövedelmű országokban (HIC) az olyan fertőző betegségeket, mint a helminták (általában rossz higiéniával vagy higiénés viszonyokkal társulnak), viszonylag jól kontrollálják a fejlődő vagy az alacsony és közepes jövedelmű országokkal (LMIC-k) összehasonlítva, különösen az LMIC-k vidéki területein. A HIC-k egészségi problémái inkább a MetS-hez kapcsolódnak. Egyre több bizonyíték áll rendelkezésre arra vonatkozóan, hogy az LMIC-k fertőző betegségeinek infrastruktúrájának és ellenőrzésének javulása, amelyet gyakran a fertőzések (köztük a helmint-fertőzések) csökkenése követ, a különböző gyulladásos betegségek, például allergiák és autoimmunitások, valamint T2D és CVD [10].
Számos tanulmány fordított összefüggést mutatott ki a helmintás fertőzések és a gyulladásos betegségek, például az allergia, az autoimmunitás és a gyulladásos bélbetegség között, de fontos, hogy vannak olyan bizonyítékok, amelyek úgy tűnik, hogy a helminták a MetS alacsonyabb előfordulási gyakoriságával is összefüggenek [10]. Egy indiai tanulmány fordított összefüggést mutatott a nyirokcsomó filariasis és a T2D között [11], míg egy kínai vidéki közösség nemrégiben készített jelentése, amely korábban endemikus volt a schistosomiasis miatt, azt mutatta, hogy a Schistosoma japonicum korábbi fertőzése alacsonyabb MetS előfordulással járt [12]. Az éhgyomri plazma glükóz, az étkezés utáni vércukor, a HbA1c és az inzulinrezisztencia, valamint a triglicerid és az alacsony sűrűségű koleszterin szintje fordítottan összefüggésben állt a korábban bejelentett S. japonicum fertőzéssel. Ennek alátámasztására azt is megállapítottuk, hogy Indonéziában a helmint fertőzések az inzulinérzékenység javulásával járnak (Wiria et al., Cikk, publikálatlan).
Egy indonéziai vidéki tanulmányban kimutattuk, hogy a felnőttek bélféreg-fertőzései negatívan társultak a CVD kockázati tényezőihez, például a testtömeg-indexhez (BMI), a derék-csípő arányhoz (WHR) és a lipidszintekhez [13]. . Ugyanebben a tanulmányban nem találtunk összefüggést a jelenlegi helmintás fertőzések és a carotis intima media vastagsága (cIMT) között [13]. Ez nem biztos, hogy meglepő, mivel ezen a területen az egyének CIMT-je nagyon alacsony volt a HIC-ekben élő azonos korú egyénekhez képest [14], ami megnehezítené bármilyen jótékony hatás kimutatását. Megállapításunkat egy másik tanulmány is alátámasztja, amely kutyákban vizsgálta az érelmeszesedést [15]. A szerzők arról számoltak be, hogy az Opistorchis felineus fertőzés alacsonyabb szérum koleszterinszinttel társult, és az aorta érelmeszesedésének negatív előrejelzője volt.
Összességében csábító feltételezni, hogy a helmint fertőzések védhetnek a MetS ellen, így csökkentve a T2D és/vagy CVD későbbi kialakulásának kockázatát.
Mi a lehetséges mechanizmus a helmintusok és a metabolikus szindróma közötti társulás mögött?
Asztal 1
| Egér törzs | Helmintus fertőzés/kivonat | Megállapítások | Hivatkozások |
| (A) ApoE -/- egerek vagy (B) véletlenszerűen tenyésztett TO egerek | S. mansoni fertőzés | • Csökkentett teljes szérum koleszterinszint (mind A, mind B), valamint HDL és LDL koleszterin (B). | [26] |
| • Csökkent ateroszklerotikus elváltozás (A). | |||
| (C) ApoE -/- vagy (D) vad típusú (WT) C57BL/6 egerek | Fagyasztott S. mansoni tojások | • Csökkentett összszérum koleszterin (C és D) és LDL (C). | [27] |
| • Nincs hatással az ateroszklerotikus elváltozás kialakulására (C). | |||
| • Fokozott Th2 citokinválasz a Th1 citokinek befolyásolása nélkül (C). | |||
| • A makrofágok megnövekedett aránya a peritoneális üregben (C). | |||
| • A makrofágok fokozott képessége az LDL felvételére, de nem acetilezett LDL (D). | |||
| (E) ApoE -/- egerek vagy (F) TO egerek | S. mansoni fertőzés, élő S. mansoni petesejtek, SEA és SmECS | • A szabadalmaztatott biszexuális féregfertőzés csökkentette a szérum koleszterinszintjét (F) és a máj lipidjeit (E és F). | [19] |
| • Az egynemű féregfertőzés nem csökkentette jelentősen a szérum koleszterinszintjét (E, F). | |||
| • Élő petesejtek, SEA és SmECS csökkentik a szérum koleszterinszintjét (F). | |||
| • Az egynemű fertőzés, a SEA és az smECS nem befolyásolta a máj lipidjeit (F). | |||
| WT C57BL/6 egerek | N. brasiliensis fertőzés | • Javított inzulinérzékenység és glükóz tolerancia. | [17] |
| • Csökkent perigonadal zsírszövet súly. | |||
| • Megnövekedett periogonadalis zsírszöveti eozinofilek. | |||
| • Csökkent teljes zsírszöveti makrofágok. | |||
| (G) WT (H) IL-10 -/- vagy (I) Fxr-α -/- (Nr1h4) C57BL/6J egerek | TENGER | • Javított inzulinérzékenység és glükóz tolerancia IL-10-függő módon (G és H). | [21] |
| • Fokozott keringő IL-4 és IL-10 (G). | |||
| • Elősegítette az M2 és metabolikus gének expresszióját és csökkentette az M1 gének expresszióját az epididymális zsírszövetben (G). | |||
| • Védett a máj steatosisától és elnyomja a lipogén gén expressziót (g) | |||
| • Csökkent lipogenezis az Fxr-α (G, I) aktiválásával. | |||
| (J) WT (K) STAT6 (-/-) (L) IL-13 (-/-) C57BL/6 egér | N. brasiliensis fertőzés | • Csökkentett diéta okozta súlygyarapodás és elősegítette a fogyást elhízott egerekben (J-ben). | [28] |
| • Csökkent epididimális és barna zsírszövet tömeg és keringő leptin (J). | |||
| • Javított glükóz tolerancia és éhomi vér inzulin (J). | |||
| • A bél glükóz felszívódásának csökkenése, a glükóz transzporterek csökkent expressziójával társítva (J). | |||
| • Csökkent máj steatosis és befolyásolta a lipid anyagcserével kapcsolatos gének expresszióját (J). | |||
| • A Th2-citokinek szabályozott génexpressziója különböző szervekben, beleértve az epididymális zsírt is (J). | |||
| • Az Arg2 és YM1 M2 markerek fel-szabályozott génexpressziója epididimális zsírban (J) | |||
| • A máj steatosisának súlycsökkenése és gyengülése részben vagy egészben függött az IL-től- | |||
| • 13 és STAT6 (J, K, L) | |||
| (M) LDLR -/- vagy WT (N) c57BL/6 egerek | TENGER | • A lép Th2 gének indukált felszabályozása (M) | [20] |
| • Indukált gyulladásgátló peritoneális makrofágok, de nem befolyásolták az M2 génexpressziót (M). | |||
| • Csökkent szisztémás gyulladás a myeloid szinten (M). | |||
| • Csökkent plazmakoleszterin a VLDL- és LDL-méretű részecskékben (M). | |||
| • Attenuált atherosclerosis kialakulás és csökkent plakkos nekrózis (M). | |||
| • In vitro a SEA-val kezelt makrofágok gyulladásgátló fenotípust mutattak, és kevésbé tapadtak az aktivált endotheliumra (N). |
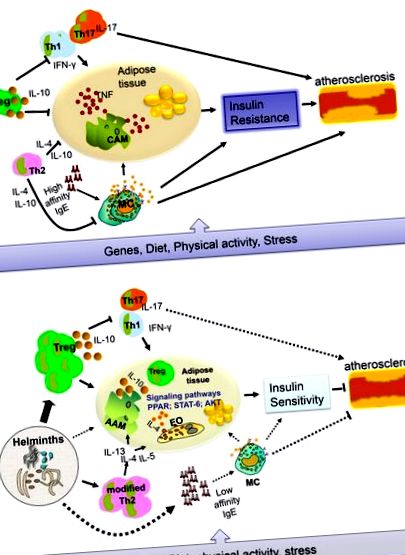
Az apoE -/- egerek felhasználásával végzett vizsgálat során kimutatták, hogy az S. mansoni petesejtekből felszabaduló faktorok lipidcsökkentő hatásúak [19]. Nemrégiben egy másik modell (c57BL/6 LDLR -/- egerek) jelentése kimutatta, hogy az S. mansoni-oldható tojásantigén (SEA) gyulladáscsökkentő makrofágokat indukál, amelyek csökkenthetik a szisztémás gyulladást, gyengíthetik az érelmeszesedés kialakulását és gátolják a lepedék nekrózisát. [20]. Sőt, Bhargava et al. [21] kimutatták, hogy a lakto-N-fukopentóz III, egy immunmoduláló glikán, amely megtalálható az emberi tejben és annak parazita helmintákon található Lewis-X-része (SEA-ban), javíthatja az inzulinérzékenységet a fehér-zsírszövet-inzulin jelátvitelének fokozásával. az IL-10 termelés indukcióján keresztül. Az, hogy a helmintfertőzések hasonló változásokhoz vezetnek-e az embereknél, még mindig további vizsgálatokat igényel. Egy nemrégiben végzett kutatás során azt találtuk, hogy az összes immunglobulin E (IgE), amely a helmint fertőzésekkel társul, az éhomi vércukorszint és a lipidszint csökkenésével járt együtt [13]. Az 1. ábrán azt a sémát mutatjuk be, amely bemutatja a gyulladás szerepét a T2D és a CVD kialakulásában helmint fertőzések hiányában és jelenlétében. .
Van-e még több IgE és CVD?
Állatmodellekben vizsgálták a teljes IgE és a CVD közötti kapcsolatot helminták hiányában. Wang és mtsai. számoltak be arról, hogy az IgE a CVD-hez kapcsolódik azáltal, hogy makrofágokon kötődik az FcεR1α-hoz, hogy elősegítse a plakk instabilitását [22]. Arról is beszámoltak, hogy az IgE-szint magasabb volt CVD-ben szenvedő alanyokban, különösen instabil anginában és akut koszorúér-eseményekben szenvedőknél. Kínában egy városi területen az IgE és a kimáz, egy hízósejt-proteáz magasabb szintjét jelentették a T2D potenciális kockázati tényezőjeként [23], [24]. Ezek a tanulmányok ellentétben állnak azzal a megállapításunkkal, miszerint a magas összes IgE a csökkent éhgyomri glükózzal és lipidekkel jár együtt [13]. Egy újabb munka azonban azt sugallja, hogy kétféle IgE létezik, amelyek különböző válaszreakciókat váltanak ki, ha a hízósejtek Fcε-receptoraihoz kötődnek [25]. Az egyik az IgE, amelynek nagy affinitása van, és az antigénjéhez kötődve képes elindítani a hízósejtek degranulációját és anafilaxiáját, míg a másik az alacsony affinitású IgE, amely funkcionálisan kevésbé aktív. Annak vizsgálata, hogy az IgE hogyan vesz részt a MetS patogenezisében, és hogyan különböznek az IgE biológiai aktivitásai a helmint fertőzések hiányában vagy jelenlétében, új betekintést nyerhet a lehetséges MetS patogenezisbe és kezelésekbe.
A Helminth-fertőzések és a MetS feltörekvő területe
Csábító feltételezés, hogy az olyan területek MetS elleni lehetséges védőhatása, amelyek olyan területeken élnek, ahol a helminták nagyon endémiásak, erős gyulladáscsökkentő és módosított válaszok jelenlétén alapul (1. ábra). Ennek a hipotézisnek a teszteléséhez kellően erőteljes longitudinális vizsgálatokra van szükség egy randomizált, kettős-vak, anthelmintikus-placebo-kontrollos vizsgálat formájában, amely feltárhatja, hogy a féreghajtás vezet-e MetS-hez. Egy másik módszer az lenne, ha helmintákkal fertőznék a MetS-t, hogy felmérjék, javíthatja-e a kezelés a MetS-t. Csak ezután lehet áthidalni a különbséget az állatmodellekben elért eredmények és az emberi helyzet között. Ezután érdekes lehet tesztelni, hogy mely helminták vagy melyik termékük használható a gyulladásos válaszok módosítására a T2D vagy CVD kezeléseként, ahogyan ez jelenleg az allergia, az autoimmunitás és a gyulladásos bélbetegségek területén történik [10].
Köszönetnyilvánítás
Köszönjük Leonie Hussaarts-nak, hogy segített az asztalnál, és Bruno Guigas-nak, aki segített a figurának és kritikusan olvasta a kéziratot. A szerzők elnézést kérnek azoktól a kollégáktól, akiknek papírjait helykorlátozások miatt nem lehetett idézni.
- Az FTO genotípusának hatása a fogyásra és az anyagcsere-kockázati tényezőkre a kalóriákra adott válaszban
- A citomegalovírus fertőzés hozzájárulhat a metabolikus szindrómához
- A zsírsejtek érzékelik a napfényt - a nem elegendő mennyiség növeli a metabolikus szindróma kockázatát EurekAlert!
- A fogyás hatása az LDL és a HDL kinetikájára a metabolikus szindróma cukorbetegség ellátásában
- A fogyás hatása a trigliceridekben gazdag lipoprotein metabolizmus markereire az anyagcserében