HIV-1 átvitel, replikációs alkalmasság és betegség progresszió
Absztrakt
Az átvitel után az 1-es típusú humán immunhiányos vírus (HIV-1) a nyiroktartály fertőzését okozza, ami a memória CD4 + T-sejtek populációjának alapos kimerüléséhez vezet, az adaptív immunválasz kiváltása ellenére. A különböző tulajdonságokkal rendelkező vírusvariánsok gyors fejlődése és társulása a fertőzés különböző szakaszaival, a vírusterhelés szintjével és a betegség progressziójának sebességével arra utal, hogy a vírusvariánsok szerepet játszanak ebben a folyamatban. Itt áttekintjük a HIV-1 variánsokkal és betegségekkel kapcsolatos szakirodalmat, és megvitatjuk a vírus transzmisszióra és betegségre való alkalmasságának fontosságát.
Adás és változatok kiválasztása
A HIV-1 terjedése szexuális, parenterális vagy vertikális fertőzés útján történhet (Lamers et al., 1993; Mulder-Kampinga et al., 1993; Pang et al., 1992; Scarlatti et al., 1993; Wolfs et al. al., 1992; Wolinsky és mtsai, 1992; Zhang és mtsai, 1993; Zhu és mtsai, 1993). Ezek mindegyike különálló környezetet képvisel, és ezért a vírusvariánsok kiválasztását befolyásoló tényezők külön csoportját. A HIV-1 szelekciót befolyásoló tényezőkre összpontosító kutatás számos kérdéssel foglalkozott, kezdve a sztochasztikus versus szelektív transzmissziós modellektől, az egy vagy több változat közötti átvitelektől, a sejtmentes és a sejtekhez társított vírus átviteltől, a variánsok átvitelének korlátozására vonatkozó szelekciós kritériumoktól és a variánsok szétosztásától a gazdagépeken belül az átvitel során elfogult változatválasztás.
A vertikális transzmissziót vagy az anya-gyermek transzmissziót (MTCT) szintén alaposan tanulmányozták, és a kutatás hasonló kérdésekkel próbált foglalkozni, mint a szexuális transzmisszióval. Az MTCT esetében azonban további tényezőkréteg merül fel az átviteli esemény időbeli jellegét illetően. Pontosabban, előfordul-e az átvitel a szülés előtt (in utero), az intrapartumban (szüléskor) és/vagy a szülés után (szoptatással), és ha van ilyen hatása, annak milyen változása van a transzmissziós profilokra? Tanulmányok kimutatták, hogy a vírus átterjedése a terhesség ezen fázisaiban is előfordulhat, de a változat átvitelére gyakorolt hatás továbbra is megfoghatatlan (Courgnaud et al., 1991; Ehrnst et al., 1991; De Rossi et al., 1992; Lepage et. al., 1987; Soeiro és mtsai, 1992; Ziegler és mtsai, 1985). A szexuális terjedéshez hasonlóan a major, a minor és a multiple variáns transzmissziós események is láthatók az MTCT esetekben (Dickover et al., 2001; Kliks et al., 1994; Lamers et al., 1994; Narwa et al., 1996; Nowak et al., 2002; Briant és mtsai, 1995; Pasquier és mtsai, 1998; Wade és mtsai, 1998; van't Wout és mtsai, 1994). A legtöbb tanulmány azonban az egyváltozatú transzmissziós eseményeket és nagyobb homogenitást talált az újonnan fertőzött gyermeken belül, összehasonlítva az anyával, ami szelektív nyomásra utal az átvitel során (Dickover et al., 2001; Becquart et al., 2002; Nowak et al., 2002; Wike és mtsai, 1992; Wolinsky és mtsai, 1992; Mulder-Kampinga és mtsai, 1993; Ahmad és mtsai, 1995; Roth és mtsai, 1996; Scarlatti és mtsai, 1993). Az, hogy ezek a szelektív kritériumok megegyeznek-e vagy hasonlóak-e a szexuális transzmisszióban résztvevőkkel, továbbra sem ismert.
Kvázi faj evolúció az átvitel után
Miután sikeres transzmissziós esemény történt, a vírusgenom mutációi, a gazda immunnyomása és a célsejtek elérhetősége a HIV-1 diverzifikálódását és evolúcióját hajtja végre, ami végül olyan vírusvariánsokat eredményez, amelyek eltérnek az alapító szülővírusokétól. Noha a replikációs kapacitás kezdetben kismértékben csökkenhet, ezek az új variánsok képesek elkerülni a gazdaszervezet immunvédelmét, fennmaradni, és végül a CD4 + T-sejtek kimerülését és az AIDS-be történő progressziót elősegíteni.
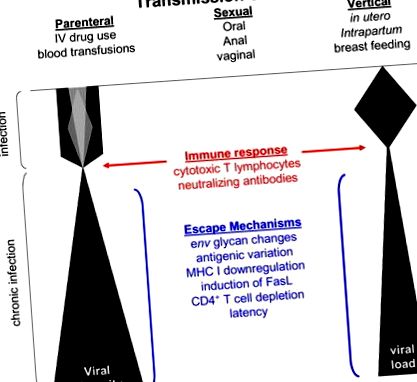
A HIV-1 evolúciója gyors a magas vírusreplikációs arány, a fordított transzkriptáz hibára hajlamos replikációja miatt (Coffin, 1995; Mansky és Temin, 1995; Preston és mtsai, 1988; Roberts és mtsai, 1988), gazda RNS polimeráz II (Laakso és Sutton, 2006), rekombinációs események a HIV-1 vírusok együttfertőződése között (Charpentier et al., 2006; Coffin, 1995; Jung et al., 2002; Kemal et al., 2003; Levy et al., 2004; Philpott et al., 2005; van Rij et al., 2003; Zhuang et al., 2002) és a vírusvariánsok gyors immunrendszer által közvetített szelekciója (Jung és mtsai, 2002; Williamson és mtsai., 2005). Ezen események kombinációja folyamatosan hajtja a HIV-1 sokféleséget a fertőzött gazdaszervezetekben (1. ábra). Azonban a vírusgenomba beépíthető mutációkra korlátozások vonatkoznak a vírusreplikációban részt vevő kódolt fehérjék szerkezeti és funkcionális követelményei miatt (Draenert et al., 2006).
A vírus sokféleségében és a vírusterhelésben bekövetkezett változásokat bemutató vázlatos diagram a fertőzés során. A vírusdiverzitás mennyiségét az átvitelkor vagy röviddel az átvitel után az elsődleges fertőzés különböző árnyalatai jelzik. Megmutatják azokat a tényezőket, amelyek befolyásolhatják a vírus sokféleségét, szelekcióját és perzisztenciáját.
A fertőzés kezdeti szakaszában a kiválasztott mutációk az immunmenekülést támogatják, nem pedig a fokozott vírusreplikációt (Martinez-Picado et al., 2006; Leslie és mtsai, 2004; Goepfert és mtsai, 2008). Azonban a fertőzés tünetmentes krónikus stádiumának végén, amikor az immunnyomás megszűnik az immunsejtek megsemmisítésével vagy az immunválasz kimerülésével, a vírusreplikációt fokozó mutációk megjelennek vagy újból megjelennek a víruspopulációban (Mild et al., 2007). Ezek az adatok arra utalnak, hogy a fertőzés korai szakaszában a mutációkat az immun megkerülése, nem pedig a fokozott vírusreplikáció alapján választják ki, míg a fertőzés későbbi szakaszaiban a patogénebb, de kevésbé immunmegkerülő vírusok vezetik a betegség előrehaladását. Ezt a hipotézist támasztják alá a makákókban végzett SIV-tanulmányok, ahol fitneszköltség van a CTL-válaszok elől való meneküléshez már a fertőzés után (Friedrich et al., 2004). Idővel azonban megnövekedett replikációs kapacitású változatok jelennek meg, és végül a betegség progresszióját hajtják végre (Kimata és mtsai, 1999; Rudensey és mtsai, 1995).
Az AIDS-betegség progressziójának további korrelációi közé tartozik a szinonim szubsztitúciós arányok lassabb aránya, ami általános, nem szelektív mutációs ráta jelzésére utal (Lemey és mtsai, 2007; Stilianakis és Schenzle, 2006), fokozott vírusreplikáció (Kimata és mtsai, 1999; Birch és mtsai, 2001; Dyer és mtsai, 1999; Kirchhoff és mtsai, 1995; Learmont és mtsai, 1999), tartós immunaktiváció (Bofill és mtsai, 1996; Grossman és mtsai, 2006; Giorgi és mtsai. ., 1999; Sousa és mtsai, 2002), széles tartományú CTL válaszok (Karlsson és mtsai, 2007; Fernandez és mtsai, 2007) és specifikus gazda humán leukocita antigén (HLA) I. osztályú allélek (Carrington és mtsai., 1999; Trachtenberg és mtsai, 2003).
A patogenitás összefüggései: fenotípusos változások a vírusfertőzés során
A HIV-1 fenotípusos jellemzői, amelyeket a betegség progressziójával összefüggésben alaposan megvizsgáltak, magukban foglalják a replikációs képességet (más néven replikációs alkalmasságot), amelyet általában gyorsnak/magasnak vagy lassúnak/alacsonynak minősítenek a vírus replikációjával és termelésével kapcsolatban ( De Rossi és mtsai, 2005; De Rossi és mtsai, 1993; Connor és mtsai, 1993), syncytium indukció, nem syncytium indukáló (NSI) vagy syncytium indukáló (SI) vírusnak minősítve (Koot et al., 1992; Jurriaans et al., 1994), a ko-receptorok használata, a vírusvariánsok túlnyomó többségével CCR5-t használó (R5), CXCR4-használó (X4) vagy kettős-tropikus (R5X4) vírusok közé sorolják (Littman, 1998; Doms és Peiper, 1997) és makrofág-tropikus (M-tropikus) vagy T-sejt-tropikus (T-tropikus) variánsok. Korábban úgy gondolták, hogy ezek a fenotípusos jellemzők szorosan kapcsolódnak egymáshoz, így a gyors/magas vírusvariánsok szintén SI, X4, T-tropikus változatok, a lassú/alacsony vírusok pedig NSI, R5, M-tropikus variánsok (Alkhatib et al., 1996a; Tersmette és mtsai., 1988; Tersmette és mtsai., 1989). Bár van összefüggés a társreceptor-használattal, az SI-képességgel és a tropizmussal, ezek egymástól elválasztható fenotípusos jellemzők, ezért a vírusizolátumok jellemzése során egyedileg kell vizsgálni őket (Aquino-de Jesus et al., 2000; Peters et al. 2006).
Az átvitel után az R5-tropikus vírusok jellemzően a fertőzések korai szakaszában vannak túlsúlyban (Connor et al., 1997). Az azonban továbbra sem tisztázott, hogy az R5 vírusok az egyetlen átvitt vírusok, vagy mind az R5, mind az X4 vírusok átvihetők, de az X4 vírusok kevésbé alkalmasak, ami azt eredményezi, hogy a fertőzés korai szakaszában csak R5 variánsokat detektálnak. Ezek a vírusizolációs vizsgálatok azt is mutatják, hogy az X4 és a kettős trópusi vírusok csak nagyon későn mutathatók ki a fertőzésekben a tünetmentes fertőzésből az AIDS-be történő átmenetkor. Morever szerint az X4 variánsok csak az esetek 50% -ában találhatók meg (Berger et al., 1999), ami azt bizonyítja, hogy az X4 variánsok nem szükségesek az AIDS progressziójának elősegítéséhez (Campbell et al., 2003; Kimata et al., 1999; Kwa et al. al., 2003; Koot és mtsai, 1993; Tersmette és mtsai, 1989).
Kísérleti bizonyítékok vannak arra, hogy az X4 variánsok érzékenyebbek lehetnek a CD8 + citotoxikus T-sejtek általi kontrollra, mint az R5 vírusok (Harouse et al., 2003). Az elsődleges fertőzés során gyorsan megválaszolhatók az X4 variánsok, lehetővé téve az R5 variánsok megjelenését és dominálását a fertőzésben. Így a fertőzés későn megjelenő X4 vírusok nem feltétlenül vezetik a betegség előrehaladását, inkább a kimerült és diszfunkcionális immunrendszer mutatóiként szolgálnak, ami lehetővé teszi a vírusok ellenőrizetlen replikációját és a fennmaradó CD4 + T sejtpopuláció megsemmisítését.
A sejttropizmust kiterjedten tanulmányozták in vivo és in vitro is. A jelenlegi modell szerint az átvitel korai szakaszában az M-tropikus vírusok vannak túlsúlyban, mivel úgy gondolják, hogy a szövetben rezidens makrofágok, monociták és dendritikus sejtek a kezdeti sejtcélok a tényleges átviteli esemény során. Míg ezeknek a sejttípusoknak a fertőzése továbbra is fontos marad a betegség progressziója során a látensen fertőzött sejtpopulációk tekintetében (Aquino-de Jesus et al., 2000), a sejttrópia elmozdulása korán és gyorsan bekövetkezik, mivel a vírus a a nyirokszövetek fertőzése, ahol a CD4 + T sejtekben robusztus replikáció valósulhat meg.
Végül úgy tűnik, hogy az átvitel során megválogatják az NSI-variánsokat (van't Wout és mtsai, 1994; Zhu és mtsai, 1993; Tersmette és mtsai, 1988; Keet és mtsai, 1993), de vajon a fenotípus megváltozik-e az átvitt NSI vírustól az SI változatig fontos az AIDS-hez való továbbjutás szempontjából, további kutatást igényel. A virológiai vizsgálatok azt mutatják, hogy az AIDS progressziójához nem szükséges az NSI-ről SI fenotípusra váltani (Fitzgibbon et al., 1998; Spencer et al., 1994), de növelheti az AIDS progressziójának sebességét (Fauci, 1996; Glushakova et al., 1998).
E fenotípusos jellemzők megjelenésének egyszerű magyarázata a fertőzés során az, hogy amint a vírusdiverzitás növeli az AIDS progressziójának sebességét, ezáltal a diverzitás, amint ezt a fenotípusok megjelenése jelzi, nem pedig a megfelelő fenotípusok funkciói hajtják az AIDS-t progresszió (Sagar et al., 2003). Ezért nem lehet önmagában az X4 és SI vírusvariánsok jelenléte, hanem a gazda immunválasz által okozott szelektív nyomás gyengülése általános vírusreplikáció esetén, lehetővé téve a korábban immunválaszra célzott fenotípusok kinövését, amelyek egyszerűen csak a gyengült és diszfunkcionális immunválasz (Troyer et al., 2005).
A fenotípust megváltoztató vírus-determinánsok
A vírusvariánsok közötti fenotípusos különbségeket tanulmányozták, és a vírusgenom specifikus régióihoz térképezték fel, beleértve az env-t, a pol-t és a nef-et. Az env gén a vírusreplikatív alkalmasság meghatározó tényezője, mivel fehérje termékei, a gp120 és a gp41, közvetítik a sejtek kötődését a receptoron és társreceptorokon keresztül, valamint a sejtplazma membrán és a vírusmembrán burok fúzióját (Baribaud és Doms, 2001; Berger et al., 1999; Poignard és mtsai, 2001). Számos tanulmány dokumentálta, hogy az env szekvenciák befolyásolják a vírus átterjedését (Hsu és mtsai, 2003; Tersmette és mtsai, 1988), a sejttropizmust (Berger, 1997; Hoffman és Doms, 1999; Alkhatib és mtsai, 1996b; Choe és mtsai., 1996; Deng és mtsai., 1996), és a gazda immunválaszának fő célpontjai (Levy, 1993; Richman és mtsai, 2003; Wei és mtsai, 2003b), beleértve mind a CTL-t, mind a semlegesítő antitest-válaszokat (Jones és mtsai., 2004; Borrow és mtsai, 1997; Geels és mtsai, 2003). Továbbá az env szekvenciáknak tűnik a legnagyobb hatással a kompetitív vírusreplikatív alkalmasságra in vitro, összehasonlítva a vírusgenom többi régiójával (Ball et al., 2003).
Modellrendszerek a vírus fenotípusának és fitneszének mérésére
A vírusfenotípus és a replikatív alkalmasság összefüggései megtalálhatók az irodalomban. A fenotípus és fenotípusos változások (pl. Tropizmus, fertőzőképesség és szinkitiaindukáló képesség) meghatározására szolgáló legtöbb vizsgálatot azonban általában in vitro egyszeri vírusreplikációs vizsgálatokban végzik. A fitnesz klasszikus meghatározása szükségszerűen megkövetelte a korlátozott erőforrásokért folyó közvetlen verseny bizonyos aspektusait; ezért az egyvírusos fertőzések és vizsgálatok nem alkalmasak arra, hogy közvetlenül megválaszolják, hogy egy vírusvariáns jobban illeszkedik-e egy adott környezetbe, szemben egy másik változattal ugyanabban a környezetben. Viszonylag kevés tanulmányban kombinálták a vírusfenotípus és a kettős vírus replikációs vizsgálatait a vírusvariáns fitneszének meghatározására.
A HIV-1 fitnesz in vivo vizsgálatának korlátai miatt a makákók SIV-vel való fertőzése kritikus modell maradt a HIV-1 fitneszre és patogenezisre vonatkozó kérdések feltárásában. A modellrendszer lehetővé teszi a vírus fitnesz pontszámok beépítését változó célsejtpopulációk, immunválasz és gazdaszervezet variabilitás jelenlétében, valamint egy rokon lentivírussal való fertőzés összefüggésében. Ez lehetővé teszi az alkalmasság vizsgálatát is ismert in vitro fenotípusú és in vivo patogenitású változatokkal. Egy nemrégiben készült tanulmány kimutatta, hogy a megnövekedett replikációs kapacitással és patogenitással rendelkező SIV-variáns nagyobb versenyképes vírusreplikációs alkalmasságot mutatott in vitro a lassabban replikálódó és minimálisan patogén szülőklónhoz képest (Voronin és mtsai, 2005). Az ilyen típusú vizsgálatok fontos kísérleti bizonyítékokkal szolgálnak azon hipotézis alátámasztására, miszerint a vírus fitnesze befolyásolja a HIV-1 patogenezisét.
A makákó modellrendszert a kettős vírusfertőzés gazdaszervezetben történő hatásainak tanulmányozására is alkalmazták. Ezek a vizsgálatok elsősorban R5- és X4-tropikus SHIV kiméra konstrukciókat alkalmaztak (Burke és mtsai, 2006; Wolinsky és mtsai, 2004; Otten és mtsai, 1999). Ezek a kettős vírusfertőzéses vizsgálatok létfontosságúak a vírus alkalmasságának megértéséhez a fertőzés teljes kontextusában, ahol mind a vírus, mind a gazda tényezők jelen vannak, és befolyásolják a változatok fitnesz kimeneteleit. Kevés tanulmányt végeztek azonban kettős vírusfertőzések alkalmazásával a variánsok relatív alkalmasságának specifikus tanulmányozására, és hogy mely meghatározók képesek fitnesz előnyöket biztosítani a fertőzés és a betegség különböző szakaszaiban (Harouse et al., 2003). Ezenkívül ezek a vizsgálatok az R5-tropikus és X4-tropikus vírusokkal folytatott versenyekre korlátozódtak. Különböző variánsokkal végzett további vizsgálatok, köztük az eltérő fenotípusú R5-tropikus vírusok, tovább erősítenék a transzmissziót, perzisztenciát és betegségeket befolyásoló vírus-determinánsok megértését.
KÖVETKEZTETÉS
Úgy tűnik, hogy a HIV-1 átvitel útja bizonyos mértékben meghatározza a vírusvariánsok típusát és számát, amelyek az újonnan fertőzött gazdaszervezet vírusainak alapító populációját tartalmazzák. Különösen érdekesek, amint azt fentebb tárgyaltuk, azok a szempontok, amelyek a szelekciót kontrollálják az átvitel során, ahol különböző tényezők, a hüvelyüregbe csapdázott vírusok érintkezésének idejétől a végbélszövetekig, a sejtmentes virionoktól a sejttel társult vírusokig, a gp120-on található glikozilezési mintákig., úgy tűnik, hogy befolyásolják a továbbított vírusok számát és típusát. Ezenkívül a gazdaszervezet immunválaszai és a fertőző változatok megfelelő ellenvédelme, amelyek lehetővé teszik az immunválasz elkerülését, a kopás környezetét jelentik. Míg az immunválasz ereje kezdetben meghatározhatja a vírus alapértékeit és a CD4 + T-sejtek veszteségének mértékét, a látencia és a magas mutabilitás lehetővé teszi a HIV-1 számára, hogy felforgassa a gazdaszervezet néhány immunválaszát és elkerülje az egyéb immunválaszokat, ami a CD4 + mélységes kimerüléséhez vezet. T-sejt populációk és az AIDS kialakulása.
A vírusfenotípusok és a patogenitás összefüggése a vírusgenomon belül a replikációt és a perzisztenciát befolyásoló érdeklődésre számot tartó régiók azonosítását eredményezte. A versenyképes replikációs alkalmasságra vonatkozóan további vizsgálatokra lesz szükség, hogy tovább világítsák e változások jelentőségét a vírus alkalmasságában a fertőzés korai és késői szakaszában. Ebben a tekintetben a makákók SIV variánsokkal történő fertőzésére lesz szükség ahhoz, hogy felbecsülhetetlen eredményeket nyújtsunk a transzmisszió és a patogenezis fitnesz determinánsainak megfejtéséhez.
Köszönetnyilvánítás
J. T. K.-t az NIH R01 AI047725 támogatás, T. B.-t pedig egy NIH molekuláris virológiai képzési támogatás (T32-AI07471) támogatja.
- Hipokinetikus betegség kockázati tényezői - testmozgás és fitnesz
- A gomba hiányzik-e az elhízás és a modern betegségek ellen - Dre Fitness
- A gastrooesophagealis reflux betegség összefügg a szívbetegséggel
- A gastrooesophagealis reflux betegség összefügg a szívbetegséggel; Cikk; Az Egyesült Államok hadserege
- Címkeolvasás; az FDA Celiac Disease Foundation