Kartogeninbe épített termogél intraartikuláris injekciója az osteoarthritis fokozásában
Shao-Jie Wang
1 Ízületi Sebészeti és Sportorvosi Osztály, Hsziamen Egyetem Zhongshan Kórház, Hsziamen, Kína
Ji-Zheng Qin
1 Ízületi Sebészeti és Sportorvosi Osztály, Hsziamen Egyetem Zhongshan Kórház, Hsziamen, Kína
Tong-En Zhang
2 Xiamen Egyetem Orvostudományi Kar, Xiamen, Kína
Chun Xia
1 Ízületi Sebészeti és Sportorvosi Osztály, Hsziamen Egyetem Zhongshan Kórház, Hsziamen, Kína
Társított adatok
A kézirat következtetéseit alátámasztó nyers adatokat a szerzők indokolatlan fenntartások nélkül hozzáférhetővé teszik bármely képesített kutató számára.
Absztrakt
Bevezetés
Az osteoarthritis (OA) egy általános degeneratív ízületi patológia, amely világszerte 151 millió embert érint. A gyógyszerek intraartikuláris injekcióit általában használják az ízületek biohasznosulásának javítására, miközben minimalizálják a szisztémás szövődményeket. Nemrégiben arról számoltak be, hogy egy kis molekula, a kartogenin (KGN) elősegíti a kollagén szintézist (Johnson, 2012). Beszámoltak arról, hogy a KGN intraartikuláris injekciója fokozza a porcregenerációt (Kang és mtsai, 2014; Mohan és mtsai, 2016; Fan és mtsai, 2018). A KGN azonban nem képes hosszú távú terápiás hatást biztosítani a KGN gyors kiürülése és rövid visszatartása miatt az ízületekben, ami hátrányt jelent klinikai alkalmazásában. Az ízületekben lévő kezelési szerek tartózkodási idejének javítása érdekében a kutatók hidrogéleket alkalmaztak a hatóanyag-leadáshoz és a gyógyszer-kontroll felszabadításához (Seliktar, 2012).
Poli (laktid-ko-glikolid) –poli (etilén-glikol) -poli (laktid-ko-glikolid) (PLGA – PEG – PLGA) triblock kopolimert alkalmaztak a termogél mátrixaként, és alacsony hőmérsékleten vízben oldódhat (pl. 4 ° C), és az oldat a testhőmérséklet körül gélesedik (azaz 37 ° C) (Yu et al., 2011; Li et al., 2012; Wang et al., 2016c, 2019; Zhang et al., 2019). Tekintettel a bioaktív molekulák eljuttatásának és minimálisan invazív módjának előnyeire, a jelenlegi tanulmányban PLGA – PEG – PLGA kopolimert alkalmaztunk az intraartikuláris injekcióhoz a KGN terápiás koncentrációjával beépített termogél előállítására. A KGN termogél rendszert in vitro és in vivo értékeltük az OA kezelés lehetőségének vizsgálatára. IL-1β-val előkezelt kondrocitákat tenyésztettünk az OA kondrociták utánzására (Cui et al., 2016), hogy megvizsgáljuk a KGN termogél OA kondrocitákra gyakorolt hatását a porcmátrix termelés és lebontás szempontjából. Ezután a PLGA – PEG – PLGA termogélt KGN-nel vagy anélkül injektálták nyulak OA térdeire, hogy megvizsgálják a KGN termogél OA-ra gyakorolt hatását.
Anyagok és metódusok
PLGA – PEG – PLGA Thermogel készítmény
A PLGA – PEG – PLGA triblock kopolimereket a (Daigang Co., Ltd., Jinan, Shandong, Kína) cégtől vásároltuk. A kopolimereket az L-LA és GA gyűrűnyitási polimerizációján (ROP) keresztül szintetizálták PEG-vel makroiniciátorként és Sn (Oct) 2 katalizátorként, amint arról korábban beszámoltunk (Wang et al., 2016c). A PEG és a PLGA Mns-értéke 1500, illetve 1400 g/mol volt. Az L-LA és GA moláris aránya a PLGA szegmensben 75:25. A PLGA – PEG – PLGA triblock kopolimereket PBS-ben (pH 7,4) oldjuk, így 20 tömeg% géloldatot kapunk, amelyet azután 4 ° C-on tartunk, mielőtt felhasználnánk a következő kísérletekben. A PLGA-PEG-PLGA termogél szol-gél átmeneti viselkedését 37 ° C-on 15 percig tartó inkubálással igazoltuk.
A KGN Thermogel elkészítése
Tíz milligramm KGN-t (Selleck Chemicals, Sanghaj, Kína) 0,6 ml dimetil-szulfoxidban (DMSO) oldunk, majd PBS-sel (pH 7,4) hígítjuk, így 5 mM KGN munkaoldatot kapunk. A KGN termogélt 100 μl 5 mM KGN oldat és 10 ml PLGA-PEG-PLGA géloldat összekeverésével állítottuk elő, hogy 50 μM KGN-t tartalmazó KGN géloldatot kapjunk. Kontrollként PLGA-PEG-PLGA géloldatot használtunk KGN nélkül.
In vitro KGN-kibocsátás
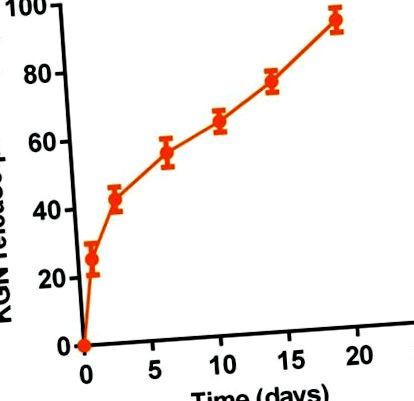
A KGN termogélből történő in vitro tartós felszabadulását ultramikro UV spektrofotométerrel (Nanodrop 2000) határoztuk meg. Röviden: 1 ml 20 tömeg% -os termogél vagy KGN termogél oldatot egy 16 mm belső átmérőjű fiolába tettünk gélesedés céljából 37 ° C-on. Ezután 2 ml PBS-t adunk a gél tetejére. A felülúszót meghatározott időközönként (0,0, 1,0, 3,0, 7,0, 11,0, 15,0 és 20,0 nap) gyűjtöttük össze. Ezután további 2 ml PBS-t cserélünk. Standardként a KGN PBS-oldatban való koncentrációját alkalmaztuk. A mérést 277 nm detektálási hullámhosszal végeztük. A felszabadult KGN mennyiségét az egyes időpontokban az 1 ml 20 tömeg% termogél vagy KGN termogél oldat teljes KGN-tartalmának százalékában számítottuk.
A kondrociták izolálása és tenyésztése
Kéthónapos, 1,5 kg körüli, új-zélandi felnőtt nyulakat feláldoztunk a kondrociták izolálására, amint azt korábban említettük (Wang et al., 2016a). Az elsődleges kondrocitákat a térd és a váll porcából gyűjtöttük össze. Először a darált porcot emésztettük 6 órán át 10 ml 0,2 tömeg/térfogat% -os 2-es típusú kollagenáz (Gibco BRL Co. Ltd.) oldatokban 37 ° C-on. A kapott sejtszuszpenziót centrifugáltuk és újraszuszpendáltuk alacsony glükózszintű DMEM-ben, amelyet 10% FBS-sel (HyCloneTM, Thermo Scientific, Ausztrália), valamint 1% penicillinnel és sztreptomicinnel egészítettünk ki. Az izolált kondrocitákat egyrétegű tenyészetekben tenyésztettük, párásított inkubátorban, 37 ° C-on, 5% CO2-nál és 21% O2-nál. A passzázs 2 kondrocitákat alkalmaztuk a következő kísérlethez.
IL-1β-val kezelt kondrociták
A passzív 2-hez tapadó, 60–70% -os összefolyást elérő nyúl kondrocitákat szérum-éhezett táptalajjal (1% FBS-sel kiegészített DMEM/F12) tenyésztettük 12 órán át, majd IL-1β-val (10 ng/ml) kezeltük 2 órán át. a következő in vitro kísérleteket.
Nyúl térd OA modell kialakítása
Ezt a vizsgálatot az Országos Egészségügyi Intézet laboratóriumi állatok gondozására és felhasználására vonatkozó útmutatójának megfelelően végezték el. A protokollt a Hsziamen Egyetem állatkísérlet-etikai bizottsága hagyta jóvá. Az elülső keresztszalag transzkciós (ACLT) eljárást a térd OA modelljének kiváltására végeztük, amint arról korábban beszámoltunk (Liu et al., 2016). Az új-zélandi fehér nyulakat (n = 24, 5 hónapos, tömeg 2,5–3,0 kg) ezután két csoportra osztották (színlelt és ACLT). Az altatás és a rutin előkészítés után 18 nyulat hajtottak végre ACLT-vel a bal térden, hat nyulat pedig színlelt műtéten. Az ACLT után 3 héttel a nyulakat véletlenszerűen három csoportra osztottuk (mindegyik csoportban hat nyulat) sóoldat, termogél vagy KGN termogél intraartikuláris injektálására. Az álműtét után 6 héttel vagy az intraartikuláris injekció után 3 héttel minden csoportban a bal térdeket beszedtük szövettani elemzés céljából, és szinoviális folyadékot gyűjtöttünk az interleukin-1 (IL-6) és az MMP-13 elemzéséhez, a térdgyulladás értékelésére.
IL-1β-val kezelt kondrociták in vitro tenyésztése KGN Thermogelben
Az 5,0x105 IL-1β-vel kezelt kondrocitákat tartalmazó sejtszuszpenziót 100,0 μl termogél vagy KGN termogél oldattal 4 ° C-on összekevertük, majd 24 lyukú lemezre helyeztük. Az összekevert sejtek-kopolimer oldatot 37 ° C-on 15 percig inkubáltuk gélesedés és a sejtek kezdeti rögzítése céljából. 2,0 ml friss DMEM-et adunk hozzá 10% (V/V) FBS-sel (HyCloneTM, Thermo Scientific, Ausztrália), valamint 1% penicillinnel és sztreptomicinnel (Invitrogen, Carlsbad, CA, USA).
A sejtproliferációs vizsgálat és a DNS-tartalom elemzéséhez a sejtekkel terhelt termogélt 1 hétig tenyésztettük DMEM-ben. A táptalajt 2 naponta cseréltük. A sejtek szaporodási aktivitását az 1., 5. és 7. napon mértük Cell Counting Kit-8 assay-vel (CCK-8; Dojindo Laboratories, Kumamoto, Japán) a gyártó utasításainak megfelelően. Röviden, a sejttenyészetet (n = 3) óvatosan öblítettük PBS-sel, majd 10,0 μl CCK-8 reagens és 90,0 μl friss táptalaj kevert oldatába 37 ° C-on 2 órán át kevertük. Az abszorbancia-leolvasásokat 450 nm-en tányérolvasóval figyeltük meg.
Biokémiai elemzés
A KGN termogél OA kondrocitákra gyakorolt hatásának feltárására megmértük az OA kondrocitákból kiválasztott mátrix degradációs enzimet (MMP-13), extracelluláris mátrix komponenst [2-es típusú kollagén (COL-2) és glikozaminoglikán (GAG)]. Röviden, a mintákat egy előre elkészített, 0,5 M EDTA-t, 0,05 M cisztein-hidrokloridot és 1,0 mg/ml papain enzimet (Sigma, St. Louis, MO, USA) tartalmazó papainoldatban emésztettük 60 ° C-on 12 órán át. A minta emésztésének alikvotjait használtuk fel a DNS és a GAG mérésére, amint arról korábban beszámoltunk (Wang et al., 2016a). A DNS-tartalmat fluoreszcencia vizsgálattal mértük. A teljes glikozaminoglikán (GAG) tartalmat 1,9-dimetil-metilénkék (DMMB; Sigma, St. Louis, MO, USA) festékkötési vizsgálattal határoztuk meg. Az IL-1β-vel kezelt kondrociták táptalaját 3 hét KGN termogélben történő tenyésztés után gyűjtöttük össze. A felülúszót 12 000 fordulat/perc sebességgel 10 percig végzett centrifugálással választottuk el az oldhatatlan maradéktól. Nyúl MMP-13 és COL-2 ELISA készleteket (Cloud-Clone, Corp., Houston, TX, USA) használtunk a COL-2 és MMP-13 mérésére a gyártó utasításai szerint. A GAG, COL-2 és MMP-13 koncentrációkat a DNS-tartalomra normalizáltuk, amelyet fluorometriásan meghatároztunk Hoechst festéssel, a korábban leírtak szerint (Wang et al., 2016a).
A génexpressziós elemzések
A KGN OA kondrocitákra gyakorolt hatásának értékeléséhez megmértük az ízületi gyulladással kapcsolatos gének és a porccal kapcsolatos gének expresszióját. A génexpressziókat valós idejű polimeráz láncreakcióval (RT-PCR) detektáltuk, amint arról korábban beszámoltunk (Wang et al., 2016a). Az előre kijelölt időpontokban a mintákat (n = 3) Trizol Reagensben (Invitrogen, Carlsbad, CA, USA) szövetdarálóval homogenizáltuk, és az RNS-t a gyártó utasításainak megfelelően extraháltuk. Az izolált RNS-koncentrációt ND-2000 spektrofotométerrel (Nanodrop Technologies) határoztuk meg. Mindegyik mintából egy mikrogramm RNS-t fordítottunk át cDNS-be az MMLV Reverse kit (Promega, Madison, WI, USA) segítségével, és az RT-PCR elemzést ABI 7300 valós idejű PCR rendszerrel (Applied Biosystems, Foster City, CA) hajtottuk végre., USA) a SYBR Green PCR Master Mix-el (Toyobo, Oszaka, Japán). A relatív génexpressziót hajtáskülönbséggel fejeztük ki, amelyet 2 ΔΔCT-nek számítottunk. Ezeknek a célgéneknek a relatív expressziós változásait úgy számszerűsítettük, hogy expressziójukat normalizáltuk a glicerinaldehid-3-foszfát-dehidrogenáz (GAPDH) háztartási génjével. 1. típusú kollagén (COL-1), 2. típusú kollagén (COL-2), aggrekán (AGC), MMP-13 és GAPDH PCR-primereit az 1. táblázat tartalmazza .
Asztal 1
Valós idejű PCR-hez használt primer szekvenciák.
| COL-1 | TGGCAAGAACGGAGATGACG | GCACCATCCAAACCACTGAA |
| COL-2 | CCACGCTCAAGTCCCTCAAC | AGTCACCGCTCTTCCACTCG |
| AGC | CGTGGTCTGGACAGGTGCTA | GGTTGGGGTAGAGGTAGACG |
| MMP-13 | TTGACCACTCCAAGGACCCAG | GAGGATGCAGACGCCAGAAGA |
| GAPDH | CCATCACCATCTTCCAGGAG | GATGATGACCCTTTTGGCTC |
Col-1, 1. típusú kollagén; Col-2, 2. típusú kollagén; AGC, aggrecan; MMP-13, mátrix metalloproteináz 13; GAPDH, glicerinaldehid-3-foszfát-dehidrogenáz.
Szövettani elemzés
Három hétig tartó intraartikuláris injekció után a nyulak minden csoportját eutanázzuk pentobarbitál-nátrium túladagolásával. A distalis combcsontot reszekcióval végeztük szövettani értékelés céljából. Nem volt ízületi fertőzés minden térdnél. A térdízületek gyulladásának értékeléséhez szinoviális folyadékot gyűjtöttünk az interleukin-6 (IL-6) és az MMP-13 elemzéséhez. Boncolás és rögzítés után a mintákat 15% EDTA-ban (pH 7,2 PBS-ben), 5% paraformaldehiddel, 4 ° C-on dekalkilizáltuk. A vízkőmentesített mediális kondíliákat ezután levágjuk, fokozatmentes etanol-sorozatban dehidratáljuk és paraffinba ágyazzuk. A metszeteket H&E-vel, TB-vel (pozitív a proteoglikánoknál) és immunhisztokémiai (IHC) festéssel (pozitív a COL-2-nél) festettük. A COL-2 kimutatásának protokolljait a fenti szakaszok írták le. A szövettani metszeteket vakon vizsgáltuk a porc pusztulásának kvantitatív értékelése céljából az Osteoarthritis Research Society International (OARSI) pontozási rendszer segítségével (Pritzker et al., 2006).
Statisztikai analízis
In vitro tartós KGN felszabadulás a KGN termogélből (20,0 tömeg%) PBS-ben (pH 7,4) 37 ° C-on (n = 3).
A sejtek életképessége és proliferációja
A tenyésztő tápközegben 72 órán át végzett tenyésztés után a CCK-vizsgálat azt mutatta, hogy az OA kondrociták mind a PLGA-PEG-PLGA termogélben, mind a KGN termogélben szaporodtak, megnövekedett proliferációt mutattak az in vitro tenyésztés 7 napja alatt (2A. Ábra). Az OA kondrociták száma azonban a termogélben és a KGN termogélben a 7. napon nem különbözött szignifikánsan az 1. napon mért értéktől (p> 0,05). Nevezetesen az MSC-k száma a KGN termogélben kissé meghaladta a termogélben található értékeket.
In vitro sejtproliferáció és mátrix komponens termelés. (A) A CCK-8 vizsgálat kimutatta, hogy az IL-1β-val kezelt kondrociták proliferációja a termogélben vagy a KGN termogélben idővel növekedett (B) A GAG-tartalmat DMMB assay-vel mértük, a COL-2-t és az MMP-13-t ELISA-val határoztuk meg, miután az IL-1β-vel kezelt kondrocitákat 2 hétig termogélben vagy KGN thermogélben tenyésztettük (n = 3, * P 2B. Ábra). A KGN termogélben szignifikánsan nagyobb mennyiségű GAG és COL-2 volt kimutatható, mint a termogél csoportban (p 3. ábra). A COL-2 és az AGC hialin-porc specifikus gének nagyobb mértékű szabályozását detektáltuk a KGN termogél rendszerében, mint a KGN nélküli termogélben (p. 4. ábra). Enyhe porc degenerációt figyeltek meg a chondrocyta hipertrófiával és klaszterrel rendelkező álcsoportban. Fontos megjegyezni, hogy az OA + KGN gélcsoportban a KGN termogél kifejezett kondroprotektív hatását figyeltük meg, amely a felszíni porc sekély függőleges repedéseit, lokalizált proteoglikán-kimerülést és részleges COL-2 veszteséget mutatott a porc korlátozott zónáiban. Összehasonlításképpen, mind az OA, mind az OA + termogél csoportok súlyos OA változásokat mutattak, jelentős porc denudációval és deformációval, valamint markáns proteoglikán és COL-2 kimerüléssel. Ezek az adatok arra utaltak, hogy a KGN IA injekciója gyulladáscsökkentő hatást mutatott és elősegítette a porc regenerálódását, összehasonlítva az IA sóoldat vagy termogél injekcióval.
Sóoldattal (OA), termogéllel (OA + gél) és KGN termogéllel (OA + KGN gél) kezelt OA térd szövettani festése az ACLT műtét után 6 héttel. (HIRDETÉS) Ő, (K – H) toluidinkék (TB) és (I – L) immunhisztokémiai (IHC) COL-2 festés.
ELISA módszer az IL-6 és MMP-13 tartalom kimutatására az összes csoport szinoviális folyadékában 6 héten át (n = 8, * p 6. ábra, az OARSI pontszámok szignifikánsan alacsonyabbak voltak az álcsoportban és az OA + KGN csoportban, mint az OA és az OA + Gélcsoportok (p 0,05). Ezek az adatok arra utalnak, hogy az OA és az OA + gél csoportban folyamatban van az ízületi gyulladás és a porc pusztulása, valamint a KGN termogéllel kezelt ízületi gyulladásos térdekben enyhült az ízületi gyulladás és a regenerált porc.
- Térd osteoarthritis diagnózisa, kezelése és a progresszió kapcsolódó tényezői II
- Alacsony FODMAP diéta az irritábilis bél szindróma kezelésére
- Vegán étrend a legjobb a Candida kezelésére
- Az LPG-kezelés segít a fogyásban; Igaz vagy mítosz »Hogyan lehet gyorsan fogyni
- Az alacsony frekvenciájú elektromos stimuláció csillapítja az izomsorvadást a CKD-ben - egy lehetséges kezelés