Rezgési és transzlációs energia a prototípus fém – szénhidrogén inszerciós reakciójának elősegítésében
David L. Proctor
Kémiai és Kémiai Biológiai Tanszék, Baker Laboratory, Cornell Egyetem, Ithaca, NY 14853-1301
H. Floyd Davis
Kémiai és Kémiai Biológiai Tanszék, Baker Laboratory, Cornell Egyetem, Ithaca, NY 14853-1301
Szerző közreműködései: D.L.P. és H.F.D. kutatásokat tervezett, kutatásokat végzett, elemezte az adatokat és megírta a dolgozatot.
Absztrakt
Az Y + CH4 → HYCH3 → YCH2 + H2 reakciót 20 ± 3 kcal/mol potenciális energiagátat magában foglaló C – H beépítéssel indítjuk. A reakciót keresztezett molekuláris nyalábokon vizsgálják, két különböző körülmények között, közel azonos teljes energiával. Az egyik kísérletet 15,1 kcal/mol ütközési energián hajtjuk végre, az egyik kvantum CH4 antiszimmetrikus (ν3) nyújtó vibrációs gerjesztéssel (8,63 kcal/mol), a másikat 23,8 kcal/mol ütközési energiával. A C – H szakaszos gerjesztett gerjesztett metán (σs) reakciókeresztmetszete legalább 2,2-szer nagyobb tényező, mint az alapállapotú metáné (σg) ugyanazon összes energiánál.
A korai és késői potenciális energiagátak koncepciói lehetővé tették, hogy egyszerű, intuitív értelemben racionalizálják a reaktáns transzlációs és rezgési energia szerepét az atom + kova reakciók elősegítésében (1). Az üzemmód- és kötésspecifikus hatások megfigyelése olyan gázfázisú reakciókban, mint a Cl + CH4 → HCl + CH3 és Cl + H2O → HCl + OH, azt illusztrálta, hogy a több rezgésfokú szabadságot magában foglaló poliatomi rendszerek dinamikája is nagyon érzékeny lehet a reaktáns rezgési állapotához (2, 3).
Egy nemrégiben készült tanulmányban Yan és munkatársai a Cl – CHD3 → HCl + CD3 absztrakciós reakció elősegítésében nyújtották a C – H reaktáns rezgési energia és a reagens transzlációs energia első közvetlen összehasonlítását (4). Bár a C – H antiszimmetrikus rezgésgerjesztés fokozta a reaktivitást, kissé kevésbé hatékonynak találták, mint egy ekvivalens mennyiségű reaktáns transzlációs energia. A hőgerjesztéssel kiváltott CHD3 hajlító gerjesztés azonban valamivel hatékonyabban mozdította elő a reakciót, mint egy ekvivalens mennyiségű transzlációs energia. Gáznemű poliatomi rendszerek esetében a reaktáns energia különböző formái nem egyenértékűek az átmeneti állapotban való átjutás megkönnyítésében az atomtranszfer számára (2–5).
A szénhidrogén C – H kötések átmenetifém-komplexekkel történő aktiválása jelentős aktuális téma (11, 12). Az e folyamatok kinetikáját és termodinamikáját szabályozó tényezőkbe való betekintést az elektronszerkezet elméletén keresztül vezették le (13). Sajnos az átmenetifém-komplexekben több ligandum jelenléte megnehezíti az elméleti számításokat. Következésképpen jelentős erőfeszítéseket tettek az olyan modellrendszerek számításainak elvégzésére, amelyek magukban foglalják az izolált átmenetifém-atomok C – H és C – C kötésekbe történő beépítését (14, 15). Érdekes módon a metán Ir (111) (16) és Ni (111) (17) felületeken történő disszociatív adszorpciójának dinamikájával kapcsolatos újabb elméleti munka azt jelzi, hogy a fémrács a reakció során rekonstrukción megy keresztül, és egy helyi felületi fématom jelentős ( 0,6 Å) elmozdulás a felszíntől kifelé. Az izolált átmenetifém-atomok metánnal való reakcióképességének megértése így betekintést nyerhet a disszociatív adszorpciós folyamatba.
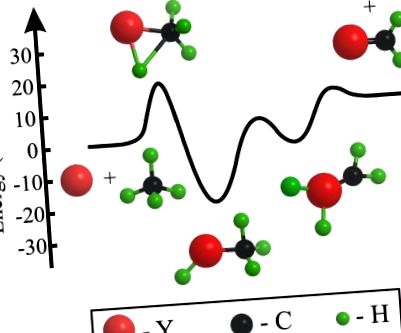
Az Y + CH4 → YCH2 + H2 reakció vázlatos energiaszint-diagramja.
Eredmények
Keresztezett molekuláris nyaláb reaktív szórási kísérleteket végeztünk Y atomok és alapállapotú CH4 között 23,8 ± 1,5 kcal/mol transzlációs energiát biztosító sugársebességgel, valamint Y és CH4 (ν3 = 1) között 15,1 ± 0,9 kcal/mol transzlációs energiával. energia. A 2. ábra a két kísérletsorozat teljes reaktáns energiaeloszlását mutatja. A második kísérlet rezgési energiája, amelyet egy infravörös optikai parametrikus oszcillátor (OPO) által termelt 3,018 cm-1 foton abszorpciója biztosít, az összes kísérletben az összes energiát lényegében azonosá teszi. Az YCH2 reakciótermékek tömeg szerint kiválasztott repülési idő (TOF) eloszlásait mindkét kísérletnél a laboratóriumi szögben rögzítettük a gerendákhoz viszonyítva. Az iteráltan beállított tömegközéppont (CM) kerettermék transzlációs energia és szögeloszlás alapján kiszámított TOF-eloszlásokat az ismert sugársebesség-eloszlások és műszerfüggvények előre történő konvolúciójával illesztettük az adatokhoz.
Valószínűségeloszlásfüggvény a teljes reaktáns energiához az „OPO Off” és az „OPO On” kísérletekben. Az OPO Off kísérletekben az összes reaktáns energia transzlációs; az OPO-ban A kísérletek során a teljes reaktáns energia 8,63 kcal/mol rezgésgerjesztést tartalmaz a CH4 antiszimmetrikus szakasz (ν3) rezgési módban.
A 3. ábra mutatja az YCH2 termékek laboratóriumi szögeloszlását a 23,8 kcal/mol ütközési energiánál, valamint az illesztéskor alkalmazott CM transzlációs energiaeloszlást. A CM szögeloszlás, T (θ), a rotációs periódusuknál hosszabb élettartammal rendelkező komplexek esetén várható izotróp volt. A 4. ábra az YCH2 termékek TOF eloszlását mutatja. Ennél az ütközési energiánál (azaz a gát felett) az alapállapotú CH4 reakciója YCH2 + H2 képződéséhez vezet, miközben a termék transzlációs energiája P (E) 3 kcal/mol közelében csúcsosodik és 11 kcal/mol-ig terjed, 〈P (E)〉 = 3,6 kcal/mol. A 15,1 kcal/mol vibrációs gerjesztésű ütközési energia TOF-jeit és laboratóriumi szögeloszlását azonos P (E) és CM szögeloszlás alkalmazásával illesztettük, és hasonlónak tűnnek.
Laboratóriumi szögeloszlás, a tömeg közepes szórási szögével és a termék transzlációs energiaeloszlásának eloszlásával, P (E) Y + CH4 → YCH2 + H2 esetén Ecoll = 23,8 kcal/mol, OPO Off mellett. Az adatok fekete, piros színben illeszkednek, a hibasávok pedig 90% -os megbízhatósági intervallumokat tartalmaznak.
A YCH2 termékek laboratóriumi repülési időbeli eloszlása jelzett laboratóriumi szögben, kikapcsolt OPO mellett. A kitöltött körök jelzik a kísérleti adatokat, és a folytonos vonal eloszlását a 2. ábra P (E) és az izotróp tömegközéppont szög-eloszlásának T (θ) segítségével számoljuk. Az adatok fekete, piros színben illeszkednek, a hibasávok pedig 90% -os megbízhatósági intervallumokat tartalmaznak.
Megállapítottuk, hogy a reakció keresztmetszete a reaktáns ütközési energiájával élesen emelkedik. A reaktív jel ütközési energiától való függése 20 ± 3 kcal/mol értékre helyezi a potenciális reakciógátat. Ennek az értéknek a bizonytalansága elsősorban az egyes kísérletek ütközési energiáinak eloszlásából és az Y (2 D1/2) gerjesztett pálya jelenlétéből származik, amely 1,5 kcal/mol a Y Y (2 D3/2) állapot felett helyezkedik el, az atomnyalábban. A termék transzlációs energia leadási adatai az YCH2 + H2 termék aszimptotát ~ 11 kcal/mol a reagensek fölé helyezik. Ez összhangban áll a termék energetikájával, amelyet a legutóbbi elméleti munka eredményeinek felhasználásával számítottak ki, amely ezt az értéket 12 kcal/mol közelébe helyezi (19). A reakció sebességének korlátozása tehát megfelel a rendszer áthaladásának a C – H beillesztés kezdeti gátján.
18,6 kcal/mol névleges átlagos ütközési energia esetén gyenge termékjelet figyeltünk meg az alapállapotú CH4 molekulák esetében. 15,1 kcal/mol ütközési energia esetén OPO besugárzás nélkül nem volt reakció. A rugalmatlan szórási kísérletek azt mutatták, hogy ennél az ütközési energiánál a nem reaktív módon szétszórt Y atomok erősen előre szóródnak a CM keretben, jelezve a közvetlen rugalmatlan szórás előfordulását anélkül, hogy a hosszú életű YCH4 komplexek észrevehető kialakulása lenne. A gát alatti ütközési energiáknál a komplex képződésének hiánya várható, mivel a semleges fém-alkán σ-komplexek legfeljebb 1-2 kcal/mol kötődnek (20). Ennél az ütközési energiánál, amely jóval a földi rezgésállapotú CH4 molekulák C – H beillesztési akadálya alatt van, erős YCH2 jel figyelhető meg, amikor a CH4 molekulákat optikailag a C – H antiszimmetrikus nyújtási szintre (ν3) pumpálják közvetlenül az ütközés előtt. A megfigyelt YCH2 jelszint az OPO impulzusenergia függvényében (5. ábra) azt jelzi, hogy az átmenet könnyen telítődik az OPO keskeny sávszélessége miatt. Így a C – H rezgésgerjesztés az ütköző párok reakcióit nyitja meg olyan ütközési energiáknál, amelyek nem voltak reagálók a gerjesztetlen metánra.
Telítettségi görbe, amely az YCH2 jelszintet mutatja a laboratóriumi tömegközéppont szögben, az OPO impulzusenergia függvényében. Az adatok fekete, piros színben illeszkednek, a hibasávok pedig 90% -os megbízhatósági intervallumokat tartalmaznak.
Vita
Gáz-felület-disszociatív adszorpcióban, gázfázisú absztrakciós reakciókban (pl. Cl + CH4) és egy fématom C-H kötésbe történő beillesztésekor az izolált metánmolekulában a kezdeti antiszimmetrikus normál üzemmódú gerjesztés négy helyen delokalizálódik C – H kötések. Ennek az energiának a reakció koordinátájában lokalizált energiává kell fejlődnie a megközelítés során, hogy a reakció sikeres legyen. Az elméleti számítások lehetővé tették számunkra, hogy megértsük e folyamatok dinamikáját. Diszociatív metánadszorpció esetén a szimmetrikus szakasz alapja adiabatikusan korrelál a felszín felé mutató egyedi reakcióba lépő C – H kötés lokalizált gerjesztésével (24, 25). Az antiszimmetrikus szakaszos gerjesztés azonban a néző CH3 részében lévő reaktív kötéstől távol lokalizálódik. Minőségileg hasonló viselkedést figyeltek meg a Cl + CH3D gáz absztrakciós reakció elméleti tanulmányaiban (26).
Jelen eredmények alapján megkísértés lehet arra a következtetésre jutni, hogy mivel az Y + CH4 inszerciós reakciót erősebben fokozza a reaktáns rezgési energia, mint egy ekvivalens mennyiségű transzlációs energia, ez egy olyan rendszert képvisel, amely „késői ”Potenciális energiagát. Rezgésmentesen nem adiabatikus modellben a reaktáns rezgésgerjesztés hozzáférést biztosít az alacsonyabb energiájú átmeneti állapot geometriáihoz a reakcióhoz (7). Annak ellenére, hogy ez a magyarázat vonzó, a poliatomi rendszerek sokféle körét érintő reakciókban már megállapított figyelemre méltó finomságok azt mutatják, hogy a háromatomos reakciók megértésén alapuló egyszerű fogalmakat nagy körültekintéssel kell alkalmazni. További kísérletek hiányában, amelyek más fémek és más reaktáns rezgési módok összehasonlítását tartalmaznák, és mivel elméleti elemzésre van még szükség, tanulmányunk alapján az általánosítás korai lenne. Nyilvánvaló, hogy a kísérlet és az elmélet kombinációja óriási értéket fog jelenteni annak az alapvető dinamikának a felderítésében, amely mögött a reaktánsenergia különböző formái segítik elő a kémiai reakciók ezen fontos osztályát.
Kísérleti módszerek
A kísérleti berendezés egy lézeres párologtató forrást alkalmaz, amely olyan fénysugarat állít elő, amely alapállapotú Y atomokat tartalmaz tiszta H2-ben vagy 20% H2-ben He-ben (30). A gerendát 2 mm-es vetőgéppel és 1,7 mm × 1,7 mm-es négyzetes meghatározó nyílással kollimálják, időbeli finomítással egy réselt aprító kerék segítségével, és derékszögben keresztezik 5% vagy 10% CH4-t tartalmazó H2-ben levő, külön-külön lefejtett gerendával. . Az optikai szivattyúzási kísérletekhez az impulzusos keskeny sávú infravörös optikai paraméteres oszcillátor kimenete úgy van elrendezve, hogy keresztezze a metánnyalábot az ütközési tartomány előtt. Bimolekuláris reakció után a kémiai termékek egy része (YCH2) ~ 25 cm-rel sodródik egy detektorhoz, ahol egy F2 lézer kimenete által 157 nm-en fotoionizálják őket, áthaladnak egy kvadrupol tömegszűrőn, és egy dióda/elektron szorzóval detektálják őket. kombináció. A forgatható forrás szerelvény lehetővé teszi a két gerenda forgatását a rögzített detektorhoz képest. A termékek detektorhoz érkezési idejének eloszlásának mérésével meghatározzuk a laboratóriumi szög- és kinetikus energiaeloszlást reakció vagy nem reaktív rugalmatlan ütközés esetén.
Köszönetnyilvánítás.
Ezt a munkát a Nemzeti Tudományos Alapítvány CHE-0316296 támogatása támogatta.
- A Viburnum gyümölcsének, virágának és kérgének kémiai összetételének és antioxidáns kapacitásának összehasonlítása
- Elektronikus cigaretta áttekintése a kémiai összetételről és az expozíció becsléséről
- CARNATION Special Treatment kéttónusú gumikesztyű otthoni használatra, SIZE 8; Tak Shing Hong
- Értékelje a megtanult jellemzők pontosságát a vizsgálati adatokon - MATLAB
- Értékelje a megtanult jellemzők pontosságát a vizsgálati adatokon - MATLAB