Kölcsönhatás a hepatitis C vírus és az anyagcsere tényezők között
Levelezés: Yasunori Kawaguchi, MD, Saga Medical School Belgyógyászati Klinika, 5-1-1 Nabeshima, Saga 849-8501, Japán. pj.ca.u-agas.cc@yugawak
Telefon: + 81-952-342362 Fax: + 81-952-342017
Absztrakt
Alap tipp: A hepatitis C vírus (HCV) fertőzés sajátos patofiziológiai jellemzője a teljes test inzulinrezisztenciája, amely összefügg az oxidatív stresszel, a lipidanyagcsere rendellenességeivel, a máj steatosisával és a vas túlterhelésével. A gazdaszervezet metabolikus tényezői szinergikusan fokozzák a HCV által kiváltott anyagcserezavarokat, és befolyásolják a klinikai lefolyást krónikus hepatitis C-ben szenvedő betegeknél. Következésképpen az étrend, az életmód és az anyagcsere-rendellenességeknek megfelelő gyógyszerek fontosak a HCV-fertőzött betegek kezelésében, prognózisuk javítása érdekében.
BEVEZETÉS
Epidemiológiai és klinikai vizsgálatok kimutatták, hogy a krónikus májbetegségben szenvedő betegeknél, különösen a hepatitis C vírussal (HCV) fertőzötteknél a glükóz intolerancia gyakoribb, mint az általános populációnál [1–8]. Úgy tűnik, hogy az inzulinrezisztencia a HCV által kiváltott glükóz intolerancia patogenezisének központi jellemzője. Kimutatták, hogy a HCV vírusellenes terápiával történő felszámolása javítja az inzulinrezisztenciát, mind a májszövetekben [4], mind az egész testben [9]; ezenkívül ezek a vírusellenes kezelési reakcióval rendelkező betegek a következő követés során a glükóz metabolizmus rendellenességeinek előfordulási aránya lényegesen alacsonyabb [10,11].
Az inzulinrezisztencia fontos prognosztikai tényezővé vált a HCV-fertőzés klinikai lefolyásában, mivel összefügg az antivirális terápiával szembeni rezisztenciával [12-18], a májfibrózis előrehaladásával [13,19-24], a hepatocelluláris carcinoma (HCC) kialakulásával. ) [25], és a rossz életminőség [26]. Emellett az inzulinrezisztencia, valamint az oxidatív stressz bebizonyosodott, hogy hozzájárul a HCV-vel kapcsolatos rendellenességekhez a gazda metabolikus faktoraiban, különösen a lipidekben és a vasban [27-31]. A zsigeri elhízásról kimutatták, hogy fokozza a HCV által kiváltott inzulinrezisztenciát [32], és az elhízásban és a cukorbetegségben szenvedő betegek HCV-fertőzése erőteljesen elősegíti a HCC kialakulását [33]. Tehát feltételezzük, hogy a vírusos és metabolikus faktorok szinergetikus hatásai hozzájárulnak a hepatocarcinogenezishez.
A májcirrózis etiológiától függetlenül jelentős metabolikus zavarokhoz vezet a fehérje-energia alultápláltságában [34], az egész test inzulinrezisztenciájában [35,36] és a perifériás hiperinsulinémiában [37-40]. Így a májcirrhosis patofiziológiája nem szerepel a HCV-specifikus anyagcserezavarok közötti interaktív és szinergikus összefüggések jelen tárgyalásában. Ehelyett áttekintést nyújtunk a következőkről: (1) inzulin szignál faktorok és utak, amelyek fontos szerepet játszanak a glükóz és a lipid anyagcserében; (2) a HCV által kiváltott inzulinrezisztencia mechanizmusa több szervben; (3) a megváltozott lipid-anyagcsere és a máj steatosis mechanizmusai HCV-fertőzés körülményei között; (4) kölcsönhatások a vas metabolizmusa és az oxidatív stressz útjai között a HCV fertőzésben; (5) a gazdaszervezethez kapcsolódó metabolikus tényezők hatása a HCV által kiváltott anyagcserezavarokra; és (6) ajánlások étrendre, életmódra és gyógyszerekre, amelyek célja az anyagcserezavarok elleni védelem vagy az oldása HCV-fertőzött nem cirrhosisos betegeknél.
A GLUKÓZ ÉS A LIPID METABOLIZMUS SZABÁLYOZÁSÁNAK INSULINI CSELEKVÉSE
Az inzulin az étkezés utáni vércukorszintet úgy szabályozza, hogy növeli az izom és a zsír glükózfelvételét és csökkenti a máj glükóztermelését. Az inzulin stimulálja a glikogén, a fehérjék és a lipidek sejtszintézisét, és gátolja a glikogenolízist, a fehérje lebontását és a lipolízist, megkönnyítve ezáltal a szubsztrátok tárolását. Az izom- és zsírsejtek glükózfelvételét elősegítik az inzulin stimulálása révén a glükóz transzporter (GLUT) 4 transzlokációja a citoplazmából a plazmamembránba. Bár az inzulin nem befolyásolja a hepatociták GLUT2-ét, blokkolja a glükoneogenezist és a glikogenolízist, és serkenti a glikogénszintézist [41].
A foszfatidil-inozitol-3-kináz (PI3K) -Akt útvonal az inzulin által közvetített metabolikus jel kulcsátalakítója [41,49]. Maga a PI3K egy p110 katalitikus alegységből és egy p85 szabályozó alegységből áll. Az IRS fehérjék úgy aktiválják a PI3K-t, hogy két SH2 domént foszforileznek a p85 komponensben [50]. Ezt követően a PI3K p110 komponense foszforilálja a membrán foszfolipid-foszfatidil-inozitol-4,5-biszfoszfátot a 3 ’helyzetben. A kapott foszfatidil-inozitol-3,4,5-trifoszfát (PIP3) szabályozza az 1 foszfoinozitid-függő kinázt, amely foszforilálja és aktiválja az Akt-ot [51]. A foszfatáz és a tenzin homológ [52], valamint az SH2 doméntartalmú inozitol-5-foszfatáz [53] túlzott expressziója a PIP3 szintjének csökkenéséhez vezet, ami a PI3K-Akt útvonal gátlását eredményezi.
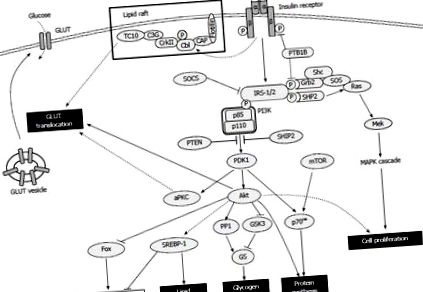
A következő három út szabályozza a glükózfelvételt: PI3K-Akt [54]; PI3K-atipikus protein-kináz C (aPKC, amely PKC ζ/λ-ból áll) [55]; és a tutajban expresszált CAP-Cbl-TC10 [56,57]. Mindenki számára a PI3K-Akt útvonal kritikus a GLUT4 transzlokáció szempontjából. Aktiválásakor az Akt gátolja a glikogén-szintáz kináz-3-ot [58] és aktiválja a protein-foszfatáz-1-t [59], ezáltal aktiválja a glikogén-szintázt a defoszforilezésének elősegítésével. Az inzulin maga gátolja a glükoneogenezist és a glikogenolízist bizonyos folyamathoz kapcsolódó transzkripciós faktorok modulálása révén, mint például a máj 4-es nukleáris faktor, a villa fehérje családjának tagjai és a peroxiszóma-proliferátor-aktivált receptor (PPAR) γ ko-aktivátor 1, és növeli a lipogenezist azáltal, hogy a szterin szabályozó elemet megkötő fehérje (SREBP) -1 modulálása [41]. Az inzulin által közvetített PI3K útvonal és a rapamicin (mTOR) jelátviteli emlős célpont aktiválja a p70 riboszomális S6 kinázt, amely szintetizálja a fehérjéket és modulálja az emlős transzlációs gépezetét [60]. Az inzulin stimulálhatja a sejtek proliferációját és differenciálódását azáltal is, hogy zavarja a Ras-aktivációt a Grb2-SOS által, amely modulálja a downstream mitogén-aktivált protein-kináz (MAPK) jelátviteli kaszkádot [61,62] (ábra (1. ábra).
Az inzulinjelzés áttekintése. Az inzulinkötés elősegíti a receptor autofoszforilezését és az azt követő tirozin foszforilezését az inzulinreceptor szubsztrátok számára, amelyek sokoldalú anyagcsere-lépések kaszkádját indítják el. GLUT: Glükóz transzporter; IRS: Inzulinreceptor szubsztrát; SOCS: A citokin szignál szuppresszora; aPKC: atipikus protein-kináz; SREBP: Szterol szabályozó elemet megkötő fehérje; mTOR: A rapamicin emlős célpontja; MAPK: mitogénnel aktivált protein-kináz; PTEN: foszfatáz és tenzin homológ; GSK3: Gen-szintáz kináz-3; HAJÓ: SH2 domént tartalmazó inozitol-foszfatázok.
HCV által kiváltott metabolikus zavar
Az inzulinrezisztencia molekuláris mechanizmusai HCV-vel fertőzött májban
Az inzulinrezisztencia molekuláris mechanizmusai a hepatitis C vírussal fertőzött hepatocitákban. A hepatitis C vírus (HCV) közvetlenül vagy közvetve gátolhatja az inzulin jelátvitelt. GLUT: Glükóz transzporter; IRS: Inzulinreceptor szubsztrát; SOCS: A citokin szignál szuppresszorja; SREBP: Szterol szabályozó elemet megkötő fehérje; mTOR: A rapamicin emlős célpontja; MAPK: mitogénnel aktivált protein-kináz; PTEN: foszfatáz és tenzin homológ; HAJÓ: SH2 doméntartalmú inozitol-foszfatázok; GSK3: Gen-szintáz kináz-3; PI3K: Foszfatidil-inozitol-3-kináz; TNF: Tumor nekrózis faktor; ER: Endoplazmatikus retikulum; PP2A: Protein-foszfatáz 2A; PA28γ: Proteasoma aktivátor 28γ.
Az inzulinrezisztencia mechanizmusai a HCV-vel nem fertőzött perifériás szövetekben (főleg vázizmok)
Normális fiziológiai körülmények között a vázizomok az inzulinfüggő glükóz-leadás akár 75% -át teszik ki, míg a zsírszövet csak kis részét teszi ki [41]. Az elhízott és a cukorbetegeknél azonban egyszerre alakul ki inzulinrezisztencia a májban, a vázizomban és a zsírban. A HCV-fertőzött betegeknél a perifériás szövetekben (főleg vázizomokban), valamint a májban is kialakul az inzulinrezisztencia, bár a molekuláris mechanizmus továbbra sem tisztázott.
Több szerv interakciója hepatitis C vírusfertőzésben. A zsigeri zsírbetegség fokozza a hepatitis C vírus (HCV) által indukált teljes test inzulinrezisztenciáját. TNF: Tumor nekrózis faktor; FFA: Szabad zsírsav.
HCV-vel kapcsolatos változások a hasnyálmirigy β-sejtjeiben
Hogy a HCV által kiváltott cukorbetegség patogenezise megegyezik-e a 2-es típusú cukorbetegséggel, továbbra is ellentmondásos, annak ellenére, hogy átfogó tanulmányok készültek a csökkent szigetek tömegének és a β-sejtek diszfunkciójának a cukorbetegséggel kapcsolatos főbb jellemzőire gyakorolt HCV-hatásról. In vitro vizsgálatok kimutatták, hogy az emberi β-sejtek HCV-fertőzése a sejtek glükóz-stimulált inzulin felszabadulásának csökkenéséhez vezet [82], és új, apoptózis-szerű halált vált ki ER-stressz-érintett, kaszpáz-3-függő, specifikus útvonal [83]. Ezzel szemben a HCV magfehérje transzgénikus egérmodell in vivo vizsgálata nem utalt arra, hogy a hasnyálmirigyhez kapcsolódó inzulinra nézve nem lenne lényeges hatás, mivel a szigetek tömege kompenzációs módon megnőtt, ami a gyulladásos sejtek beszűrődése nélkül történt [64].
Ezek az in vivo eredmények megegyeznek a HCV-fertőzött betegek felfelé szabályozott inzulinszekréciójának klinikai megfigyeléseivel [3,4,9,12-14,18-20,22-24,65,84,85]. Mindazonáltal további vizsgálatokra van szükség a HCV hasnyálmirigy β-sejtekre gyakorolt hatásainak, valamint ezek termelésének és inzulin felszabadulásának tisztázásához.
A HCV-vel kapcsolatos változások a bélhormonokban
A gyomor-bél traktus kulcsfontosságú szerepet játszik a glükóz metabolizmusának és az energia homeosztázisának szabályozásában a tápanyagok emésztése és felszívódása, valamint több bélhormon kiválasztása révén. Az inkretin hormonok, a glükagonszerű peptid (GLP) -1 és a glükózfüggő inzulininotróp polipeptidek elsősorban a vékonybélben termelődnek, és elősegítik az inzulin bioszintézist, az inzulin szekréciót és a β-sejtek túlélését, és enzimatikusan inaktiválják őket a dipeptidil peptidáz (DPP). ) -IV [86]. Ezenkívül a GLP-1 gátolja a glükagon szekrécióját és a gyomor kiürülését, jóllakottságot vált ki és aktiválja a glikogén szintézist a hepatocitákban [86,87]. Ezzel szemben a gyomorban termelődő ghrelin hormon gátolja az inzulin szekrécióját és serkenti a táplálékfelvételt [88]. A kolecisztokinin és a gasztrin hormonok mind a szigetek neogenezisének stimulálásával serkentik az új β-sejtek képződését [86].
A mai napig csak néhány jelentés foglalkozott a bélhormonok és a HCV-fertőzés kapcsolatával. Egy tanulmány kimutatta, hogy a HCV csökkentheti a szérum GLP-1 szintjét a DPP-IV expresszió felfelé történő szabályozása révén, és azt javasolta, hogy ez a mechanizmus magyarázza a HCV által kiváltott glükóz intoleranciát [89]. Egy másik friss tanulmány kimutatta, hogy az aktív ghrelin keringő szintje pozitív korrelációt mutat a HCV-fertőzött betegek szérumalbuminszintjével [90]. Ugyanakkor a ghrelin hatása a glükóz metabolizmusára HCV-fertőzésben továbbra sem tisztázott.
A HCV befolyásolja a lipid anyagcserét és genotípus-specifikus mechanizmusokkal indukálja a máj steatosisát
A gazda lipideket a HCV manipulálja annak életciklusának támogatása érdekében. A vírus replikációja és összeszerelése szoros kölcsönhatást igényel a lipidcseppekkel és a lipoprotein metabolizmus tényezőivel [91,92] a gazdasejtben. Ezenkívül, amikor az érett vírus felszabadul a hepatocitákból, az komplexet képez gazda lipoproteinekkel [93]. Sajnos a lipid metabolizmus folyamatának a gazdasejtekben történő HCV általi modulálása máj steatózist indukálhat [27]. Ezt a tényt tükrözi a máj steatosis nagyobb gyakorisága HCV-fertőzött betegeknél az általános populációhoz vagy akár krónikus hepatitis B-ben szenvedőkhöz képest [94].
A HCV magfehérje transzgénikus egérmodell felhasználásával a magfehérjét a HCV-vel összefüggő máj steatosis kulcsinduktoraként vonták be [95], és meghatározták a mechanizmust, amely magában foglalja mind a mikroszómás triglicerid transzfer fehérje aktivitás, mind a nagyon alacsony sűrűségű lipoprotein gátlását ( VLDL) szekréció [96]. A HCV által indukált oxidatív stressz mitokondriális diszfunkció révén szintén kimutatták, hogy lipid és fehérje peroxidációt okoz, ami a VLDL export károsodását eredményezi [27]. Ezenkívül a HCV magfehérje kimutatta, hogy károsítja a PPARγ expresszióját és működését [97], ezáltal csökkenti a mitokondriális hosszú láncú zsírsav β-oxidációját [98], és indukálja a máj génexpresszióját és az SREBP-1 transzkripciós aktivitását, ezáltal növelve zsírsavszintézis [99]. Az SREBP-1 aktiválását SOCS [100] vagy PA28γ [101] útján elősegítik (2. ábra). Ezek az eredmények együttesen azt sugallják, hogy a HCV-fertőzésben a máj steatózist a májból származó lipidexport csökkenése, a zsírsav oxidációjának csökkenése és a de novo zsírsavszintézis elősegítése indukálja.
Egy in vitro vizsgálat kimutatta, hogy a sejtekben szignifikáns triglicerid felhalmozódás következik be az 1. és a 3. HCV genotípusú transzfekció során, de a 2., 4. vagy 5. genotípus esetében nem. Ezenkívül a HCV 3. genotípusú magfehérjét háromszor erőteljesebbnek becsülték az indukcióban. ez a triglicerid felhalmozódás, mint az 1. genotípusú magfehérje [102]. Az 1. genotípussal összehasonlítva a HCV 3. genotípus nagyobb SREBP-1-függő zsírsavszintáz-promóter aktivitást is indukált [103], a PPARγ expresszió károsodását [104] és nagyobb lipidcseppek képződését hepatocitákban [105]. A máj steatosis klinikai vizsgálata HCV 3 genotípusú betegeknél közvetlen összefüggést mutatott a HCV RNS szérum [20,106,107] és intrahepatikus [108] titereivel, amelyek a HCV vírusellenes vírusirtással való felszámolása után eltűntek [107-110], és a HCV visszaesésével összefüggésben ismétlődtek [ 108.]. Ezeket a klinikai jelenségeket a többi HCV genotípus vizsgálatakor nem figyelték meg, ami arra utal, hogy csak a HCV 3 genotípus rendelkezik vírusspecifikus citopátiás hatásokkal, amelyek steatosishoz vezethetnek.
Vas túlterhelés és oxidatív stressz HCV fertőzésben
A GÁZTALNAK KAPCSOLÓDÓ Metabolus Tényezők hatása a HCV fertőzésre
A zsigeri elhízás szinergetikus hatása a HCV által kiváltott szisztémás inzulinrezisztenciára
A zsigeri adipociták által termelt és kiválasztott szabad zsírsavak (FFA-k) inzulinrezisztenciát válthatnak ki a vázizomban és a májban [120]. A legújabb vizsgálatok jelentős betekintést nyújtottak a lipidek által kiváltott inzulinrezisztencia mechanizmusába [121]. Különösen a zsírsav metabolitok intracelluláris felhalmozódása mutatta ki az új PKC (δ, ε, η és θ) aktiválódását, ami az inzulin szignalizáció károsodását eredményezte. Izomban az aktivált PKCθ szükséges a GLC4 transzportjának diacilglicerin (DAG) által közvetített gátlásához, a májban pedig az aktivált PKCε szükséges a glikogénszintézis DAG által közvetített csökkenéséhez és a glükoneogenezis növekedéséhez. Ezenkívül a viscerális adipocitákról azt is kimutatták, hogy számos adipokin negatív modulálásával elősegítik az inzulinrezisztenciát, beleértve a TNF-a-t, az adiponektint, a leptint és a rezisztint [41]. Ezeknek az összesített megállapításoknak a hipotézise, miszerint a zsigeri elhízás az egész test inzulinrezisztenciáját és glükóz intoleranciáját okozhatja FFA-k és adipokinek révén, alátámasztják krónikus hepatitis C betegek klinikai vizsgálatai, amelyek azt mutatják, hogy a zsigeri adipozitás szinergikusan fokozza a HCV által kiváltott inzulinrezisztenciát [32 ] (Ábra (3. ábra 3).
Kapcsolatok a metabolikus tényezők és a vírusellenes terápiával szembeni rezisztencia között HCV-fertőzésben
A máj- és perifériás inzulinrezisztencia szorosan összefügg a pegilált interferon (peg-IFN) -α plusz ribavirin kombinációs terápiával adott válasz krónikus hepatitis C-ben szenvedő betegeknél [12,13-18]. A HCV-fertőzött betegek vírusellenes terápiájára adott válaszreakció a SOCS-3 fokozott máj expressziójával is összefüggésbe hozható [122], amely az IFN-α jelátvitel egyik kulcsfontosságú tényezőjének fiziológiás negatív szabályozója, a jelátalakító és transzkripció aktivátor (STAT) -1 [123]. Ismert, hogy a HCV a gazda immunrendszeréből úgy távozik, hogy a PP2A felfelé szabályozásával és a STAT-1 hipometilezésével interferál az IFN szignalizációval, és mindkettő az IFN által stimulált gének csökkent transzkripciós aktivációját eredményezi [124]. Így az IFN szignalizációval kapcsolatos tényezők képviselhetik a molekuláris kapcsolatot az antivirális terápiával szembeni rezisztencia és az inzulinrezisztencia között krónikus hepatitis C-ben szenvedő betegeknél. Ezt az elméletet támasztják alá olyan tanulmányok is, amelyek azt mutatják, hogy a SOCS fehérjék szintén fontos szerepet játszanak a metabolikus szindrómához kapcsolódó inzulinrezisztenciában. [100] és hogy a máj SOCS-3 expressziójának elhízással összefüggő fel-szabályozása a HCV-fertőzött betegek IFN-α elleni csökkent biológiai válaszával jár [122].
A metabolikus faktorok májgyulladással, fibrózissal és hepatocarcinogenezissel társulnak a HCV fertőzésben
Étrend- és életmód-ajánlások HCV-vel fertőzött nem cirrózisos betegeknek
Az étrend és az életmódra vonatkozó ajánlások a krónikus hepatitis C kezelésére alapvetően megegyeznek az elhízással, a cukorbetegséggel és a metabolikus szindrómával kapcsolatosakkal, tükrözve az anyagcsere-tényezők potenciális negatív hatásait a HCV-fertőzés klinikai lefolyására. Egy nemrégiben készült metaanalízis megerősítette, hogy a metabolikus szindróma kezelésére tervezett étrend és életmód-módosítások eredményesen csökkentették az éhomi vércukorszintet, a derék kerületét, a vérnyomást és a triglicerideket [131]. A testmozgás egy jól megalapozott viselkedésmódosítás, amely elősegíti az anyagcsere-rendellenességeket, és a molekuláris mechanizmus megállapítást nyert, hogy a testmozgással stimulált glükóztranszportot magában foglalja az AMP-aktivált protein-kináz (AMPK) aktiválása a vázizomzatban [132]. Mivel az AMPK útja független az inzulin szignalizációjától, a testmozgás hatékonyan javítja a hiperglikémiát anélkül, hogy az inzulinrezisztens közeg befolyásolja. Bár az étrend és az életmód-módosítások pontos hatása a HCV-fertőzés kimenetelére még nem teljesen tisztázott, kimutattuk, hogy a megfelelő étrend és testmozgás növelheti az inzulinérzékenységet a HCV-fertőzött betegeknél, valamint javíthatja a vírusellenes terápiára adott korai vírusreakciót és csökkenti a szérum α-fetoprotein szintjét [84,85].
Figyelembe véve a HCV által közvetített, a vas anyagcseréjére gyakorolt lehetséges hatásokat, ajánlott, hogy a HCV-fertőzött betegek csökkentsék a vasbevitelt. Bár a HCV által kiváltott vas-felhalmozódás jelentett terhelése a májban nem volt rendkívül magas [133,134], a túlzott vasbevitel veszélyessé teheti az állapotot [31,118,119]. Ezért az étkezési vaskorlátozás fontos a HCV-fertőzött betegek számára. Megfelelő táplálékkal bevitt alacsony vas-diéta bevitele jelentősen csökkenti a szérum ALAT- és ferritinszintet krónikus hepatitis C-ben szenvedő betegeknél [135]; ezenkívül a máj vasának csökkentése phlebotomiával szintén javította a szérum ALT szintjét [30,136-138] és az inzulinrezisztenciát [30]. Az alacsony vas-diéta hosszú távú kezelése phlebotomiával kombinálva tovább javította a májgyulladást és a fibrózist [138], és csökkentette a hepatocarcinogenezis kockázatát [139]. E klinikai vizsgálatok összegyűjtött eredményei ideális vasbevitel becsléséhez vezettek: Mehta SH, Brancati FL, Sulkowski MS, Strathdee SA, Szklo M, Thomas DL. A 2-es típusú diabetes mellitus előfordulása a hepatitis C vírusfertőzésben szenvedők körében az Egyesült Államokban. Ann Intern Med. 2000; 133: 592–599. [PubMed] [Google Tudós]
- Keto-savval kiegészített alacsony fehérjetartalmú étrend felnőtt betegek hepatitis B vírusának kezelésére
- Herpes Simplex (HSV-1 és HSV-2) vírus tünetei, diagnózisa, kezelése
- 8 típusú herpeszvírus - fertőzés
- Herpes simplex vírus
- Hogyan kell enni a csökkenő tesztoszteron szint metabolikus étkezés elleni küzdelem érdekében