Kompozit állványok, amelyek selyemszálat, zselatint és hidroxiapatitot tartalmaznak a csontszövet regenerálásához és a 3D sejttenyésztéshez
M. M. Moisenovich
Biológiai Kar, Moszkvai Állami Egyetem, Leninskie Gory, 119991, 1-12, Moszkva, Oroszország
A. Yu. Arkhipova
Biológiai Kar, Moszkvai Állami Egyetem, Leninskie Gory, 119991, 1-12, Moszkva, Oroszország
A. A. Orlova
Biológiai Kar, Moszkvai Állami Egyetem, Leninskie Gory, 119991, 1-12, Moszkva, Oroszország
M. S Drutszkaja
Biológiai Kar, Moszkvai Állami Egyetem, Leninskie Gory, 119991, 1-12, Moszkva, Oroszország
S. V. Volkova
Biológiai Kar, Moszkvai Állami Egyetem, Leninskie Gory, 119991, 1-12, Moszkva, Oroszország
S. E. Zacharov
Biológiai Kar, Moszkvai Állami Egyetem, Leninskie Gory, 119991, 1-12, Moszkva, Oroszország
I. I. Agapov
Shumakov Transzplantológiai és Mesterséges Intézet, Szövetségi Ügynökség a High-Tech Orvosi Szolgáltatásokért, Shchukinskaya Str., 1, 113182, Moszkva, Oroszország
M. P. Kirpichnikov akadémikus
Biológiai Kar, Moszkvai Állami Egyetem, Leninskie Gory, 119991, 1-12, Moszkva, Oroszország
Absztrakt
A háromdimenziós (3D) selyem fibroin állványokat az egyik legfontosabb csontszövet-származékkal (nano-hidroxi-apatit) és/vagy egy kollagén-származékkal (zselatin) módosítottuk. Az egér embrionális fibroblasztjainak (MEF) tapadása és szaporodása az állványon belül nano-hidroxi-apatittal vagy zselatinnal végzett módosítást követően megnőtt. Azonban a MEF tapadásának és szaporodásának jelentős növekedését figyelték meg, amikor mindkét adalékot bevitték az állványba. Az ilyen módosított kompozit állványok új és jobb platformot kínálnak a sebgyógyulás, a csontok és más szövetek regenerálódásának, valamint a mesterséges szervek biotechnológiájának tanulmányozásához. Ez a rendszer tovább alkalmazható kísérleti modellek létrehozására a sejt-szubsztrát kölcsönhatások, a sejtvándorlás és más összetett folyamatok tanulmányozására, amelyek nehezen kezelhetők a hagyományos kétdimenziós tenyésztési rendszerek használatával.
BEVEZETÉS
Korábbi vizsgálataink során összehasonlítottuk a fibroinból és a rekombináns spidroinból származó állványok tulajdonságait. Ezek a tanulmányok azt mutatták, hogy az újraképződött fibroin kisebb mértékben fenntartja a fibroblasztok (a sebgyógyulásban és a szövetek regenerálásában részt vevő egyik fő összetevő) tapadását és proliferációját, mint a Nephila clavipesből származó polimerizált rekombináns spidroin által képzett szubsztrát. A fibroin anyagok csökkent képessége a sejtek adhéziójának és proliferációjának fenntartására gyengébb újragenerációs képességet okozhat, mint a spidroin állványoké, csontsérülési modellel végzett kísérletek során. Ezekben a kísérletekben a fibroin állványok re-generatív tulajdonságai jelentősen javultak a nano-hidroxi-apatit mineralizáció alkalmazásával [5]. Két összetett adalékanyag, a nano-hidroxi-apatit (csontszövet-komponens) és zselatin (kollagén-származék) kombinációját vezettük be a fibroin-állványok készítményeibe, hogy fokozzuk a fibroblasztok tapadásának és proliferációjának fenntartására való képességüket. A mindhárom komponens alkotta kompozit szubsztrátum volt az optimális anyag, amely fenntartotta a MEF adhézióját és proliferációját.
KÍSÉRLETI
A bombycid (Bombyx mori) hüvelyeit V.V. Bogoslovskii, az Orosz Agrártudományi Akadémia (Zheleznovodsk, Stavropol régió) republikánus szaporításkutató állomásának igazgatója. A tiszta fibroin előállításához a desericinizációs technikát alkalmazták. A sericint és más szennyeződéseket eltávolítottuk a hüvelyből 0,03 M NaHC03-oldatban (pH 8,4) 1,5 órán át forralva, majd vízzel mostuk és szárítottuk. A természetes hidroxiapatitot V. V. professzor biztosította. Guzeev (Seversk Technológiai Intézet, Nemzeti Kutatási Nukleáris Egyetem, MEPhI, Oroszország).
Állványgyártás
Az állvány gyártásához egy súlyozott fibroinmintát (250 mg) feloldottunk 1000 µl 10% -os lítium-klorid oldatban, 90% -os hangyasavban, 60-70 ° C-on, 30 percig. A fibroint (225 mg) és a zselatint (25 mg) 1000 µl oldatban tartalmazó keveréket 10% zselatin tartalmú kompozit állvány kialakításához használtuk. A kapott oldatot 12 100 g-vel 5 percig centrifugáltuk; a felülúszót állványok kialakítására használták. 50 µl előmelegített felülúszót rétegenként adtunk a formába, és összekevertük 100 mg, különböző részecskeméretű nátrium-kloriddal. Tágítószerként NaCl kristályokat (átmérője 150-300 µm) használtunk. A HA por súlyozott mintáját táguló NaCl-részecskékkel (átmérője 150-300 µm) kevertük, így 30% HA-tartalmú kompozit állványokat kaptunk. A sókoncentrációt úgy választottuk meg, hogy egy komplex, belső porózus felülettel rendelkező, elszigetelt üregektől mentes állványt képezzen. A kapott mintákat 3 órán át 75-80 ° C-on szárítottuk, 16 órán át szobahőmérsékleten tartottuk, 120 percig 96% -os etanollal dolgoztuk fel, 120 percig kétszer desztillált vízben mostuk, majd lebontották és 70% -os etanolban tárolták.
Pásztázó elektronmikroszkópia (SEM)
Pásztázó elektronmikroszkóppal vizsgálták az állványok szerkezetét.
A SEM mintákat standard eljárásokkal állítottuk elő: glutár-aldehidben történő rögzítéssel és dehidratálással etanol és aceton osztályozott sorozataiban. Ezután a mintákat kritikus pont módszerrel szárítottuk HCP-2 kritikus pont szárítóban (Hitachi Ltd., Japán). A mintákat porlasztással 20 nm vastag aranyréteggel vontuk be argonatmoszférában, 6 mA ionárammal és 0,1 Hgmm-rel Ion Coater IB-3-ban (Eiko Engineering, Mito, Japán). 10 nm-es felbontású és 20 kV üzemi térfogatú (SEI mód) Camscan S2 mikroszkópot (Cambridge Instruments, Cambridge, UK) használtunk pásztázó elektronmikroszkópiához. A képek rögzítésére a MicroCapture szoftvert (SMA, Oroszország) használták.
Konfokális lézeres pásztázó mikroszkópia (CLSM)
Konfokális lézeres letapogató rendszert használtunk (Nikon, Japán), amelyben a laboratóriumi vizsgálatokhoz használt Eclipse klinikai inverz mikroszkópot A1 konfokális modullal kombinálták. A lyukméretet, a lézerparamétereket és az összes optikai szakasz sorozatának szűrőméretét a gyártó ajánlása szerint választottuk meg a képek nagy felbontásának elérése érdekében.
A GFP expresszáló egér embrionális fibroblasztok elsődleges kultúrái
A MEF-sejteket a GFP + embriókból izoláltuk az intrauterin növekedés 13. napján. Két C57Bl/6 nőstényt egy éjszakára párosítottak egy GFP + hímmel, és másnap reggel megvizsgálták a hüvelyi dugókat. A dugó észlelésének pillanatát az időzített terhesség 0,5 napjának tekintették. Az egereket a vemhesség 13.5. Napján eutanizáltuk. A méhet eltávolították; a fejeket és a beleket elválasztották az embrióktól, és a GFP expresszióját transz-megvilágítóval határoztuk meg. A többi szövetet aszeptikusan aprítottuk ollóval, disszociáltuk 0,05% tripszin/EDTA oldatban, és 1000 fordulat/perc sebességgel 5 percig centrifugáltuk. A kapott sejtszuszpenziót 25 cm2-es tenyésztőlombikokba helyeztük a tapadó sejtnövekedés érdekében (Greiner). A sejteket ezt követően 4,5 g/l glükózzal (HyClone) és 10% szarvasmarha-magzati szérummal (HyClone) kiegészített DMEM-ben tenyésztettük 37 ° C-on, 5% CO2-nál és 95% páratartalom mellett. A sejteket háromnaponta 1: 3 arányban passzáltuk, miután elértük a 80-85% -os összefolyást. A C57Bl/6 nőstényeket a Pushchino állattenyésztő létesítménytől (BIBC RAS) vásároltuk; és az expresszált GFP-vel rendelkező transzgén hímeket N.N. Logunova (ISTC RAMS).
A C57Bl/6 nőstényeket a Pushchino állattenyésztő létesítménytől (BIBC RAS) vásároltuk; és az expresszált GFP-vel rendelkező transzgén hímeket N.N. Logunova (ISTC RAMS).
Eredmények és vita
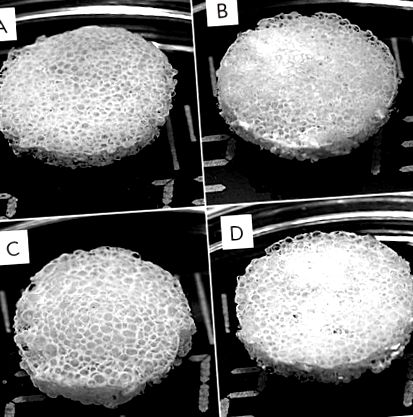
Korábban kialakítottunk selyemfibróm állványokat [6] és selyemfibrin – HA állványokat [5], és megvizsgáltuk a kísérleti minták biológiai tulajdonságait. Az állványok rendelkeznek a csontműtéthez szükséges összes jellemzővel; különösen biokompatibilisek, erősek és porózusak. A jelenlegi tanulmány selyemfibrin állványokat, kompozit selyemfibrin – zselatin és selyemfibrin – HA állványokat, valamint kompozit állványokat eredményezett, amelyek három fő komponenst tartalmaztak: selyemfibrinát, zselatint és HA-t (1. ábra). Ezeknek az állványoknak az előállításához egy előre beállított részecske-átmérővel rendelkező pórusképző szert választottunk.
3D porózus selyemfibrin (A) és kompozit fibroin – zselatin (B), fibroin – hidroxi-apatit (C) és fibroin – zselatin – hidroxi-apatit (D) állványok megjelenése. A zselatin és a hidroxiapatit beépítése az állványszerkezetbe nem változtatja meg annak megjelenését
A kapott vizsgálati minták megőrizhették integritásukat és megszerezhették az előre beállított hengeres alakot. A kompozit selyem fibroin – zselatin állványok rugalmas deformáción mentek keresztül közvetlen mechanikai nyomás alatt, míg a selyem fibroin – HA állványok deformálatlanok maradtak. A kioldással előállított állványok pórusainak mérete megfelel a pórusképző szer hozzáadott részecskéinek (150–300 µm).
A termékek felületét pásztázó elektronmikroszkóppal (SEM) vizsgáltuk (2. ábra). A kapott állványok sejtes hálós szerkezetűek voltak, amelyek teljesen mentesek a pórusképző ágensektől (nyomait soha nem találták az anyagban) (2., 3. ábra). A szuszpendált színes tintarészecskékkel végzett permeabilitási teszt megerősítette az állvány pórusainak konjunktivitását.
A 3D porózus selyemfibrin (A) és az összetett fibroin – zselatin (B), a fibroin – hidroxi-apatit (C) és a fibroin – zselatin – hidroxi-apatit (D) állványok felépítése. A képeket pásztázó elektronmikroszkóppal rögzítettük. A zselatin és a hidroxiapatit bevitele az állványszerkezetbe nem változtatja meg a pórusméretet és az általános állványszerkezetet
Selyemfibrin (A) és kompozit fibroin – zselatin (B), fibroin – hidroxi-apatit (C) és fibroin – zselatin – hidroxi-apatit (D) állványok pórusfelülete. A képeket pásztázó elektronmikroszkóppal rögzítettük. A zselatin és a hidroxiapatit bevitele az állványszerkezetbe megváltoztatja az állványok finom felépítését
A minta szerkezetének vizsgálata azt mutatta, hogy az összetett állványban lévő zselatin és HA mennyisége nem befolyásolta a pórusok konjunktivitását, az árucikkek megjelenését és a tinta permeabilitását. Három vizsgálati minta porozitása és megjelenése azonos volt annak a ténynek köszönhető, hogy az anyag porozitását a pórusképző szer paraméterei határozzák meg (amely 150–300 µm átmérőjű pórusokat képez), és független az adalékanyagok, zselatin vagy HA.
A pórusátmérő meghatározza a szerkezet mechanikai tulajdonságait és biodegradációjának sebességét; befolyásolja az implantáció utáni szöveti választ és a sejt kölcsönhatását az állvány felületével. A nagyobb pórusok elősegítik az újonnan képződött szövet jobb és gyorsabb beilleszkedését, vaszkularizációját és a graft hatékonyabb biorezorpcióját.
A háromdimenziós sejttenyésztéshez zárt szerkezetű állványok szükségesek. A lyukakkal és csatornákkal összekötött pórusok összetett, zárt belső felületet képeznek, amely megkönnyíti a sejtek migrációját egy mesterséges állvány belső rétegeibe. Ezenkívül egy zárt pórusszerkezet biztosítja a feltételeket a tápközeg cseréjére és a metabolitok eltávolítására, ezáltal megkönnyítve egy homogén, állványon belüli közeg kialakulását [5, 7-9].
A CLSM-vizsgálat azt mutatta, hogy a vízi közeg mind a merülés után (1 óra), sem egy nappal később befolyásolja a fibroin és az összes kompozit állvány integritását és porozitását. Ez a jellemző nagyon fontos, mivel a graft alapszerkezetének és fizikai jellemzőinek szétesése vagy megváltoztatása egy vízi közegben megakadályozza annak in vivo alkalmazását. A jelentős vízelnyelő és vízmegtartó képesség hiánya lehetővé tette, hogy az árucikkek megtartsák az előre beállított paramétereiket.
A szubsztrátfüggő sejtek ragaszkodása az állvány felületén szükséges ahhoz, hogy életképességüket megőrizzék egy 3D kultúrában [10, 11]. A szubsztrát befolyásolja az extracelluláris mátrix komponensek sejtek általi termelését, szintézisét és összetételét. A sejtadhézió és a proliferáció fenntartásának képességét fontos in vitro biokompatibilitási paraméternek tekintik egy szubsztrátként használt anyagnál [10-12]. Ennélfogva egy gátló tulajdonságú anyag gátolja a szövetek regenerálódását in vivo.
A selyemfibrin nagy erősségű fehérje, amely nem tartalmaz rákkeltő, toxikogén vagy allergén tulajdonságokat. Megőrzi funkcionális jellemzőit egy adott időszakra, nem okoz helyi gyulladásos választ, nem váltja ki a fertőzés terjedését, és idővel a páciens őshonos szövetével helyettesítik; ezért a csontszövet újratermelésére alkalmas anyag [5-7].
A fibroin egy amfifil fehérje, amelynek hidrofób tulajdonságai jelentős mértékben elterjedtek [13]; pI izoelektromos pontja 4,2. Ennek a paraméternek köszönhetően nem oldódik sem vízben, sem egyes savak és bázisok hígított oldataiban [13], míg fiziológiai pH = 7-nél negatív töltésű, ellentétben a pozitív töltésű spidroinnal [5], így csökken a sejtek száma tapadás és a sejtproliferációs sebesség növelése [5].
A kompozit anyagok adalékanyagaként kollagénszármazékot, a zselatint használtak. A kollagén az extracelluláris mátrix és a kötőszövet fibrilláris összetevője, molekulatömege 300 kDa. A kollagén szinte minden szövettípusban megtalálható, biztosítva azok szilárdságát és szerkezeti stabilitását. Tehát a fehérje az emlősök teljes fehérjetömegének körülbelül 30% -át teszi ki. Ez az anyag nem mérgező és gyenge allergén; a kollagén állványok fontos hiányosságai azonban a gyenge mechanikai tulajdonságok és a rövid biodegradációs idő (ezt a térhálósító szerek csak részben szabályozzák, ami a kollagén cikkek élettartamát egy hónapra korlátozza). A zselatin a kollagén denaturációjának terméke. Nagy mennyiségű glicint, prolint és 4-hidroxi-prolint tartalmaz a három aminosav-szekvenciával együtt (arginin, glicin és aszpartát - RGD), amelyek kötődnek a sejtreceptorokhoz (integrinek), elősegítve ezzel a sejtek tapadását és proliferációját. . Hasonló szekvenciák találhatók a sejtmátrix más fehérjéiben; használatuk azonban jelentősen megnöveli e termékek költségeit.
Megvizsgáltuk az állvány-adalékok hatásait az elsődleges MEF tapadására és proliferációjára. Fi- 5. ábra. Az egér embrionális fibroblasztok (MEF) számának növekedése a tenyésztés során 3D porózus selyem fibroin és kompozit állványokon A sejtek száma 1 mm2 nézetben 1400 1200 1000 800 600 400 200 0 A tenyésztés ideje, napok 1 4 7 Fibroin fibroin + zselatin fibroin + HA fibroin A + zselatin + HA broblasztok heterogén sejtpopuláció, amely képes olyan extracelluláris mátrix komponenseket előállítani, mint a prokollagén, a fibronektin, a proelasztin, a glükóz-aminoglikánok, a nidogén, a laminin, a tenasztin és a kondroitin-2-szulfát. A fibroblasztok aktívan részt vesznek a sebgyógyulásban és az epithelizációban [14]. Ezenkívül szekretálhatnak vaszkuláris epithelium növekedési faktorokat (VEGF), serkentve ezzel az angiogenezist és a nyirokerek kialakulását [15, 16]. Az egér embrionális fibroblasztok primer kultúráját választottuk, amelyek proliferációs potenciálja nagyobb, mint a posztnatális tenyész sejtekben.
Az egér embrionális fibroblasztok (MEF) számának növekedése 3D porózus selyemfibrin és kompozit állványokon történő tenyésztés során
A CLSM által rögzített képek egy állvány vízszintes optikai szakaszai. Sejtek és állványszerkezetek 300 µm mélységig rendelkezésre álltak (4. ábra). A képeket sejtszámolásra használtuk. Összehasonlítottuk a különböző állványokon tenyésztett sejtek számának időbeli változását. Az állványszerkezetbe bevitt zselatin és HA fokozta a sejtek tapadását és a proliferációs sebességet (5. ábra). Így egy napon belül az összetett állványon a sejtek száma 2,5-szer nagyobb volt, mint a fibroin állványain, míg a 4. és a 7. napon több mint háromszorosára nőtt.
GFP-t expresszáló egér embrionális fibroblasztok (MEF) a selyem fibroin állványon (A, E, I), kompozit fibroin – zselatin állványon (B, F, J), hidroxi-apatit (C, G, K), zselatin és hidroxi-apatit (D, H, L) 1 (A – D), 4 (E – H) és 7 (I – L) nap termesztés után. A képek az optikai szakaszok felületi vetületeit mutatják
KÖVETKEZTETÉSEK
Ebben a vizsgálatban selyemfibrin állványokat és zselatin- és HA-adalékokkal ellátott kompozit állványokat állítottak elő. Ezek az állványok zárt szerkezetűek, megőrzik integritásukat, és nincsenek mechanikusan szétesve. A fibroin állványok módosítása zselatinnal és HA-val egyidejűleg megváltoztatja felületük tulajdonságait. Ezek a változtatások fokozzák a MEF adhézióját és proliferációját egy 3D kultúrában, így a módosított állványok ígéretes anyagot jelentenek a regeneratív orvoslás számára, különösen a csontszövet regenerációja szempontjából.
Köszönetnyilvánítás
A szerzők hálásak G.N. Davidovich, a Lomonoszov Moszkvai Állami Egyetem elektronmikroszkópos laboratóriumának vezetője a SEM képek rögzítésében nyújtott segítségéért.
Ezt a tanulmányt a Moszkvai Állami Egyetem Fejlesztési Programjának költségén vásárolt berendezésekről és a CUC MSU-hoz tartozó berendezésekről végezték; az Orosz Föderáció Oktatási és Tudományos Minisztériumának pénzügyi támogatásával.
Ez a tanulmány a Szövetségi Célprogram „Kutatás és fejlesztés az Oroszország Tudományos és Technológiai Komplexumának prioritást élvező területein 2007–2013-ig” része (2013.5.07-i 14.512.11.0006. Számú kormányzati szerződés), az Orosz Alapkutatásért Alapítvány (támogatás 14-04-01799) és a Skolkovo Tudományos és Technológiai Intézet (SkolTech) az MIT SkolTech Initiative keretében.
- Gyors 4-nitrofenol-redukció ezüst nanorészecskéket tartalmazó zselatin-hidrogél használatával
- A nagymama csontleves-étrendje titkos receptje a fogyásért és az egészség javításáért, Emily Potts
- A sótartalom füves ponty hatása a túlélésre, a fogyásra és az izomszövet víztartalmára
- A magas fehérjetartalmú étrend bevitelének kielégítő hatása, valamint a vese- és csontegészség körüli ellentmondások
- A kukoricaselyem tea készítése, előnyei és mellékhatásai - TopicTea