Lipolízis
A lipolízist az észter kötések hidrolitikus hasításaként határozzák meg a trigliceridekben (TG), amelyek zsírsavak (FA) és glicerin képződését eredményezik.
Kapcsolódó kifejezések:
- Glükoneogenezis
- Szőlőcukor
- Zsírsavak
- Zsírszövet
- Eicosanoid Receptor
- Enzimek
- Inzulin
- Lipid
- Fehérje
- Triacilglicerin-lipáz
Letöltés PDF formátumban
Erről az oldalról
Lipolízis
Mivel a lipolízis során felszabaduló glicerin nem képes újrafoszforilezni az adipocitákban, magyarázza el, hogyan képződik a glicerin 3-P a TG képződéséhez.
Azonosítsa a glükóz transzportert az adipociták sejtmembránjaiban, valamint a glükóz számára elérhető intracelluláris utakat.
Tudja meg, hogy az inzulin, az adrenalin, a tiroxin és a glükokortikoidok hogyan befolyásolják a zsírsejtek lipolízisét és/vagy a TG lerakódását.
Azonosítsa és megvitassa az LPL, az adenil-cikláz, a HSL, a ciklikus-AMP-függő foszfodiészteráz és a protein-kináz aktivitását.
Magyarázza el, hogy az adipocita lipolízis során felszabaduló FFA nagy részét hogyan és miért használják fel a 3-P glicerin reészterezéséhez éhezés során.
Beszélje meg a leptin, a ghrelin és az obestatin javasolt szerepét az etetési viselkedésben.
Jelezze, hogy a barna zsírszövet metabolizmusa hogyan segíti a hőszabályozást.
Határozza meg és vitassa meg a zsírszövetben vagy azon található tényezőket, amelyek segítenek a plazma FFA-koncentrációjának szabályozásában.
A cirkadián időzítés neurobiológiája
Rianne van der Spek,. Andries Kalsbeek, folyamatban az agykutatásban, 2012
Lipolízis
A lipolízis egy katabolikus folyamat, amely a triacil-glicerin (TAG) lebontásához vezet FFA-kká és glicerinné. A vérbe történő felszabadulás után az FFA-kat más szövetek szállítják és veszik fel, hogy felhasználják őket a β-oxidációhoz és az azt követő ATP-képződéshez. Egyes FFA-k nem hagyják el a zsírsejtet, és újraészterelik az intracelluláris TAG-be. A lipolízis során az intracelluláris TAG három fő lipáz hatására hidrolízisen megy keresztül: adipóz-triglicerid-lipáz (ATGL/desnutrin/foszfolipáz A22), HSL és monoacil-glicerin (MGL) lipáz. Az ATGL a TAG-ket diacilglicerinné (DAG) és egy FA-ként hidrolizálja, majd a HSL a DAG-t átalakítja monoacil-glicerinné (MAG) plusz egy FA -vá, MGL, majd a MAG-t hidrolizálja glicerin és egy harmadik FA előállításához (Ahmadian et al., 2010; Lafontan és Langin, 2009 ).
A lipolízist az ANS (Bartness et al., 2010a) és számos humorális tényező szabályozza, mint például a katekolaminok (a HSL foszforilezése), a glükokortikoidok (az ATGL felszabályozása), a natriuretikus peptidek és a növekedési hormon (Ahmadian et al., 2010; Lafontan és Langin, 2009). Míg a lipolízis szisztémás szabályozását viszonylag jól jellemezték, sokat kell még vizsgálni az (autokrin/parakrin) faktorok által a lipolízis adipocitákban történő helyi szabályozásával kapcsolatban. Az adipociták számos tényezőt választanak ki, amelyek képesek lokálisan szabályozni a lipolízist, például a lipolízist stimuláló TNFα és a lipolízist gátló adenozin (Ahmadian et al., 2010).
A zsírszövetbiológia módszerei, B. rész
Martina Schweiger,. Achim Lass, a Methods in Enzymology, 2014
Absztrakt
A lipolízist az észter kötések hidrolitikus hasításaként határozzák meg a trigliceridekben (TG), amelyek zsírsavak (FA) és glicerin képződését eredményezik. A gerincesek testében található két fő TG-készlet intracelluláris TG-ket és plazma/táplálkozási TG-ket tartalmaz. Ennek megfelelően ez megkülönböztetéshez vezet az intracelluláris és az intravaszkuláris/emésztőrendszeri lipolízis között. Ez a fejezet kizárólag az intracelluláris lipolízisre összpontosít, amelyet itt lipolízisnek nevezünk. A TG-k lipolitikus hasítása lényegében a test összes sejtjében és szövetében történik. Mindegyikben a kapott FA-kat endogén módon hasznosítják energiatermeléshez vagy bioszintetikus utakhoz, egy kivétellel, a fehér zsírszövet (WAT) kivételével. A WAT tápanyaghiány idején felszabadítja az FA-kat és a glicerint a nem adipózos szövetek ellátására. A lipolízis alapvető szerepe a lipid- és energiaháztartásban megköveteli a lipázaktivitások és a lipolitikus sebesség pontos mérését. A TG hidrolízisét közvetítő új enzimek és szabályozók közelmúltbeli felfedezése ezeket a méréseket bonyolultabbá tette. Itt részletes módszertant írunk le a lipolízis és a specifikus enzimek aktivitásának mérésére a sejtekben, szervekben és ezek kivonataiban.
Májtoxikológia
9.10.5.1. Zsírsavak a máj steatosisához lipolízissel
Az adipociták lipolízise szoros hormonális szabályozás alatt áll. A β-adrenerg receptorokkal kölcsönhatásban lévő katekolaminok stimulálják a lipolízist, és az inzulin számlálók ezt elnyomják a lipolízist (Holm et al. 2000). A NAFLD-betegeknél az inzulin képtelen elnyomni a perifériás lipolízist, hozzájárulva a keringésben megnövekedett FFA-hoz (Sanyal és mtsai 2001). A NAFLD betegeknél végzett in vivo stabil izotóp vizsgálatok azt is sugallják, hogy a zsírszövet nem megfelelő lipolízise hozzájárul a májban felhalmozódott trigliceridhez (Donnelly et al. 2005).
Míg ALD-vel rendelkező emberekről nem állnak rendelkezésre adatok, állatmodellekben a krónikus etanol-etetés a zsírszövetben a lipolízis diszregulációját eredményezi. A krónikus etanol rontja az inzulin képességét a zsír lipolízisének elnyomására, ami a glicerin keringésbe kerülésének sebességének csökkenését eredményezi (Kang et al. 2007a). Ez az inzulinrezisztencia mind az etanollal táplált patkányokból izolált adipocitákban, mind pedig in vivo megfigyelhető hiperinsulinémiás-euglikémiás szorító kontrollált körülmények között (Kang és mtsai. 2007a). A 2 H2O nyomjelzőként végzett vizsgálatokban az epididymális zsírszövet triglicerid-forgalmának sebessége megnőtt az etanollal történő etetés után (Kang et al. 2007a). A krónikus etanolos táplálás 2,3-szorosára növelte a triglicerid lebomlást a párosan táplált patkányokhoz képest, de nem volt hatással a triglicerid szintézisre (Kang és mtsai 2007a). Összességében ezek az adatok azt mutatják, hogy a zsírszövetben a lipolízis mély diszregulációja valószínűleg hozzájárul a máj steatosisának előrehaladásához mind a NAFLD, mind az ALD esetében.
Adipociták a normál szövetbiológiában
A lipolízis szabályozása
A lipolízist az adenil-cikláz aktiválása váltja ki, amely az adenozin-trifoszfátot (ATP) ciklikus adenozin-monofoszfáttá (cAMP) alakítja. A katekolaminok, amelyek a béta-adrenerg receptorokon (βADR) keresztül hatnak, stimulálják az adenil-ciklázt, de ezt a hatást ellensúlyozza az alfa-adrenerg receptor (αADR) aktiválása. Az adipociták adrenerg stimulációjának nettó hatását ezért az αADR-ek és βADR-ek száma és affinitása határozza meg az adipocita membránon. Éhomi állapotban a glükokortikoidok szabályozzák az ATGL transzkripciót, míg táplált állapotban az inzulin aktiválja a foszfodiészteráz 3B-t, ami csökkenti a cAMP-t, és ezáltal gátolja a lipolízist. Ciklusos guanozin-monofoszfát és PKA szignalizációval járó alternatív utak révén a pitvari natriuretikus peptid és az agy natriuretikus peptidje stimulálhatja a lipolízist.
Ezen neurológiai és endokrin kontrollerek mellett a lipolízist számos adipokin autokrin/parakrin hatása - például a lipolízist serkentő tumor nekrózis faktor (TNF) -α, valamint az adenozin és a zsírszövet-specifikus foszfolipáz A2 - autokrin/parakrin hatása alatt is ellenőrzi. gátolják. Ezeket az alfa Tumor nekrózis faktor és más adipocitokinek szakaszokban írjuk le.
Különböző fajokból és ugyanazon állat különböző raktáraiból származó adipociták válasza az adrenerg stimuláció lipolitikus hatására változó. Emberben a zsigeri hasi WAT nagyobb lipolitikus választ mutat a katekolaminokra, mint a szubkután WAT (lásd a Depó-specifikus különbségek a zsírszövetben és az adipocita biológiában ’). Még a szubkután depóban is vannak helyspecifikus különbségek, például felnőtt nőknél a gluteális WAT-ban lévő adipocyták kevesebb lipolízist mutatnak, mint a hasi szubkután WAT adipocitái.
A táplálkozás és a testtömeg megváltozása szívelégtelenség esetén
Zsírszövet (lásd még a 20. fejezetet)
A lipolízist elsősorban a hormonérzékeny lipáz enzim szabályozza. Főleg a katekolaminok aktiválják az adrenoreceptorokon keresztül. Nemrégiben megállapították, hogy a natriuretikus peptidek (pitvari, B-típusú és C-típusú natriuretikus peptidek) szerepet játszanak a zsírsejtek metabolizmusában. 128 A natriuretikus peptidek az intracelluláris cGMP és a lipolízis növelésével szabályozzák a lipid mobilizációt és a lipid oxidációt. 129 Emellett csökkentik a leptintermelést, növelik a keringő szabad zsírsavakat és növelik az inzulinrezisztenciát. 130
Az inzulin a fő antilipolitikus anyag. A zsírszövet elvesztését cachexiás betegeknél fokozott lipolízis vagy csökkent lipogenezis közvetítheti. 131 A rákos cachexiában szenvedő betegek vizsgálati adatai arra utalnak, hogy az uralkodó mechanizmus a fokozott lipolízis. A triglicerid lebomlását tükröző éhomi plazma glicerinszint magasabb a súlyvesztéses rákos betegeknél, mint azoknál, akik nem. 132,133 Ezt nem igazolták szívkachexiában szenvedő betegeknél vagy CHF-ben szenvedő betegeknél; csábító azonban feltételezni, hogy a katekolaminok és esetleg a natriuretikus peptidek megnövekedett szintje felelős lehet az ilyen betegeknél megfigyelt zsírszövet-veszteségért. A 119 TNF-α, amely mind a CHF 134, mind a szív cachexiájában túlzott mértékben expresszálódik, 90 fontos szerepet játszik a zsírsejtek lipolízisében és az inzulinjelzés gátlásában. Ez utóbbi fontos szempont az inzulinrezisztencia kialakulásában.
A zsírszövetbiológia módszerei, B. rész
Emilio P. Mottillo,. James G. Granneman, a Methods in Enzymology, 2014
Absztrakt
Az intracelluláris lipolízis fontos sejtfolyamat a kulcsfontosságú anyagcsere szövetekben, és bár sok minden ismert a lipolízis enzimatikus alapjairól, nem teljes a megértésünk arról, hogy ezek a folyamatok hogyan szerveződnek és szabályozódnak a sejtekben. A lipolízis az intracelluláris lipidcseppek felszínén zajlik, amelyeket ma jóhiszemű organellákként ismerünk el, és számos fehérjéről kiderült, hogy lipolitikus stimulációra reagálva megváltoztatja a lipidcseppekkel való kapcsolatukat. Az intracelluláris lipolízis kritikus térbeli és időbeli doménekkel rendelkezik, amelyek rögzített és élő sejtek nagy felbontású képalkotásával vizsgálhatók. Itt leírjuk a natív lipidcseppfehérjék nagy felbontású leképezésének technikáit, ezeknek a fehérjéknek a dinamikus kereskedelmét és interakcióját a modellrendszerekben, valamint az intracelluláris zsírsavtermelést fluoreszcens riporterek alkalmazásával élő adipocitákban.
Diagnózis, osztályozás, epidemiológia és biokémia
Sujoy Ghosh MD (általános orvoslás) DM (endokrinológia) MRCP (Egyesült Királyság) MRCPS (Glasgow), Andrew Collier BSc MD FRCP (Glasgow és Edinburgh), Churchill Diabetes zsebkönyvében (második kiadás), 2012
Lipolízis
A lipolízis a lipidek hidrolízise (1.4. Ábra). Metabolikusan a trigliceridek szabad zsírsavakra bontása a sejteken belül. Amikor a zsírokat energiára bontják, a folyamat β-oxidáció néven ismert: ketonok keletkeznek, és nagy mennyiségben találhatók meg ketózisban (az anyagcsere olyan állapotában, amely akkor fordul elő, amikor a máj zsírsavakká és ketontestekké alakítja át, amelyet a test energiára). A vizelet ketonjainak felismerésére lipolízis tesztcsíkokat, például Ketostixet használnak.
A következő hormonok indukálják a lipolízist: noradrenalin (epinefrin), noradrenalin (noradrenalin), glükagon, növekedési hormon és kortizol (bár a kortizol hatása még mindig nem egyértelmű). Ezek kiváltják a G-fehérjéhez kapcsolt receptorokat, amelyek aktiválják az adenilát-ciklázt. Ez megnöveli a cAMP termelését, amely aktiválja a protein kináz A-t, amely ezt követően aktiválja a zsírszövetben található lipázokat.
A triglicerideket a véren keresztül a megfelelő szövetekbe (zsír, izom stb.) Lipoproteinek, például chilomicronok szállítják. A chilomikronokon jelen lévő trigliceridek a célszövetek celluláris lipázain keresztül lipolízisen esnek át, amelyek glicerint és szabad zsírsavakat eredményeznek. A vérbe felszabaduló szabad zsírsavak ezután rendelkezésre állnak a sejtfelvételhez. A szabad zsírsavak, amelyeket a sejtek nem vesznek fel azonnal, kötődhetnek az albuminhoz, hogy a környező szövetekbe szállítsák és energiát igényelnek. A szérumalbumin a szabad zsírsavak fő hordozója a vérben. A glicerin a véráramba is bejut, és a máj vagy a vese felszívódik, ahol a glicerin-kináz enzim glicerin-3-foszfáttá alakítja át. A máj-glicerin-3-foszfát főleg dihidroxi-aceton-foszfáttá (DHAP), majd glicerinaldehid-3-foszfáttá (GA3P) alakul át, hogy újra csatlakozzon a glikolízis és a glükoneogenezis útjához.
Míg a lipolízis triglicerid hidrolízis, a trigliceridek lebontásának folyamata, az észterezés az a folyamat, amelynek során a trigliceridek képződnek. Az észterezés és a lipolízis lényegében egymás megfordulása.
Hipoglikémia
Plazma-β-hidroxi-butirát (β-OHB)
A lipolízis nagyon érzékeny a keringő inzulinkoncentrációkra. Böjt alatt normális egyéneknél fokozatosan csökken az inzulin koncentrációja, és fokozatosan növekszik a lipolízis és ennélfogva a keton testek, például a β-OHB (17.3. Ábra). A hiperinsulinaemia miatt hipoglikémiában szenvedő betegeknél a lipolízis elnyomódik, és a β-OHB koncentráció alacsony. A plazma β-OHB koncentrációja ≤2,7 mmol/L hosszan tartó böjt alatt és amikor a plazma glükózkoncentrációja
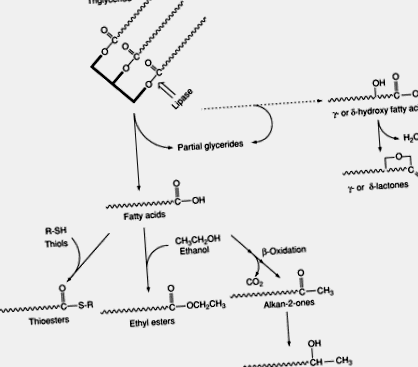
Sajtok | Kemény és félkemény sajtok gyártása
Lipolízis
3. ábra A sajt zsírsavainak termelésének és katabolizmusának általános útja az érés során.
- Levotiroxin - áttekintés a ScienceDirect témákról
- Liraglutid - áttekintés a ScienceDirect témákról
- Lipstatin - áttekintés a ScienceDirect témákról
- Indol-3-karbinol - áttekintés a ScienceDirect témákról
- Kefir - áttekintés a ScienceDirect témákról