Lizin
A lizin az emberi táplálkozás szempontjából nélkülözhetetlen aminosav, amelyet kenyérrel és más élelmiszerekkel kiegészítõ táplálékként használnak.
Kapcsolódó kifejezések:
- Aminosavak
- Acetilezés
- Chromatin
- Arginin
- Enzimek
- Metilezés
- Peptid
- Fehérje
- DNS
- Hiszton
Letöltés PDF formátumban
Erről az oldalról
Ipari biotechnológia és árutermékek
3.47.2.3 l-lizin
Molekuláris és sejtes változások a rákos sejtben
6.3 Hiszton lizin-demetiláz inhibitorok
Az LSD1 szükséges a normális differenciálódáshoz és az őssejtek fenntartásához. Az LSD1 azonban többféle rákban túlzottan expresszálódik, és úgy gondolják, hogy tumor elősegíti. 185 Az LSD1 leütésével járó vizsgálatok arra utalnak, hogy a csökkent LSD1 csökkenti a rákos sejtek növekedését, a migrációt és az inváziót. 186 Az első generációs LSD1 inhibitorok számos célhatással jártak, így meglehetősen mérgezőek és nehezen tanulmányozhatók, de felhasználták őket az AML LSD1 gátlásra való érzékenységének kimutatására. Nemrégiben olyan specifikusabb LSD1 katalitikus inhibitorokat fejlesztettek ki, amelyek a sejtállapot megváltoztatása révén gátolják a kissejtes tüdőrákos sejtek és az xenograftok növekedését. Normál sejtekben az LSD1 gátlása vagy leütése indukálja a proinflammatorikus citokinek expresszióját, ami arra utal, hogy az LSD1 normálisan segít visszaszorítani e gének expresszióját. 190,191
Mutációk hiszton lizin metiltranszferázokban és demetilázokban
Sara Weirich, Albert Jeltsch, az Encyclopedia of Cancer (harmadik kiadás), 2019
Absztrakt
A lizin-metiláció a hiszton és nonhiszton fehérjék fontos poszttranszlációs módosulása, amelynek kulcsszerepe van a karcinogenezisben. A közelmúltban a fehérje-lizin-metil-transzferázok (PKMT) és a lizin-demetilázok (KDM) visszatérő szomatikus mutációit azonosították különféle daganatokban. Ezek a mutációk a funkcióvesztés és a funkciógyarapodás hatásait okozhatják, ahol a mutáció megváltoztatja a kritikus enzimatikus tulajdonságokat vagy a szabályozó fehérjékkel való kölcsönhatást. Itt leírjuk a kiválasztott PKMT-k és KDM-ek szerepét a rákban, a szomatikus rákmutációk hatására összpontosítva. A szomatikus rákmutációk hatásának vizsgálata segít megérteni a PKMT-k és a KDM-ek karcinogenezisben betöltött szerepét és kialakítani az egyénre szabott rákterápiákat.
Az epigenetika enzimjei, A. rész
D. Hayward, P.A. Cole, Methods in Enzymology, 2016
Absztrakt
A lizin-specifikus demetiláz (LSD1) egy flavin-függő amin-oxidáz, amely szelektíven eltávolít egy vagy két metilcsoportot a H3 hisztonból a Lys4 helyzetben. Az 1. és 2. hiszton-deacetilázokkal együtt az LSD1 részt vesz a gének expressziójának epigenetikus elnémításában. Az LSD1 potenciális terápiás célpontként szerepel a rák és más betegségek esetében. Ebben a fejezetben többféle megközelítést tárgyalunk az LSD1 demetiláz aktivitás mérésére, valamint azok relatív erősségére és korlátaira az inhibitorok felfedezéséhez és mechanisztikus jellemzéséhez. Ezenkívül áttekintjük a monoamin-oxidáz inhibitorokból származó fő kémiai funkcionális csoportokat, amelyeket az LSD1 kontextusában demetiláz inhibitorokként vizsgáltak. Végül kiemelünk néhány példát a közelmúltban kifejlesztett LSD1 mechanizmuson alapuló inaktivátorokra és azok biomedicinális alkalmazásaira.
Herpes Simplex vírus
Maret Rossi, MD, Bradly Jacobs, MPH, ABOIM, az integratív gyógyászatban (negyedik kiadás), 2018
Táplálás
Lizin és arginin
A lizin egy esszenciális aminosav, amelyet a szervezet nem termel természetes úton. Számos klinikai vizsgálat arról számolt be, hogy a lizinben gazdag étrend és a lizin-kiegészítők csökkentik a herpes simplex vírusfertőzések megismétlődését, súlyosságát és gyógyulási periódusát. Ezzel szemben az arginin a lizin antagonistája. Griffith és mtsai. egy in vitro vizsgálat során bebizonyította, hogy a herpes simplex vírus arginint használ a replikációhoz. 25 Miller és mtsai. Megfigyelték, hogy a lizin verseng az argininnel a bél felszívódásáért, a sejtekbe történő transzportért és a vese tubulusban való újrafelszívódásáért, és az arginázt aktiválja az arginin lebontásával. Ezért ajánlott kerülni az argininben gazdag ételeket, például a dióféléket, a szemeket, a csokoládét és a finomított cukrokat, valamint a lizinben gazdag hús-, hal- és tejtermékek étrendjének fokozott bevitelét. 28 A kiválasztott ételek arginin- és lizinaránya 30 alatt van bemutatva (a herpesz szimplex vírusfertőzés étrendi szempontjait lásd a 20.2.
Aminosav szintézis ☆
Lizin
A lizinszintézis az aszpartát-szemialdehid és a piruvát kondenzációjával kezdődik, és ciklikus köztiterméket képez, amelyet a NADPH redukálva tetrahidrodipikolináttá alakul ( 5. ábra, második sor). Az E. coliban a tetrahidrodipikolinátot szukcinil-CoA-val szukcinilezzük, nitrogént adunk glutamát-függő transzaminációval, és a blokkoló csoportot eltávolítva LL-diaminopimelátot kapunk. Az epimeráz az LL-diaminopimelátot mezo-diaminopimeláttá alakítja, amelyet dekarboxilezve lizinné alakítanak. Egyes organizmusokban a tetrahidrodipikolinát közvetlenül mezo-diaminopimeláttá alakul át, és gram-pozitív organizmusokban a blokkoló szer egy acetilcsoport. Az egyetlen ismert transzamináz egyben az argininszintézis negyedik enzime is. Az enzim génjének törlése nincs hatással a növekedésre, ami redundáns enzimekre utal a transzamináz reakcióhoz.
A lizinszintézis szabályozása összetett, ami a szintetizálandó fontos köztitermékek számát figyelembe véve megfelelő. A lizin kinetikailag szabályozza az aszpartokináz III-at és a lizinszintézis első elkövetett reakcióját - a piruvát aszpartikus szemialdehiddel történő kondenzációját. A lizin-specifikus út génjei nem kapcsolódnak egymáshoz. Az ArgP aktiválja az aszpartátot lizinné alakító kilenc enzim közül öt transzkripcióját, a lizin pedig megakadályozza ezt az aktivációt. A diaminopimeláttal komplexált LysR aktiválja a diaminopimelát-dekarboxiláz transzkripcióját, amely az út utolsó enzime. A diaminopimelát éhezés egy ismeretlen mechanizmus révén szabályozza a lizinszintézis első elkötelezett lépését.
Membrán kontaktorok és integrált membrán műveletek
4.06.4.4.1 Lizin
A lizin fontos aminosav az emberi és állati táplálékban, és magas koncentrációban megtalálható a húsban, a baromfiban és a tejtermékekben, míg a növényi fehérjék csak kisebb koncentrációban tartalmazzák ezt az aminosavat. A lizin biológiailag aktív l-konfigurációját ezért adalékként használják az emberi és állati táplálékban. Az ipari lizintermelés fejlődése szorosan összefügg az aminosav-termelés fermentációval történő általános fejlődésével az 1950-es években. Annak ellenére, hogy a lizint szintetikusan lehet előállítani, a gazdaságosabb biológiai módszert szinte kizárólag.
Az l-lizin előállításának első lépése az erjesztés, jellemzően Corynebacteria vagy Brevibacteria törzseket használva lizintermelő baktériumként és melaszszént szénforrásként. Az erjesztés után az UF felhasználható a fermentlé hatékony elválasztására retentátfolyammá, amely a koncentrált mikroorganizmusokat és a tisztított l-lizinnel rendelkező permeátumáramot tartalmazza. A megtisztított UF-permeátumot ezután RO-val előzetesen bepárolhatjuk, majd bepároljuk és porlasztva szárítjuk. Alternatív megoldásként a nagyobb tisztaság elérése érdekében a lizint az UF-permeátból ioncserélő lépéssel kinyerhetjük, amely után az ioncserélő eluátumot közvetlenül kristályosíthatjuk vagy RO-val előre bepárolhatjuk bepárlás és porlasztva szárítás előtt.
Rák, immunológia és gyulladás, valamint fertőző betegség
5.08.2.6.1. Lizin-demetilázok
A lizin-metil-jeleket a lizin-demetiláz (KDM) enzimcsalád szekvenciafüggő módon távolítja el. A KDM-ek két alcsaládra oszlanak, a lizin-specifikus demetilázokra (LSD1/KDM1) és a Jumonji C (JmjC) -domaintartalmú demetilázokra (KDMs2–7). A lizin-specifikus demetiláz enzimcsalád flavintól függ, míg a JmjC doméntartalmú enzimek Fe (II) és 2-oxoglutaráttól függenek. Beszámoltak arról, hogy a Jumonji domént tartalmazó 6 (JmjD6) arginin-demetilezési aktivitással rendelkezik; azonban ez a tevékenység ellentmondó jelentések tárgyát képezi. 7 Jelenleg három KDM1-gátló van klinikai vizsgálat alatt ( Asztal 1 ).
Asztal 1 . A jóváhagyott és a klinikai vizsgálatokban szereplő epigenetikus szabályozók összefoglalása
| Belinostat | HDAC/pan-HDAC | Jóváhagyott | Perifériás T-sejtes lymphoma |
| Panobinostat | HDAC/pan-HDAC | Jóváhagyott | Myeloma multiplex |
| Pracinostat | HDAC/I., II., IV. Osztály | Jóváhagyott | AML, T-sejtes lymphoma |
| Romidepsin | HDAC/Zn függő HDACS | Jóváhagyott | Bőr T-sejtes lymphoma |
| Vorinostat | HDAC/pan-HDAC | Jóváhagyott | Bőr T-sejtes lymphoma |
| Entinostat | HDAC/I., III. Osztály | II/III. Szakasz | Többszörös rák |
| Givinostat | HDAC/I., II | Fázis II | |
| Mocetinostat | HDAC/pan-HDAC | Fázis II | Limfóma, leukémia |
| Quisinostat | HDAC/pan-HDAC | Fázis II | Leukémia, MLL, limfóma, szilárd rosszindulatú daganatok |
| Resminostat | HDAC | Fázis II | HCC |
| Tacedinaline | HDAC/HDAC1, HDAC2 | Fázis II | Myeloma multiplex |
| Tazemetosztát | HMT/EZH2 | Fázis II | Limfóma, szilárd daganatok |
| Valproinsav | HDAC/pan-HDAC | Fázis II | Többszörös rák |
| ACY-1215 | HDAC/HDAC6 | Fázis I/II | Myeloma multiplex |
| AR-42 | HDAC/pan-HDAC | Fázis I/II | MLL, limfóma, leukémia |
| ORY-1001 | KDM/KDM1A | Fázis I/II | AML |
| OTX015 | Bromodomain/BET | Fázis I/II | Glioblastoma |
| Tranilcipromin | KDM/KDM1A | Fázis I/II | AML |
| ABBV-075 | Bromodomain | I. fázis | Előrehaladott rákos megbetegedések |
| Abexinostat | HDAC/pan-HDAC | I. fázis | B-sejtes lymphoma |
| BAY-1238097 | Bromodomain/BET | I. fázis | Neoplazmák |
| BMS-986158 | Bromodomain/BET | I. fázis | Szilárd daganatok |
| CPI-0610 | Bromodomain/BET | I. fázis | Limfóma |
| CPI-1205 | HMT/EZH2 | I. fázis | B-sejtes lymphoma |
| CUDC-907 | HDAC/I., IIB osztály | I. fázis | Limfóma, myeloma multiplex, szilárd tumorok |
| GSK525762 | Bromodomain/BDR4 | 1. szakasz | Hematológiai malignitás, NUT középvonal carcinoma |
| GSK2816126 | HMT/EZH2 | I. fázis | B-sejtes lymphoma, follikuláris lymphoma |
| GSK2879552 | KDM/KDM1A | I. fázis | AML |
| Pinometostat | HMT/DOT1L | I. fázis | Leukémia |
| TEN-010 | Bromodomain/BET | I. fázis | AML és szilárd daganatok |
FERMENTÁCIÓ (IPARI) Aminosavak előállítása
L-lizin előállítása
A lizin képviseli a leggyorsabban növekvő aminosav szegmenst. A világon elfogyasztott gabonafélék nagy részében hiányzik az aminosav, az l-lizin. Ez elengedhetetlen összetevője az állatok növekedésének, és fontos része a milliárd dolláros takarmányiparnak. A lizinpótlás a gabonaféléket kiegyensúlyozott táplálékká vagy takarmányká alakítja az állatok számára, beleértve a baromfit, a sertést és más állatállományt is. Az állati takarmány mellett a lizint gyógyszerekben, étrend-kiegészítőkben és kozmetikumokban használják. Becslések szerint az l-lizin globális piaca az elmúlt 20 évben csaknem 20-szorosára nőtt, és számos olyan vállalat, mint az Ajinomoto Co. Inc. és az Archer Daniels Midland Co., jelenleg jelentős beruházásokkal bővíti létesítményeit Brazíliában, Kínában és Az Egyesült Államok.
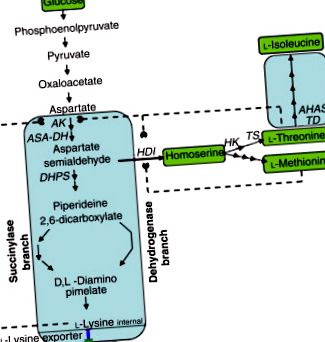
2. ábra . Bioszintetikus út az l-lizinhez, az l-treoninhoz és az l-izoleucinhoz a C. glutamicumban. AK, aszpartát-kinázok; ASA-DH, aszpartát-szemialdehid-dehidrogenáz; HDI, homoserin-dehidrogenáz; HK, homoserin kináz; TS, treonin-szintetáz; TD, treonin-dehidratáz; AHAS, acetohidroxisav-szintáz.
Sok munkát végeztek a glutamát túltermelő törzsek auxotróf és szabályozó mutánsain a lizin előállítása érdekében. A homoserin-dehidrogenáz (HDI) genetikai eltávolításával egy glutamáttermelő vad típusú Corynebacterium törzsből lizint termelő mutánssá alakult át, amely nem tud növekedni, hacsak metionint és treonint nem adnak a táptalajhoz. Amíg a treonin-kiegészítést alacsony szinten tartják, a treonin intracelluláris koncentrációja korlátozó és az AK visszacsatoló gátlása megkerülhető, ami több mint 70 g l-1 lizin kiválasztódásához vezet a tenyészfolyadékokban. Egyes törzsekben a metionin és az izoleucin hozzáadása a táptalajhoz a lizin túltermelésének növekedéséhez vezetett. Az S-2-amino-etil-cisztein (AEC; tiarizin) rezisztencia kiválasztása blokkolja az AK visszacsatoló gátlását. Az AK deregulációjához hasznos egyéb antimetabolitok közé tartozik az a-ketobutirát és az aszpartát-hidroxamát keveréke. A leucin auxotrófiája növelheti a lizintermelést. Az l-lizin titerekről ismert, hogy 170 g l -1 .
A lizin C. glutamicum általi kiválasztása aktív transzport révén több mint 100 mM koncentrációt ér el a külső közegben. A lizint, egy kationt, ki kell választani a membránpotenciál-gradienssel szemben (kívül pozitív), és a kiválasztást hordozó közvetíti. A rendszer az elektron mozgatóerejétől függ, nem az adenozin-trifoszfáttól.
Genom alapú törzsrekonstrukciót alkalmaztak a C. glutamicum lizintermelési sebességének javítására azáltal, hogy összehasonlítottuk a magasan termelő törzset (a termelési ráta valamivel kevesebb, mint 2 g l -1 h -1) és egy vad típusú törzset. A termelési törzsből származó 16 gén összehasonlítása, amelyek a glükóz és a lizin közötti út enzimjeit kódolják, mutációkat tártak fel a gének közül ötben. Ezen mutációk közül három (a HDI-t, az AK-t és a piruvat-karboxilázt kódoló hom, lysC és pyc kódolása) a vad típusba új törzset hozott létre, amely 27 óra alatt 80 gl-1-et termelt, 3 gl-1 sebességgel. h −1. Az l-lizin termelés további növekedését (15%) figyelték meg egy mutáció bevezetésével a 6-foszfoglukonát-dehidrogenáz génben (gnd). Az enzimatikus elemzés kimutatta, hogy a mutáns enzim kevésbé érzékeny, mint a vad típusú enzim, az intracelluláris metabolitok alloszterikus gátlására. Az izotóp alapú metabolikus fluxus elemzés kimutatta, hogy a gnd mutáció a pentóz-foszfát útvonalon keresztül az l-lizin termelés során a szén-fluxus 8% -os növekedését eredményezte. Végül az mqo mutáció (malát: kinon-oxidoreduktáz) bevezetésével lehetővé vált mind a termelés sebességének, mind az l-lizin-titernek 95 g l-1-re történő növelése szakaszosan táplált tenyésztéssel.
A metabolikus mérnöki rendszerek alkalmazásával 12 meghatározta a központi metabolikus enzimeket kódoló gének genomon alapuló változását, kívánt esetben, a szilíciummodellezéssel megjósolva, az optimális l-lizin útvonal-felhasználás felé irányította a fő szén-fluxusokat. A mérnökök által előállított C. glutamicum törzs nagy mennyiségű, 55 g/g glükóz hozammal rendelkező lizint, 120 g L -1 lizin titeret és 4,0 g l -1 h -1 termelékenységet tudott előállítani szakaszosan táplált tenyészetekben.
- Liver Fluke - áttekintés a ScienceDirect témákról
- Kefir - áttekintés a ScienceDirect témákról
- Kemény széklet - áttekintés a ScienceDirect témákról
- Máj policisztás betegség - áttekintés a ScienceDirect témákról
- Inzulinrezisztencia - áttekintés a ScienceDirect témákról