Lizin
A lizin fontos szerepet játszik a fehérjék felszívódásában és felhasználásában, a táplálkozási egyensúlyban, az idegrendszer működésének javításában, az immunrendszer működésének fokozásában, az oszteoporózis megelőzésében és más rendszerekben (Behr-Roussel et al., 2000).
Kapcsolódó kifejezések:
- Aminosav
- Enzim
- Peptid
- Fehérje
- DNS
- Arginin
- Hiszton
- H3 hiszton
- Acetilezés
- Metilezés
Letöltés PDF formátumban
Erről az oldalról
Mutációk hiszton lizin metiltranszferázokban és demetilázokban
Sara Weirich, Albert Jeltsch, az Encyclopedia of Cancer (harmadik kiadás), 2019
Absztrakt
A lizin-metiláció a hiszton és nonhiszton fehérjék fontos poszttranszlációs módosulása, amelynek kulcsszerepe van a karcinogenezisben. A közelmúltban a fehérje-lizin-metil-transzferázok (PKMT) és a lizin-demetilázok (KDM) visszatérő szomatikus mutációit azonosították különféle daganatokban. Ezek a mutációk a funkcióvesztés és a funkciógyarapodás hatásait okozhatják, ahol a mutáció megváltoztatja a kritikus enzimatikus tulajdonságokat vagy a szabályozó fehérjékkel való kölcsönhatást. Itt leírjuk a kiválasztott PKMT-k és KDM-ek szerepét a rákban, a szomatikus rákmutációk hatására összpontosítva. A szomatikus rákmutációk hatásának vizsgálata segít megérteni a PKMT-k és a KDM-ek karcinogenezisben betöltött szerepét és kialakítani az egyénre szabott rákterápiákat.
Herpes Simplex vírus
Maret Rossi, MD, Bradly Jacobs, MPH, ABOIM, az integratív gyógyászatban (negyedik kiadás), 2018
Táplálás
Lizin és arginin
A lizin egy esszenciális aminosav, amelyet a szervezet nem termel természetes úton. Számos klinikai vizsgálat arról számolt be, hogy a lizinben gazdag étrend és a lizin-kiegészítők csökkentik a herpes simplex vírusfertőzések megismétlődését, súlyosságát és gyógyulási periódusát. Ezzel szemben az arginin a lizin antagonistája. Griffith és mtsai. egy in vitro vizsgálat során bebizonyította, hogy a herpes simplex vírus arginint használ a replikációhoz. 25 Miller és mtsai. Megfigyelték, hogy a lizin verseng az argininnel a bél felszívódásáért, a sejtekbe történő transzportért és a vese tubulusban való újrafelszívódásáért, és az arginázt aktiválja az arginin lebontásával. Ezért ajánlott kerülni az argininben gazdag ételeket, például a dióféléket, a szemeket, a csokoládét és a finomított cukrokat, valamint a lizinben gazdag hús-, hal- és tejtermékek étrendjének fokozott bevitelét. 28 A kiválasztott ételek arginin- és lizinaránya 30 alatt van bemutatva (a herpesz szimplex vírusfertőzés étrendi szempontjait lásd a 20.2.
Aminosav szintézis ☆
Lizin
A lizinszintézis az aszpartát-szemialdehid és a piruvát kondenzációjával kezdődik, és ciklikus köztiterméket képez, amelyet a NADPH redukálva tetrahidrodipikolináttá alakul ( 5. ábra, második sor). Az E. coliban a tetrahidrodipikolinátot szukcinil-CoA-val szukcinilezzük, nitrogént adunk glutamát-függő transzaminációval, és a blokkoló csoportot eltávolítva LL-diaminopimelátot kapunk. Az epimeráz az LL-diaminopimelátot mezo-diaminopimeláttá alakítja, amelyet dekarboxilezve lizinné alakítanak. Egyes organizmusokban a tetrahidrodipikolinát közvetlenül mezo-diaminopimeláttá alakul át, és gram-pozitív organizmusokban a blokkoló szer egy acetilcsoport. Az egyetlen ismert transzamináz egyben az argininszintézis negyedik enzime is. Az enzim génjének törlése nincs hatással a növekedésre, ami redundáns enzimekre utal a transzamináz reakcióhoz.
A lizinszintézis szabályozása összetett, ami a szintetizálandó fontos köztitermékek számát figyelembe véve megfelelő. A lizin kinetikailag szabályozza az aszpartokináz III-at és a lizinszintézis első elkövetett reakcióját - a piruvát aszpartikus szemialdehiddel történő kondenzációját. A lizin-specifikus út génjei nem kapcsolódnak egymáshoz. Az ArgP aktiválja az aszpartátot lizinné alakító kilenc enzim közül öt transzkripcióját, a lizin pedig megakadályozza ezt az aktivációt. A diaminopimeláttal komplexált LysR aktiválja a diaminopimelát-dekarboxiláz transzkripcióját, amely az út utolsó enzime. A diaminopimelát éhezés egy ismeretlen mechanizmus révén szabályozza a lizinszintézis első elkötelezett lépését.
Rák, immunológia és gyulladás, valamint fertőző betegség
5.08.2.6.1. Lizin-demetilázok
A lizin-metil-jeleket a lizin-demetiláz (KDM) enzimcsalád szekvenciafüggő módon távolítja el. A KDM-ek két alcsaládra oszlanak, a lizin-specifikus demetilázokra (LSD1/KDM1) és a Jumonji C (JmjC) -domaintartalmú demetilázokra (KDMs2–7). A lizin-specifikus demetiláz enzimcsalád flavintól függ, míg a JmjC doméntartalmú enzimek Fe (II) és 2-oxoglutaráttól függenek. Beszámoltak arról, hogy a Jumonji domént tartalmazó 6 (JmjD6) arginin-demetilezési aktivitással rendelkezik; azonban ez a tevékenység ellentmondó jelentések tárgyát képezi. 7 Jelenleg három KDM1-gátló van klinikai vizsgálat alatt ( Asztal 1 ).
Asztal 1 . A jóváhagyott és a klinikai vizsgálatokban szereplő epigenetikus szabályozók összefoglalása
| Belinostat | HDAC/pan-HDAC | Jóváhagyott | Perifériás T-sejtes lymphoma |
| Panobinostat | HDAC/pan-HDAC | Jóváhagyott | Myeloma multiplex |
| Pracinostat | HDAC/I., II., IV. Osztály | Jóváhagyott | AML, T-sejtes lymphoma |
| Romidepsin | HDAC/Zn függő HDACS | Jóváhagyott | Bőr T-sejtes lymphoma |
| Vorinostat | HDAC/pan-HDAC | Jóváhagyott | Bőr T-sejtes lymphoma |
| Entinostat | HDAC/I., III. Osztály | II/III. Szakasz | Többszörös rák |
| Givinostat | HDAC/I., II | Fázis II | |
| Mocetinostat | HDAC/pan-HDAC | Fázis II | Limfóma, leukémia |
| Quisinostat | HDAC/pan-HDAC | Fázis II | Leukémia, MLL, limfóma, szilárd rosszindulatú daganatok |
| Resminostat | HDAC | Fázis II | HCC |
| Tacedinaline | HDAC/HDAC1, HDAC2 | Fázis II | Myeloma multiplex |
| Tazemetosztát | HMT/EZH2 | Fázis II | Limfóma, szilárd daganatok |
| Valproinsav | HDAC/pan-HDAC | Fázis II | Többszörös rák |
| ACY-1215 | HDAC/HDAC6 | Fázis I/II | Myeloma multiplex |
| AR-42 | HDAC/pan-HDAC | Fázis I/II | MLL, limfóma, leukémia |
| ORY-1001 | KDM/KDM1A | Fázis I/II | AML |
| OTX015 | Bromodomain/BET | Fázis I/II | Glioblastoma |
| Tranilcipromin | KDM/KDM1A | Fázis I/II | AML |
| ABBV-075 | Bromodomain | I. fázis | Előrehaladott rákos megbetegedések |
| Abexinostat | HDAC/pan-HDAC | I. fázis | B-sejtes lymphoma |
| BAY-1238097 | Bromodomain/BET | I. fázis | Neoplazmák |
| BMS-986158 | Bromodomain/BET | I. fázis | Szilárd daganatok |
| CPI-0610 | Bromodomain/BET | I. fázis | Limfóma |
| CPI-1205 | HMT/EZH2 | I. fázis | B-sejtes lymphoma |
| CUDC-907 | HDAC/I., IIB osztály | I. fázis | Limfóma, myeloma multiplex, szilárd tumorok |
| GSK525762 | Bromodomain/BDR4 | 1. szakasz | Hematológiai malignitás, NUT középvonal carcinoma |
| GSK2816126 | HMT/EZH2 | I. fázis | B-sejtes lymphoma, follikuláris lymphoma |
| GSK2879552 | KDM/KDM1A | I. fázis | AML |
| Pinometostat | HMT/DOT1L | I. fázis | Leukémia |
| TEN-010 | Bromodomain/BET | I. fázis | AML és szilárd daganatok |
FERMENTÁCIÓ (IPARI) Aminosavak előállítása
L-lizin előállítása
A lizin képviseli a leggyorsabban növekvő aminosav szegmenst. A világon elfogyasztott gabonafélék nagy részében hiányzik az aminosav, az l-lizin. Ez elengedhetetlen összetevője az állatok növekedésének, és fontos része a milliárd dolláros takarmányiparnak. A lizinpótlás a gabonaféléket kiegyensúlyozott táplálékká vagy takarmányká alakítja az állatok számára, beleértve a baromfit, a sertést és más állatállományt is. Az állati takarmány mellett a lizint gyógyszerekben, étrend-kiegészítőkben és kozmetikumokban használják. Becslések szerint az l-lizin globális piaca az elmúlt 20 évben csaknem 20-szorosára nőtt, és számos olyan vállalat, mint az Ajinomoto Co. Inc. és az Archer Daniels Midland Co., jelenleg jelentős beruházásokkal bővíti létesítményeit Brazíliában, Kínában és Az Egyesült Államok.
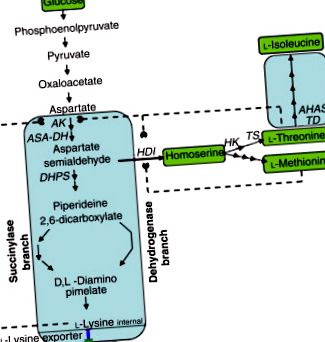
2. ábra . Bioszintetikus út az l-lizinhez, az l-treoninhoz és az l-izoleucinhoz a C. glutamicumban. AK, aszpartát-kinázok; ASA-DH, aszpartát-szemialdehid-dehidrogenáz; HDI, homoserin-dehidrogenáz; HK, homoserin kináz; TS, treonin-szintetáz; TD, treonin-dehidratáz; AHAS, acetohidroxisav-szintáz.
Sok munkát végeztek a glutamát túltermelő törzsek auxotróf és szabályozó mutánsain a lizin előállítása érdekében. A homoserin-dehidrogenáz (HDI) genetikai eltávolításával egy glutamáttermelő vad típusú Corynebacterium törzsből lizint termelő mutánssá alakult át, amely nem tud növekedni, hacsak metionint és treonint nem adnak a táptalajhoz. Amíg a treonin-kiegészítést alacsony szinten tartják, a treonin intracelluláris koncentrációja korlátozó és az AK visszacsatoló gátlása megkerülhető, ami több mint 70 g l-1 lizin kiválasztódásához vezet a tenyészfolyadékokban. Egyes törzsekben a metionin és az izoleucin hozzáadása a táptalajhoz a lizin túltermelésének növekedéséhez vezetett. Az S-2-amino-etil-cisztein (AEC; tiarizin) rezisztencia kiválasztása blokkolja az AK visszacsatoló gátlását. Az AK deregulációjához hasznos egyéb antimetabolitok közé tartozik az a-ketobutirát és az aszpartát-hidroxamát keveréke. A leucin auxotrófiája növelheti a lizintermelést. Az l-lizin titerekről ismert, hogy 170 g l -1 .
A lizin C. glutamicum általi kiválasztása aktív transzport révén több mint 100 mM koncentrációt ér el a külső közegben. A lizint, egy kationt, ki kell választani a membránpotenciál-gradienssel szemben (kívül pozitív), és a kiválasztást hordozó közvetíti. A rendszer az elektron mozgatóerejétől függ, nem az adenozin-trifoszfáttól.
Genom alapú törzsrekonstrukciót alkalmaztak a C. glutamicum lizintermelési sebességének javítására azáltal, hogy összehasonlítottuk a magasan termelő törzset (a termelési ráta valamivel kevesebb, mint 2 g l -1 h -1) és egy vad típusú törzset. A termelési törzsből származó 16 gén összehasonlítása, amelyek a glükóz és a lizin közötti út enzimjeit kódolják, mutációkat tártak fel a gének közül ötben. Ezen mutációk közül három (a HDI-t, az AK-t és a piruvat-karboxilázt kódoló hom, lysC és pyc kódolása) a vad típusba új törzset hozott létre, amely 27 óra alatt 80 gl-1-et termelt, 3 gl-1 sebességgel. h −1. Az l-lizin termelés további növekedését (15%) figyelték meg egy mutáció bevezetésével a 6-foszfoglukonát-dehidrogenáz génben (gnd). Az enzimatikus elemzés kimutatta, hogy a mutáns enzim kevésbé érzékeny, mint a vad típusú enzim, az intracelluláris metabolitok alloszterikus gátlására. Az izotóp alapú metabolikus fluxus elemzés kimutatta, hogy a gnd mutáció a pentóz-foszfát útvonalon keresztül az l-lizin termelés során a szén-fluxus 8% -os növekedését eredményezte. Végül az mqo mutáció (malát: kinon-oxidoreduktáz) bevezetésével lehetővé vált mind a termelés sebességének, mind az l-lizin-titernek 95 g l-1-re történő növelése szakaszosan táplált tenyésztéssel.
A metabolikus mérnöki rendszerek alkalmazásával 12 meghatározta a központi metabolikus enzimeket kódoló gének genomon alapuló változását, kívánt esetben, a szilíciummodellezéssel megjósolva, az optimális l-lizin útvonal-felhasználás felé irányította a fő szén-fluxusokat. A mérnökök által előállított C. glutamicum törzs nagy mennyiségű, 55 g/g glükóz hozammal rendelkező lizint, 120 g L -1 lizin titeret és 4,0 g l -1 h -1 termelékenységet tudott előállítani szakaszosan táplált tenyészetekben.
Új epigenetikus terápiák - Bromodomain ligandumok
David S. Hewings,. Stuart J. Conway, az epigenetikus rákterápiában, 2015
A lizin-acetilezésről ismert, hogy fontos szerepet játszik a rákkal kapcsolatos folyamatokban. Következésképpen nagy érdeklődés mutatkozott azon enzimek gátlóinak kifejlesztése iránt, amelyek acetilcsoportot adnak a lizin, lizin/hiszton acetiltranszferázok ε-nitrogénatomjához, valamint az ezeket a csoportokat eltávolító enzimek, a lizin/hiszton deacetilázok. A bromodomének olyan fehérjemodulok, amelyek kötődnek („felismerik”) az N-ε-acetil-l-lizint (acetil-lizin) és megkönnyítik a multiprotein állványok összeszerelését a fehérje – fehérje kölcsönhatások közvetítésével. Csak viszonylag nemrégiben tekintik a bromodoméneket terápiás szempontból fontos célpontoknak, de a gyógyszerszerű bromodomain ligandumok kifejlesztése utáni gyors előrelépés. Itt ismertetjük a BET (brómdomain és extraterminális) brómdomain ligandumok fejlesztésének előrehaladását és alkalmazását a rák szempontjából releváns biológiai rendszerekben. Ezenkívül tárgyaljuk a nem BET bromodomain ligandumok azonosításának előrehaladását.
Kofaktorok
7.19.4.2.1. LTQ bioszintézis
7. séma Az LTQ bioszintézisének mechanizmusa.
Szintetikus módszerek VI - Enzimatikus és Félenzimatikus
7.12.2.1. 1 -AAO
l - A lizin-oxidáz (EC 1.4.3.14) katalizálja az l-lizin ω-amino-csoportjának oxidációját. Ezt az enzimet egy egycserépes, kétenzimű rendszerben alkalmazták több nem természetes ciklikus aminosav szintéziséhez a megfelelő lineáris prekurzorokból. A diaminosav átalakítására kezdetben 15 l-lizin-oxidázt használtak (alternatívaként l- vagy d-AAO-t is használhattak). 1 a megfelelő a-keto aminosavba 2, amely spontán in situ ciklizálódott az iminosavvá 3 ( 2. ábra ). Egy második enzim, nevezetesen az N-metil-1-aminosav-dehidrogenáz (NMAADH) hozzáadása az imin redukcióját eredményezte a ciklikus aminosav előállításához. 4 jó hozammal és kiváló optikai tisztasággal. Átfogó deracemizációs eljárást hajtottunk végre a racém analógok felhasználásával is 1 kiindulási anyagként a d -AAO-val és az NMAADH-val együtt.
2. ábra . L-lizin-oxidáz alkalmazása N-metilaminosav-dehidrogenázzal az (R) átalakításához-1 ciklikus aminosavvá (R)-4.
A rapamicin géncsoportban azonosították a lizin-ciklodeamináz enzimet, amely katalizálja az l-lizin oxidatív ciklizációját l-pipekolsavvá. A gén klónozása, majd az enzim túlexpressziója és tisztítása (3. ábra) olyan biokatalizátort eredményezett, amely képes átalakítani az l-lizint 5. l-pipekolsavvá 6.. Az enzim azonban sokkal alacsonyabb aktivitást mutatott az l -ornitin ellen, mint az l-lizin (13 mM -1 perc -1), és a d-lizin nem volt aktív. Az enzim mechanizmusát az enzim kofaktor igényeinek és az izotópos szubsztrát jelölésének tanulmányozásával vizsgáltuk. 16.
3. ábra L-lizin átalakítása 5. l-pipekolsavvá 6. a Streptomyces hygroscopicus-ból nyert lizin-ciklodeaminázt használva.
- Liver Fluke - áttekintés a ScienceDirect témákról
- Kefir - áttekintés a ScienceDirect témákról
- Kemény széklet - áttekintés a ScienceDirect témákról
- Máj policisztás betegség - áttekintés a ScienceDirect témákról
- Inzulinrezisztencia - áttekintés a ScienceDirect témákról