Molekuláris utak: zsírgyulladás, mint az elhízással összefüggő rák közvetítője
Louise R. Howe
1 Sejt- és fejlődésbiológiai tanszék, Weill Cornell Medical College, New York, NY
Kotha Subbaramaiah
2 Orvostudományi Tanszék, Weill Cornell Orvosi Főiskola, New York, NY
Clifford A. Hudis
2 Orvostudományi Tanszék, Weill Cornell Orvosi Főiskola, New York, NY
3 Orvosi Osztály, Memorial Sloan-Kettering Cancer Center, New York, NY
Andrew J. Dannenberg
2 Orvostudományi Tanszék, Weill Cornell Orvosi Főiskola, New York, NY
Absztrakt
Háttér
A megnövekedett testtömeg következtében felmerülő többszörös molekuláris változás valószínűleg hozzájárul a neoplazia gyakoribb előfordulásához és az elhízott egyének rosszabb kimeneteléhez. Ide tartozik a hiperinsulinémia, az inzulinszerű növekedési faktor 1 (IGF-1) szintjének emelkedése, az adipokin egyensúlyhiánya, valamint a megnövekedett citokin és ösztrogén szint (6). Fontos, hogy az elhízást nemcsak a megnövekedett zsírteher jellemzi, hanem a megváltozott zsírbiológia is. Pontosabban, az elhízott egyének fehér zsírszövetei és az egér elhízási modelljei gyulladást mutatnak, amelyet a leukociták, köztük a makrofágok, valamint a CD8-pozitív T-limfociták és hízósejtek beszivárgása határoz meg (7). A zsírgyulladást egyre inkább az elhízással összefüggő betegségek, például a II-es típusú cukorbetegség kulcsfontosságú elemének ismerik el. Itt a gyulladt zsírszövet proneoplasztikus következményeire összpontosítunk, meghatározva a parakrin kölcsönhatásokat az adipociták, a makrofágok és más sejttípusok között (1. ábra), amelyek valószínűleg hozzájárulnak a megnövekedett rákos megbetegedésekhez általában és a túlzott zsírbetegséghez kapcsolódó rosszabb általános eredményekhez. Ezeknek a megfigyeléseknek egyedülálló következményei vannak az ösztrogén-vezérelt karcinogenezisre is.
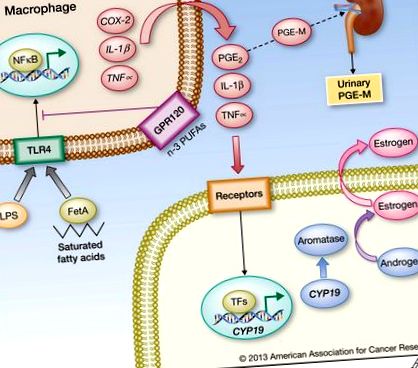
Az elhízással összefüggő lipolízis eredményeként az adipocitákból felszabaduló telített zsírsavak komplexet alkotnak a Fetuin A-val (FetA), és aktiválják a Toll-szerű receptor 4 (TLR4) jelátvitelt, ami fokozott NFκB aktivitást eredményez a makrofágokban. Ezenkívül a bélnyálkahártya integritásának elhízás által okozott károsodása következtében a szisztémás keringésbe belépő bakteriális endotoxin (lipopoliszacharid, LPS) szintén előidézheti az NFκB aktiválódását a TLR4 ligálás útján. Az NFκB a proinflammatorikus gének, köztük a COX-2, IL-1β és TNFα expresszióját indukálja makrofágokban. Az n-3 többszörösen telítetlen zsírsavak (PUFA) a GPR120-on keresztül jeleznek és elnyomhatják a TLR4 jelátvitelt. A citokinek és a COX-2-eredetű PGE2 aktiválják az aromatázt kódoló CYP19 gén transzkripcióját a szomszédos sejtekben, beleértve a preadipocitákat is, ami megnövekedett aromáz expresszióhoz és aktivitáshoz vezet. Következésképpen fokozódik az ösztrogén bioszintézise, amely az ER célgének, köztük a progeszteron receptor fokozott expressziójaként nyilvánul meg. A zsírgyulladás szisztémás következményei közé tartozik a megnövekedett keringő citokinek szintje, valamint a PGE2 metabolit PGE-M felhalmozódása a vizeletben. A vizelet PGE-M szintje ezért értékes biomarkert jelenthet az elhízással kapcsolatos fehér zsírszövet gyulladásban.
A zsírszöveti makrofágok az elhízott zsírszövet sejtjeinek akár 40% -át is tartalmazhatják, és gazdag citokinek forrását jelenthetik, amelyek kulcsfontosságú közvetítők az elhízással járó inzulinrezisztencia fokozott kockázatának (7). Szövettanilag ez a makrofág infiltráció gyulladásos gócként nyilvánul meg, amelyet koronaszerű struktúráknak (CLS) neveznek, amelyek makrofágok által körülvett elhalt adipocitákból állnak (8–10). Eredetileg a zsigeri és a szubkután zsírban azonosították ezeket a gyulladásos gócokat az utóbbi időben elhízott nők és egerek mell fehér fehér zsírszövetében, ahol CLS-B-nek hívták őket, emlőt jelölő „B” -nek (11–13). Meglepő módon a CLS-bőség általában nő a testtömeg függvényében, mind az emlőben, mind az egyéb zsírraktárakban (8–12, 14). Ezekkel a megfigyelésekkel összhangban a génexpressziós elemzések azonosították az elhízott nők mellszövetében a makrofág markerek szelektív dúsítását (14). Fontos hangsúlyozni, hogy a CLS-B jelenléte és az elhízás közötti kapcsolat nem lineáris: néhány elhízott egyénnél hiányzik a felesleges (vagy bármilyen kimutatható) CLS, míg a soványak kisebbségénél jelentkezik a zsírgyulladás ezen jele. Ezért az elhízással járó gyulladás következményeinek megcélzása szempontjából a BMI önmagában nem elegendő a veszélyeztetett betegek kiválasztásához.
A genetikai és az étrend által kiváltott elhízási modellek alkalmazásával nemrégiben bebizonyosodott, hogy az NFκB jelátvitel és a COX-2, TNFα és IL-1β expressziója mind az emlőmirigyekben, mind az elhízott nőstény egerek zsigeri zsírjában megnő (12). Fokozott NFκB jelátvitelt és citokin expressziót detektálnak az emlőmirigy sztrómás-vaszkuláris frakciójában, összhangban a makrofágokban legalább részben bekövetkező up-szabályozással. Hasonló hatásokat figyeltek meg elhízott nők gyulladt mellfehér zsírszövetében (11, 13). Tehát mind az elhízott egereknél, mind a nőknél a mell szöveteiben szövettani és molekuláris zsírgyulladás lép fel, amely az egeret az emberi betegség modelljeként érvényesíti (11, 12).
Fontos, hogy az ösztrogén receptor α (ERα) -függő génexpresszió (pl. Progeszteron receptor; PR) aktiválódását a zsírgyulladás következtében mind egér emlőzsír-párnákban, mind emberi emlőben megfigyelték. Ennek a megfigyelésnek a jelentőségét növeli az a tudat, hogy az ösztrogén jelátvitel valószínűleg kulcsfontosságú szerepet játszik az elhízással összefüggő emlőrákban (11–13). Az emberi mellrák kb. Kétharmada expresszálja az ERα-t, és az ösztrogén és az ösztrogén receptor szignalizáció fontosságát a mell neopláziájában világosan szemlélteti a korai menopauza és az oophorectomia védőhatása, valamint a szelektív ösztrogén receptor modulátorok (SERM) és az aromatáz hasznossága. inhibitorok a betegség megelőzésében és kezelésében (23, 24). Ezen túlmenően az ösztrogén-metabolitoknak karcinogén aktivitását javasolják, függetlenül az ER-jeltől (25). Ezért az ösztrogénnel szabályozott gén fokozott expressziójának bemutatása arra utal, hogy az elhízással járó gyulladás kritikus szerepet játszik a posztmenopauzás emlőrák patogenezisében.
A fehér zsírszövet gyulladásának lokális és szisztémás hatásai
Klinikai-transzlációs előrelépések
Az 1. ábrán bemutatott elhízás-gyulladás tengely azonosítása keretet nyújt racionális beavatkozások tervezéséhez az elhízással összefüggő emlőrák kockázatának csökkentése és a prognózis javítása érdekében. Fontos, hogy az emlő fehér zsírszövet gyulladását csökkentő beavatkozások valószínűleg jótékony hatással vannak más zsírraktárakra és rosszindulatú daganatokra is. A potenciális stratégiák nagyjából három csoportra oszthatók; olyanok, amelyek a zsírgyulladás enyhítését célozzák, azok, amelyek a diszregulált gyulladásos jelátviteli utak kulcsfontosságú elemeit célozzák meg, és amelyek a zsírgyulladás daganatbiológiára gyakorolt következményeinek orvoslására törekednek. Kevéssé ismert ezeknek a különböző stratégiáknak az elhízással kapcsolatos daganatos megbetegedések kockázatának csökkentésére vagy a prognózis javítására gyakorolt potenciális haszna. Ezeket a lehetséges stratégiákat az alábbiakban vesszük figyelembe.
A zsírgyulladás csökkentése
Jelenleg több fogyókúra kapható. A szimpatomimetikus gyógyszerek (pl. Fentermin) étvágycsökkentőként hatnak. A fentermin és a görcsoldó topiramát kombinációs készítményét nemrég jóváhagyta az Élelmiszer- és Gyógyszerügyi Hatóság. A 2012-ben szintén jóváhagyott Lorcaserin agonistaként működik az 5-HT-2C receptoron, ezáltal növelve a jóllakottság érzetét, míg a hasnyálmirigy-lipáz inhibitor vagy az orlisztát csökkenti az étkezési zsír felszívódását. Ezen gyógyszerek mindegyikével elért súlycsökkenés mértéke azonban szerény és visszafordítható a gyógyszer abbahagyása után. Tudomásunk szerint a meglévő súlycsökkentő gyógyszerek potenciális haszna az elhízással összefüggő fehér zsírszövet-gyulladás csökkentésében vagy a rák kialakulásának vagy progressziójának modulálásában bizonytalan. Ezért figyelembe kell venni a hatékony testsúly-szabályozó szerek azon lehetőségét, hogy modulálják az elhízással összefüggő rák kockázatát vagy javítsák az eredményeket, valamint a cukorbetegség és a kardiovaszkuláris kockázat szempontjából szélesebb körben észlelt előnyeiket.
A jelentős és tartós fogyás leghatékonyabb kezelése a bariatrikus műtét, beleértve a Roux-en-Y gyomor bypass-ot és a gyomor sávosodását. A gyomor bypass műtét gyakran társul a II-es típusú cukorbetegség teljes remissziójához, bár a jobb inzulinérzékenység gyors időkerete gyakran megelőzi a jelentős súlyvesztést (69, 70). Feltűnő, hogy a betegek szubkután fehér zsírszövetében a gyomor bypass műtét után 3 hónappal csökkent makrofág sűrűség és csökkent stromalis vaszkuláris frakció expressziója figyelhető meg a makrofágok toborzásáért (8). Ezek a megállapítások a bariatrikus műtétet javasolják a tartós fogyás és a gyulladás megszüntetésének lehetséges útjaként. Nevezetesen a rákos megbetegedések és a mortalitás szignifikáns csökkenését azonosították a gyomor bypass betegeknél az elhízott kontrollalanyokkal összehasonlítva mind retrospektív, mind prospektív vizsgálatokban (71, 72). Csökkent rákos megbetegedéseket figyeltek meg nőknél, de férfiaknál nem (71).
A gyulladásos jelzés célzása
Bizonyos típusú lipidek gyulladáscsökkentő hatással bírnak. Az n-3 többszörösen telítetlen zsírsavak (PUFA-k), beleértve a dokozahexánsavat (DHA) és az eikozapentaénsavat (EPA), gátolhatják a gyulladást. A közelmúltban a makrofágokon található G-fehérjéhez kapcsolt GPR120 receptort azonosították az n-3 zsírsavak szenzoraként, amely aktivál egy β-arrestin/TAB1 jelzőrendszert, amely a TLR4 jelátvitel gátlását eredményezi (73) (1. ábra). Az n-3 zsírsavak, a halolaj alkotórészei, szintén aktiválhatják a peroxiszóma proliferátor által aktivált γ (PPARγ) receptort, és blokkolhatják a proinflammatorikus mediátorok NFκB által közvetített indukcióját (76). Ezeknek a hatásoknak megfelelően az étrendi n-3 PUFA adagolása elnyomja a zsírgyulladást és a hiperinsulinémiát az egér elhízási modelljeiben (77, 78). Az étrendi n-3 PUFA-k és az emberi emlőrák előfordulásának epidemiológiai elemzése kétértelmű eredményeket hozott (79). Érdekes módon azonban egy nemrégiben készített jelentés egy mexikói eset-kontroll vizsgálatban azonosította az n-3 PUFA fogyasztásának védő hatását elhízott nőknél (80). Ezek az adatok együttesen az n-3 PUFA-k lehetséges alkalmazását javasolják az elhízással járó gyulladás és az ebből következő neoplasztikus kockázat csökkentésére.
Az úgynevezett kalória-korlátozás utánzó szerek szintén potenciálisan hasznosak az NFκB aktivációjának blokkolásában és a gyulladás elnyomásában. Ezekről a szerekről úgy gondolják, hogy kedvezően modulálják a kalória-korlátozás által szabályozott anyagcsere- és stressz-válaszutakat anélkül, hogy a kalóriabevitelt ténylegesen csökkentenék. Nem meglepő, hogy ezek a vegyületek (pl. Resveratrol, rapamicin, metformin) a gyulladásban, a növekedési faktor szignálozásában (különösen az inzulin/IGF-1), az oxidatív stresszben és a tápanyagok metabolizmusában vesznek részt (81, 82). A szőlőben és néhány bogyóban bőségesen előforduló polifenol-vegyület, a rezveratrol pleiotróp aktivitással rendelkezik, beleértve a sirtuin-1 (SIRT-1) aktiválását és az NFκB jelátvitelének elnyomását, amelyek valószínűleg hozzájárulnak a magas zsírtartalmú étrend okozta zsírgyulladás csillapításához egerekben ( 83).
A bakteriális eredetű immunszuppresszáns rapamicin hatásait leginkább az mTOR-komplex 1 (mTORC1) - a sejtnövekedés központi szabályozójának - gátlásának képessége alapján értjük, amely a növekedési faktor jelátvitelének, a tápanyagok, az energia és az oxigén rendelkezésre állásának integrálásáért és a nettó jel fordításáért felelős. a transzlációs aktivitás megfelelő szintjének biztosítása a cellán belül. Az mTOR gátlás gyengíti az inzulin/IGF-1 jelátvitelt, amely az elhízás egyik fő szabályozatlan útja. Ezenkívül a rapamicin által közvetített mTOR gátlás blokkolhatja az NFκB jelátvitel aktiválódását is (84).
Elhízás és rákterápia
Valószínűnek tűnik, hogy a mell fehér fehér zsírszöveti gyulladása vagy a keringő tényezők kapcsolódó változásai, például az inzulin megnövekedése hatással lesz a tumor biológiájára, és több mechanizmus révén csökkenti a kezelés hatékonyságát. Amellett, hogy megkísérli csökkenteni a zsírgyulladást vagy célozni a gyulladásos jelátviteli utakat, elhízott egyéneknél specifikus utakat és folyamatokat kell megcélozni a daganatokon belül. Egy nemrégiben végzett preklinikai vizsgálatban az IKKβ/mTOR/VEGF jelátviteli utat elhízott egerek emlődaganataiban proinflammatorikus TNFα aktiválta (104). Érdekes, hogy ennek az útnak a gátlása klinikailag elérhető gyógyszerekkel, beleértve az aszpirint, a rapamicint és a bevacizumabot, csökkentette az elhízás által közvetített tumorgenezist. Hogy egy ilyen megközelítés működne-e a nőknél, nem tudni. Az AMPK aktivitása csökken az elhízásban és a metabolikus szindrómában (88). Mint fent említettük, kiterjedt preklinikai bizonyítékok állnak rendelkezésre arra vonatkozóan, hogy az AMPK aktiválása hasznos tumorellenes megközelítés lehet, és ez klinikai vizsgálathoz vezetett a metformin hasznosságának értékelésére korai stádiumú emlőrákos betegeknél.
Biomarker fejlesztés
A fehér zsírszövet-gyulladás nem invazív biomarkerei hasznosak lehetnek, és szükségük lesz rájuk fokozottan veszélyeztetett egyének azonosításához. A fehér zsírszövet-gyulladás jelenlétéről pontosan beszámoló biomarkerek szintén hasznosak lehetnek a gyulladás csillapítását célzó terápiás beavatkozások hatékonyságának felmérésében. A biomarkerek iránti igényt kiemeli az a megfigyelés, hogy nem minden túlsúlyos és elhízott egyénnél jelentkezik zsírgyulladás vagy kapcsolódó molekuláris változások, míg néhány sovány egyénnél (11.
Az 1. ábrán bemutatott molekuláris útvonal arra utal, hogy a PGE2 szintjének számszerűsítése tájékoztatást adhat a fehér zsírszövet gyulladásának jelenlétéről. A vizelet PGE-M a PGE2 stabil végmetabolitja, amely tükrözi a szisztémás PGE2 szintet (106). Nevezetesen két nemrégiben készült jelentés megállapította, hogy az elhízott nők vizeletében megemelkedett a PGE-M szintje (107, 108). Érdekes módon összefüggést figyeltek meg a vizelet PGE-M magas szintje és a menopauzás utáni emlőrák fokozott kockázata között azoknál a nőknél, akik nem használták rendszeresen az NSAID-okat (107). További vizsgálatokra van szükség a gyulladás e biomarkerének hasznosságának felméréséhez. Hogy ez jobb lesz-e a gyulladás más biomarkereinél, mint például a CRP, nem ismert. A szérum és a plazma vizsgálata folyamatban van egy olyan biomarker aláírás kifejlesztése érdekében, amely beszámol a fehér zsírszövet gyulladásának jelenlétéről. A több véralapú biomarkert tartalmazó algoritmus hasznos lehet a gyulladással összefüggő kockázatértékelésben mind elhízott, mind sovány betegeknél.
Következtetések és jövőbeli irányok
- ÖNÁPOLÁS - A sugárterápia sikerei - Rákellátó Intézet
- Elhízás és hasnyálmirigyrák Az epidemiológiai bizonyítékok és a molekuláris mechanizmusok frissítése -
- Omega-3 zsírsavak és zsírszövet gyulladás és Browning éves táplálkozási áttekintés
- Új tanulmány magyarázatot nyújt az elhízással összefüggő hasnyálmirigyrákra - hasnyálmirigyrák-akcióra
- Elhízás és rák mechanizmusai Daganat mikrokörnyezet és gyulladás Journal of Clinical Oncology