Sejtes metabolikus aktivitás marker transzporter fehérje szelektív bekapcsolási detektálásával nitrobenzoxadiazol alapú fluoreszcens riporter segítségével
Tárgyak
Absztrakt
A nitrobenzoxadiazol alapú fluorpróbát (NBD-Bu) arra tervezték, hogy vizsgálja a rák és a normál sejtek metabolikus aktivitását. Az NBD-Bu szignifikáns fluoreszcencia fokozódást mutat a transzportfehérje szérumalbuminhoz PBS pufferben történő szelektív kötődéssel környezeti körülmények között. Ezen felfedezéssel ösztönözve az NBD-Bu helyspecifikumát versenyképes elmozdulási vizsgálattal vizsgálták helyspecifikus markerek, például warfarin és ibuprofen jelenlétében. Nevezetesen, még a mikromoláris koncentrációknál is, a próba képes arra, hogy hatékonyan kiszorítsa az ibuprofen helymarkert. Ezt követően a nagy felbontású fluoreszcencia képalkotási eredmények megerősítették az NBD-Bu potenciálját a kóros sejtes metabolikus aktivitás kimutatásában.
Bevezetés
A szérumalbumin (SA) a vérplazmában megtalálható leggyakoribb vízoldható fehérje, amely az összes vérplazma fehérje közel 60% -át foglalja el 1,2. A humán szérumalbumin (HSA) 585 aminosavmaradékot tartalmaz egyetlen polipeptidláncban, míg a szarvasmarha-szérumalbumin (BSA), amely 76% -ban homológ a HSA-val, 583 aminosavmaradékkal rendelkezik 1. Sokoldalú transzportfehérjeként funkcionál, kis gyógyszermolekulákat, epesót, hormonokat, vitaminokat, fémeket szállít, és jelentős szerepet játszik azáltal, hogy 80% -ban hozzájárul az erek és szövetek közötti onkotikus nyomás fenntartásához 3,4. Ezenkívül az albuminok felelősek elsősorban a vér pH-értékének fenntartásáért 5,6. Az SA-t adalékként használják a sejttenyésztő táptalajban is, mivel fokozza a növekedést és a sejtek életképességét 7. Az SA magas szintjét súlyos dehidráció és magas fehérjetartalmú étrend váltja ki, míg ennek hiánya a keringési rendszer diszfunkcióját okozza, ami rendkívül fontosnak tartja az SA kimutatását 6 .
Eredmények és vita
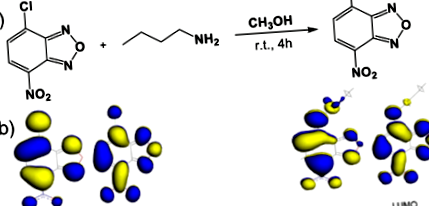
A nitrobenzoxadiazol (NBD) molekularész részt vesz az egyszerű szintetikus eljárásban, és jól ismert a környezeti polaritás iránti érzékenységéről, ezáltal potenciális érzékelője a micellás, valamint a fehérjetartalmú mikrokörnyezetnek. Korábbi beszámolók alapján egy rövid butil-láncot építettek be az NBD-részbe, hogy jobb fluoreszcencia tulajdonságot és megfelelő lipofilitást biztosítsanak a 23 fehérje hidrofób zsebével való jobb kötési affinitás javítása érdekében. Az NBD-Bu szintézisét követően NMR spektroszkópiával (lásd SI, S1–2. Ábra) és tömegspektrometriával (S3. Ábra) jellemeztük. Az optikai tisztaságot az abszorpciós és gerjesztési spektrumok összehasonlításával is megerősítettük (S4. Ábra). Az NBD-Bu tartalmaz egy elektronban gazdag nitrogénatomot, amely egy butillánchoz van kötve, és egy elektronhiányos NO2 csoportot tartalmaz. Ez a két csoport összekapcsolódik keresztül π-konjugált linker, amely klasszikus IKT festékké teszi. Általánosságban az ICT színezékek jól reagálnak az oldószer polaritására, ezáltal polaritásfüggő fotó fizikai viselkedést mutatnak 24 .
Az NBD-Bu (1. séma) IKT tulajdonságainak érvényesítéséhez alapos spektroszkópiai vizsgálatot végeztünk különböző oldószerekkel, változó polaritással. Mind a földi, mind a gerjesztett állapotokban a spektrumok a hosszabb hullámhossz felé tolódtak, a spektrális kiszélesedéssel együtt az oldószer polaritásának növekedésével (1a, b ábra, S1 táblázat, SI). Ezt követően az NBD-Bu fluoreszcencia élettartamát (1c. Ábra) hosszabbnak találták a nem poláros oldószerekben a poláros oldószerekhez képest, amelyek elsősorban a festék és a magasabb nem sugárzási bomlási sebességek poláros oldószerekben. Az emissziós maximumok és a fluoreszcencia élettartama lineárisan változott (1d., S5. Ábra), polaritással megerősítve azt a tényt, hogy az NBD-Bu felhasználható a helyi környezet érzékelésére. Egy ilyen tulajdonság miatt kiváló jelölt a fehérjemolekulák hidrofób zsebében lévő helyi mikropolaritás érzékelése.
(a) Az N-butil-7-nitro-benzo [c] [1,2,5] oxadiazol-4-amin (NBD-Bu) fluorszonda szintetikus sémája (b) az NBD-molekula szubsztitúció előtti és utáni molekuláris orbitális képe ICT-tulajdonságokat mutat.
- Sejtes metabolikus aktivitás marker a szérumalbumin szelektív bekapcsolási detektálásával an
- A zsírszövetből származó fehérje kicsapási módszerek összehasonlítása differenciál gél alkalmazásával
- A sibutramin és a fenolftalein kimutatása funkcionális élelmiszerekben kapilláris elektroforézissel -
- Ételek Ingyenes teljes szövegű Faba bab fehérje koncentrátum módosítása száraz hő felhasználásával a víz növelése érdekében
- Teljes cikk Helyileg előállított fehérjetakarmány-összetevők alacsony fehérjetartalmú étrendben történő alkalmazásának hatásai