Stressz, étel és gyulladás: pszichoneuroimmunológia és táplálkozás a csúcson
Janice K. Kiecolt-Glaser
Pszichiátriai Osztály és az Ohio Állami Magatartási Orvosi Kutatóintézet, Ohio Állami Egyetem Orvostudományi Főiskolája, Columbus, Ohio
Absztrakt
A szív- és érrendszeri betegségek, a rák és a cukorbetegség együttesen az összes halálozás csaknem 70% -át teszi ki az Egyesült Államokban; ezek a betegségek közös gyulladást jelentenek (1-2). Az étrendi stratégiák egyértelműen befolyásolják a gyulladást, ezt dokumentálják mind a prospektív megfigyelési tanulmányok, mind a randomizált, kontrollált etetési kísérletek, amelyek során a résztvevők megállapodnak abban, hogy csak a nekik biztosított ételt fogyasztják (1, 3). Valójában a mechanisztikus vizsgálatok kimutatták, hogy a különféle étrendi összetevők hogyan tudják módosítani a szimpatikus aktivitást, az oxidatív stresszt, a transzkripciós faktor nukleáris faktor kappa B (NF-κB) aktiválódását és a gyulladáscsökkentő citokintermelést, módosítva ezzel az egészségügyi kockázatokat (4).
Viselkedési vizsgálatok meggyőzően bebizonyították, hogy a stressz és a depresszió ugyanezen utakon keresztül is befolyásolhatja a gyulladást. A stresszorok - és az általuk generált negatív érzelmek - fokozhatják a szimpatikus hiperaktivitást, elősegíthetik az oxidatív stresszt, fokozhatják az NF-κB aktivációt és fokozhatják a gyulladásos citokin termelést (5-7).
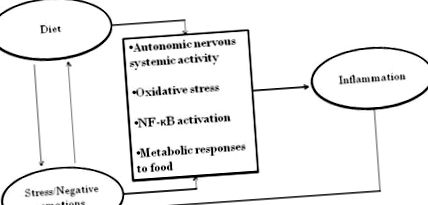
Ha az étrend és a viselkedés együttes hozzájárulása a gyulladáshoz egyszerűen additív lenne, akkor minden bizonnyal fontosak lennének. Az étrend és a viselkedés gyulladáshoz való független hozzájárulásának rövid áttekintése után azonban számos sokkal érdekesebb interaktív lehetőséget fogunk megvitatni: a stressz befolyásolja az ételválasztást; a stressz fokozza az egészségtelen ételek rosszul alkalmazkodó anyagcsere-reakcióit; az étrend befolyásolhatja a hangulatot, valamint a stresszre adott gyulladásos reakciókat - és még sok más, amint azt az 1. ábra szemlélteti. Az a bizonyíték, hogy a sebezhetőségek nem pusztán additívek, lehetőséget nyújtanak az új multidiszciplináris kilátások mérlegelésére.
Figyelemre méltó kétirányú kapcsolatok a gyulladáshoz vezető pszichológiai, étrendi és biológiai útvonalak között.
Diéta és gyulladás
A gyulladást elősegítő étrendekben sok a finomított keményítő, a cukor, a telített és transz-zsírtartalom, és kevés az omega-3 zsírsav, a természetes antioxidánsok és a gyümölcsökből, zöldségekből és teljes kiőrlésű gabonákból származó rost (1). Például az ápolók egészségügyi tanulmányában részt vevő nőknél, akik „nyugatosított” étrendet fogyasztottak (magas vörös és feldolgozott húsokban, édességekben, desszertekben, hasábburgonyában és finomított szemekben) magasabb volt a CRP, az IL-6, az E-szelektin, az sVCAM- 1 és a sICAM-1, mint a „körültekintő” mintázatúakra, jellemzőbb a gyümölcs-, zöldség-, hüvelyes-, hal-, baromfi- és teljes kiőrlésű gabona bevitele (8).
Az ápolók egészségügyi tanulmányának további munkája egyértelműen összekapcsolta a transz-zsírsav-fogyasztást a magasabb gyulladással; például a CRP 73% -kal magasabb volt a nőknél a legmagasabb kvintilisben, mint a legalacsonyabb kvintilisben, és az IL-6 szint 17% -kal volt magasabb a legmagasabbban a legalacsonyabb kvintilisekhez képest (9). A transz-zsírfogyasztás és a gyulladás közötti összefüggés megbízható megállapítás számos ellenőrzött vizsgálatban és megfigyelési tanulmányban (3).
Úgy gondolják, hogy a zöldségek és gyümölcsök antioxidáns tulajdonságai az egyik alapvető mechanizmus a gyulladáscsökkentő étrendi hozzájárulásuk mögött (1). Az élelmiszer-anyagcsere során keletkező oxidálószerek, például szuperoxid gyökök vagy hidrogén-peroxid aktiválhatják az NF-κB utat, elősegítve a gyulladást (4). A magasabb gyümölcs- és zöldségfogyasztás alacsonyabb oxidatív stresszel és gyulladással jár (1, 4). Valójában bizonyos bizonyítékok arra utalnak, hogy az antioxidánsok vagy a zöldségek hozzáadása korlátozhatja vagy akár meg is fordíthatja a magas telített zsírtartalmú ételek gyulladásgátló reakcióit (1, 10).
A teljes kiőrlésű gabonák egészségesebbek, mint a finomított szemek, mert a szénhidrátok finomításának folyamata a rostok, vitaminok, ásványi anyagok, fitotápanyagok és esszenciális zsírsavak nagy részének eltávolítását eredményezi (1). Továbbá, a finomított keményítők és cukrok gyorsan megváltoztathatják a vércukor- és inzulinszintet (1), az étkezés utáni hiperglikémia pedig növelheti a szabad gyökök, valamint a gyulladásgátló citokinek termelését (11). A cukorbetegek étkezés utáni glükózszintjének szabályozására szolgáló gyógyszerek szintén javítják az oxidatív stresszt, az NF-KB aktivációt és a gyulladást, megerősítve ennek az útnak a relevanciáját (12).
Számos kutatási irány vonja maga után a gyulladást a depresszió patofiziológiájában (13–14). Ebből a szempontból a gyulladást fokozó diéták táplálhatják a depressziós tüneteket - és így fokozhatják a gyulladást az alábbiakban ismertetett utakon keresztül. Valójában egy friss cikk azt sugallta, hogy a mediterrán táplálkozási szokások potenciálisan védik a depressziós rendellenességek megelőzését (15). Így az étrend befolyásolja a gyulladást, és az étrenddel összefüggő gyulladás viszont elősegítheti a depressziót - és ahogy az alábbiakban leírjuk, a depresszió viszont elősegítheti a gyulladást.
Depresszió, stressz és gyulladás
A pszichoszociális stressz és a depresszió hozzájárul a fertőzés, az elhúzódó fertőző epizódok és a késleltetett sebgyógyulás kockázatához, mindazokhoz a folyamatokhoz, amelyek előgyulladásos citokintermelést táplálhatnak (16). A stressz és a depresszió azonban fertőzés vagy sérülés hiányában közvetlenül is kiválthatja a proinflammatorikus citokintermelést (17-18). Ezenkívül mind a klinikai depresszió, mind a szindrómás depressziós tünetek érzékenyíthetik vagy előidézhetik a gyulladásos választ, ezáltal hatékonyan elősegítve a nagyobb citokin-növekedést a stresszre adott válaszként, valamint az antigén-kihívást (19-20). Ezenkívül a depresszió és a stressz megváltoztatja a gyulladással kapcsolatos egészségügyi magatartást; például a zavart alvás, a negatív érzelmekre és az érzelmi stresszekre adott válaszok elősegítik az IL-6 termelését (21). Ennek megfelelően a depresszió és a stressz hatékonyan képes modulálni a proinflammatorikus citokinek szekrécióját mind közvetlenül, mind közvetve. Ezen utak révén a depresszió és a stresszes tapasztalatok hozzájárulnak mind az akut, mind a krónikus proinflammatorikus citokintermeléshez (22–23).
Az NF-κB elsődleges hídnak tűnik a proinflammatorikus citokinek és az expressziójukat irányító gének stressz okozta növekedése szempontjából (5). Például az NF-κB aktivitás 341% -kal emelkedett 10 percen belül egy laboratóriumi stresszt követően (5). Ezek a stresszel kapcsolatos változások az NF-κB aktivitásában összhangban állnak más bizonyítékokkal, miszerint a stressz fokozhatja a proinflammatorikus génexpressziót a perifériás vér mononukleáris sejtjeiben (PBMC) (24-25). A noradrenalin stresszel kapcsolatos növekedése provokálja az NF-κB aktivációt, egy közvetlen út az endokrin rendszerből a gyulladás felé (5).
A krónikus stresszorok közvetlenül kiválthatják a proinflammatorikus citokintermelés hosszú távú változásait, valamint közvetett módon az oxidatív stressz elősegítésével, amely aktiválja az NF-κB útvonalat. Például egy hatéves longitudinális vizsgálat kimutatta, hogy a szérum IL-6 átlagos éves növekedési üteme körülbelül négyszer akkora volt azoknál a férfiaknál és nőknél, akiket krónikus stressz okozott demens házastárs gondozása miatt, hasonló gondozás nélküli egyénekhez képest felelősségek (23). Egy krónikusan beteg gyermeket gondozó anyák, valamint az egészséges gyermekek anyáinak mintájánál a stressz jelentésének magasabb szintje az F2-izoprostánok szintjével mérve magasabb oxidatív stressz aktivitással járt (6). Így a stressz és a depresszió fokozhatja a szimpatikus hiperaktivitást, elősegítheti az oxidatív stresszt, fokozhatja az NF-KB aktivációt és fokozhatja a proinflammatorikus citokintermelést (5-7). Az alábbiakban leírtak szerint a többszörösen telítetlen zsírsavak (PUFA-k) szintén ugyanazon az úton hatnak a gyulladás befolyásolására.
Étrendi hatások a hangulatra és a gyulladásos stresszre adott válaszokra: Omega-3 és Omega-6
Az arachidonsavból (AA) származó (omega-6 vagy n-6) eikozanoidok (elsősorban finomított növényi olajokból, például kukoricából, napraforgóból és pórsáfrányból) növelik az IL-1, TNF-α és IL-6 gyulladásgátló citokinek termelését, a prosztaglandin (PG) 2-sorozat (26–27) proinflammatorikus eikozanoidjainak prekurzoraként működik. Ezzel szemben a halban, a halolajban, a dióban, a búzacsírában és egyes étrend-kiegészítőkben, például a lenmagtermékekben található omega-3 (n-3) PUFA-k gátolhatják az AA-eredetű eikozanoidok termelését (26–27). Az n-6 és n-3 PUFA-k ugyanazon anyagcsere útvonalakért versenyeznek, ezért fontos az egyensúlyuk (28). Ennek megfelelően nem meglepő, hogy mind az n-3 PUFA-k magasabb szintje, mind az alacsonyabb n-6: n-3 arány alacsonyabb proinflammatorikus citokintermeléssel jár (29).
A depresszió és a gyulladás (13-14) közötti összefüggések alapján ésszerű azt várni, hogy az étrendi n-3 és n-6 bevitel összefüggésben lehet a depresszióval. Valójában az epidemiológiai vizsgálatok jelentős inverz összefüggéseket mutattak ki az éves halfogyasztás és a súlyos depresszió között - minél több halat fogyasztottak, annál alacsonyabb volt a súlyos klinikai depresszió előfordulása (30). Számos kutató kimutatta, hogy a depressziós betegeknél az n-3 plazmaszintje átlagosan alacsonyabb, mint a nem depressziós betegeknél; továbbá bizonyítékot találtak arra, hogy a depresszió nagyobb súlyossága az n-3 alacsonyabb szintjéhez kapcsolódik (31). Sőt, számos jól kontrollált depresszióval végzett kezelés terápiás előnyöket talált az n-3 kiegészítést követően, bár vannak kivételek is (31). Így ezek a táplálkozási utak mind a viselkedésre, mind a gyulladásra kihatással vannak.
Két kulcsfontosságú n-3 PUFA, az eikozapentaénsav (EPA) és a dokozahexánsav (DHA), jelentősen csökkentheti az LPS által indukált TNF-a expressziót az NF-κB aktiváció blokkolásával (32-33). Ezenkívül az EPA csökkentheti az LPS által indukált TNF-a mRNS-t in vitro is, a TNF-a expresszió modulációja transzkripciós szinten történik (32). Továbbá, amint azt korábban leírtuk, az oxidánsok és az oxidált sejtkomponensek aktiválhatják az NF-KB útvonalat, elősegítve a gyulladást (4); az n-3 PUFA-k csökkentik az oxidatív stresszt is (34-35). Így az n-3 PUFA NF-κB transzkripciós aktivitásának gátlása befolyásolhatja a proinflammatorikus gének expresszióját.
A magas zsírtartalmú ételek stimulálhatják az alacsony fokú endotoxémiát, vagyis a bakteriális endotoxinok, gyulladásos antigének emelkedését, amelyek általában alacsony koncentrációban keringenek a vérben (36). A magas zsírtartalmú ételek szintén indukálhatják az NF-κB aktivációt a PBMC-kben (37). Fontos, hogy az endotoxin-kihívások adatai azt mutatják, hogy az n-3 PUFA-k csökkenthetik ezeket a válaszokat, miközben egyidejűleg modulálják a hipotalamusz-hipofízis-mellékvese (HPA) és a szimpatikus-mellékvese-medulláris (SAM) tengely változását.
A bakteriális endotoxin (LPS) beadása fokozza az NF-KB aktivációt, és akut viselkedési, neuroendokrin és gyulladásos változásokat eredményez; a depresszió viselkedési modelljeként az endotoxin-kihívást követő negatív hangulati tünetek jellemző emelkedését használták (38). A halolaj (amely EPA-t és DHA-t tartalmaz) megváltoztatja ezeket a válaszokat (39–40). Például az ACTH, a noradrenalin és a TNF-a plazmaszintje négyszeres, hétszeres és kétszer alacsonyabb volt az intravénás halolaj-zsír emulziót követően az LPS beadása előtt, összehasonlítva a kezelés nélkül randomizáltakkal; a halolaj is tompította a testhőmérséklet emelkedését a kontrollokhoz képest (40). Azoknál az alanyoknál, akik n-3-kiegészítőket kaptak 3-4 hétig az endotoxin-fertőzés előtt, alacsonyabb volt a noradrenalin, az ACTH, a plazma kortizol- és a testhőmérséklet-válasz, összehasonlítva ugyanezen alanyok válaszaival a placebo-kezelés után; A TNF-α és az IL-6 különbségei nem voltak szignifikánsak ebben a 15 alanyból álló kis mintában (39). Bár a hangulatot egyik vizsgálatban sem értékelték, az étrendi n-3 zsírsavak csillapították az egerek LPS-indukálta depressziószerű viselkedését (41).
Az endotoxin adatait párhuzamosan és kiterjesztve más bizonyítékok arra utalnak, hogy az n-3 PUFA-k befolyásolhatják a pszichológiai stresszorokra adott immunválaszt. Például azok az orvostanhallgatók, akiknek a vizsga előtt alacsonyabb volt a szérum n-3 vagy magasabb az n-6: n-3 aránya, az LPS által stimulált perifériás vér leukociták (PBL) által nagyobb TNF-α és IFN-γ termelést mutattak ki a vizsgák során, mint azok, akiknek magasabb n-3 vagy alacsonyabb arány (26).
Ezenkívül egy idősebb felnőttekkel folytatott másik tanulmány azt sugallta, hogy a depressziós tünetek és az n-6: n-3 arány együttesen működött a gyulladás fokozásán túl, bármelyik változó által biztosított hozzájáruláson túl (28). Bár az előrejelzett citokinszintek meglehetősen konzisztensek voltak az alacsony depressziós tünetekkel járó n-6: n-3 arányokban, a magasabb n-6: n-3 arányok fokozatosan emelkedett TNF-α és IL-6 szintekkel társultak, mivel a depressziós tünetek növekedtek. Ennek megfelelően ezek a tanulmányok (26, 28) arra utalnak, hogy az étrend befolyásolhatja a stresszre és depresszióra adott gyulladásos válaszok nagyságát, valamint a hangulatot.
A stressz befolyásolja az ételválasztást
Laboratóriumi és epidemiológiai tanulmányok egyaránt azt sugallják, hogy a depresszió és a stresszes események kevésbé egészséges ételválasztást motiválnak, bár nagyobb a kockázata annak, hogy női, túlsúlyos és magas pontszámot ér el az étrend korlátozásában (42–43). Például a stressz és a depresszió kevesebb friss gyümölcsfogyasztással, valamint a kínai főiskolai hallgatók nagyobb snack-fogyasztásával járt (44). Női főiskolai hallgatók (de nem férfiak) Németországban, Lengyelországban és Bulgáriában, akik több észlelt stresszről számoltak be, több édességet és gyorséttermet, valamint kevesebb gyümölcsöt és zöldséget fogyasztottak, mint azok, akik kevésbé voltak stresszesek (45). Az Egészségügyi Szakemberek Tanulmányának longitudinális adatai azt mutatták, hogy a férfiak válás vagy gyász következtében csökkentek zöldségfogyasztásuk, az új házasság után pedig nőtt a fogyasztásuk (46). Így általában a stressz és a depresszió elősegíti a kevésbé egészséges ételválasztást, amely fokozhatja a gyulladást. A stressz az alábbiakban ismertetett egészségtelen ételek káros anyagcsere-reakcióinak elősegítésével növeli a problémát.
A stressz befolyásolja az étel anyagcsere-reakcióit
A telített zsírtartalmú étkezés elfogyasztása után egy órán belül a keringő trigliceridek megemelkednek, és 5-8 órán át megemelkedve maradhatnak (47). Az étkezés utáni lipémia (étkezés után kórosan magas lipidszint) a II-es típusú cukorbetegséggel, metabolikus szindrómával, elhízással és fokozott kardiovaszkuláris kockázattal jár (47). Továbbá, amikor a magas zsírtartalmú ételek glükózzal és trigliceridekkel árasztják el a testet, az IL-6 és a CRP tüskéit váltják ki, miközben fokozzák az oxidatív stresszt és a szimpatikus hiperaktivitást is; étkezés utáni diszmetabolizmusnak nevezik, ez a kaszkád elősegíti az endothel diszfunkcióját és így az aterogenezist (48). Az étkezés utáni lipémia vagy az étkezés utáni magasabb csúcsokat, vagy a clearance késleltetését jelentheti, amelyek bármelyike elősegítheti az aterogén-trigliceridekben gazdag maradék lipoproteinek felhalmozódását (49). Fontos, hogy a stressz fokozza az étkezés utáni csúcsokat és késlelteti a kiürülést.
Például egy tanulmány kimutatta, hogy az óránkénti mentális stressz jelentősen megnöveli az étkezés utáni lipémiát; a görbe alatti teljes triglicerin (TG) és a nagyon alacsony sűrűségű lipoprotein-TG területek 50% vagy annál nagyobbak voltak stressz alatt, mint kontroll körülmények között (50). Stoney és munkatársai elegáns tanulmányában az akut stressz az intravénásan alkalmazott zsíremulziót követően is lelassította a triglicerid-clearance-et. A stressz nélküli munkamenethez képest az exogén zsírterhelés megszüntetése átlagosan 14% -kal tartott tovább egy laboratóriumi stresszt követően (51).
Valójában a stressz megváltoztatja a gyomor-nyombél motilitását, lassítja a gyomor kiürülését, és zavarja a béltranzitust és a vastagbél motilitását (52). Valójában, mivel a vagus ideg beidegzi a tápanyagok emésztésében, felszívódásában és anyagcseréjében részt vevő szöveteket, beleértve a gyomrot, a hasnyálmirigyet és a májat, a vagális aktiváció közvetlenül és mélyen befolyásolja az ételek metabolikus reakcióit (53). Például a vagális aktiváció fontos az olyan korai és csúcs inzulin válaszok szabályozásában, amelyek segítenek az étkezés utáni glükózszint szabályozásában (53); viszont az étkezésekre adott glükózválasz segít meghatározni az étkezés utáni gyulladást (48). A depressziónak és a stressznek is jól dokumentált negatív hatása van a vagális aktiválódásra, a pulzus változékonysága alapján (52, 54), ami egy újabb utat jelent, amelyen keresztül a negatív érzelmek befolyásolhatják az étkezés utáni gyulladást. Röviden: az agy és a belek élénk, folyamatos párbeszédet folytatnak.
Multidiszciplináris lehetőségek
A viselkedési adatok relatív ritkaságnak számítanak a táplálkozási szakirodalomban, párhuzamosan a diétás intézkedések ritka használatával a viselkedési vizsgálatok során; a keresztbeszélgetés mindkét fél számára előnyös lenne. Például a krónikus gyulladás az elsődleges anyagcsere-változás, amely a túlzott kalóriabevitelhez és zsírossághoz kapcsolódik, és a kalóriakorlátozás (~ 20-30% -kal kevesebb kalóriafogyasztás, miközben a mikroelem-sűrű ételek maximalizálása és az energiasűrűségű ételek minimalizálása) erőteljes anti- gyulladásos hatások hónapoktól évekig (55). Az étkezés gyakoriságának vagy időzítésének rövid távú megváltoztatása azonban megváltoztathatja a gyulladást is. Például a figyelmes muszlimok nem esznek és nem isznak a nappali órákban a ramadán idején, ami gyakorlatilag egy hónapig tartó, időszakos böjtöt eredményez (56). Az IL-6 és a CRP összehasonlítása egy héttel a ramadán előtt, a ramadán utolsó hetében és 20 nappal a ramadán után azt mutatta, hogy a napi böjt kb. 50% -kal csökkentette az IL-6 és a CRP szintet a ramadán előtti értékekhez képest. csökkenés súlyváltozás hiányában; egy ugyanabban az időben értékelt nem éhgyomri csoport nem mutatott IL-6 vagy CRP változásokat (56).
Ezek a provokatív adatok arra utalnak, hogy a hosszan tartó, szakaszos éhgyomri jelentősen csökkenti a gyulladást. Van-e egyidejű változás a hangulatban? A hosszan tartó, szakaszos éhezés megváltoztatja-e a HPA vagy SAM válaszokat? És fordítva, befolyásolja-e a hangulat a változás mértékét?
A koplalás a kemoterápia hatását is befolyásolja. Például számos agresszív neuroblasztóma sejtvonallal injektált egértörzset 48-60 órán át éheztettek, mielőtt rendkívül nagy dózisú kemoterápiát kaptak (57). A normálisan evő egerek több mint 40% -a halt meg a kemoterápiában; ezzel szemben az összes éhező egér életben maradt, és egyik sem mutatta a toxicitás látható jeleit. A kemoterápia károsítja a DNS-t az osztódó sejtekben, különösen a vérsejtekben; normál sejtekben az éhezés lelassítja a sejtciklust, és így védelmet nyújt. A daganatos sejtek azonban nem reagálnak az éhezésre a sejtosztódás lassításával, és továbbra is magas replikációs arányuk sebezhetőbbé teszi őket a kemoterápiával szemben (57). Az emberen jelenleg zajló klinikai vizsgálatok során (58) minden bizonnyal érdekes lenne megtudni, hogy az éhgyomor milyen hatással van a kemoterápiára adott gyulladásos válaszokra, valamint a depressziós tünetek és a fáradtság egyidejű növekedésére, valamint hogy az éhgyomor megváltoztatja-e a kemoterápia által kiváltott kognitív változásokat (59).
A viselkedési és táplálkozási táborok szélesebb és mélyebb összekapcsolása elengedhetetlen ahhoz, hogy ismereteinket az egyes külön világokban építsük. A mezők közötti erősebb hidak rávilágítanak az elhízással összefüggő betegségeket elősegítő erőkre is. Legalább az étrend szigorúbb értékelése a magatartási vizsgálatokban és a viselkedés rutinszerűbb értékelése az étrendi vizsgálatokban fontos információkat szolgáltatna arról, ami egyébként hibavarianciának tekinthető. Röviden: a stresszorok, a negatív érzelmek és az egészségtelen ételek együttes működésének jobb megértése a gyulladás fokozása érdekében a viselkedési és táplálkozási kutatásoknak, valamint a tágabb értelemben vett orvosbiológiai közösségnek kedvez.
- A táplálkozás jelentősége a tüdő tuberkulózisban Kritikus vélemények az élelmiszer-tudományban és a táplálkozásban
- Jelentett táplálékbevitel és a testzsír megoszlása, ismételt keresztmetszeti vizsgálat Táplálkozás
- A stressz, az alvás, a fizikai aktivitás és az étkezés bizonytalanságának kapcsolata, Amy Lee Richards
- Táplálkozási konzultációk Az étel a Vida
- Kis méretű, nagy táplálkozási főzés magokkal - Ételek és receptek - Földanya élő